心房顫動患者血漿髓過氧化物酶水平與射頻消融術后復發的相關性
黃敏華,孫雁智
上海市寶山區中西醫結合醫院心內科,上海 201900
心房顫動(簡稱房顫)是臨床上常見的心律失常,60歲以上人群的發病率高達1.8%[1]。房顫可能導致心腔內血流動力學異常,易形成附壁血栓,從而導致腦血栓、心肌梗死及心力衰竭等嚴重后果。導管射頻消融術(RFCA)已被廣泛證實為根治房顫轉發和竇性心律維持的安全、有效的方法,手術成功率高,但仍有部分患者可能出現術后復發[2-3]。RFCA的高復發率一直是房顫治療亟待解決的問題,早期預測對于房顫的治療方案選擇及綜合管理具有重要意義。近年來,研究發現髓過氧化物酶(MPO)與房顫發生、發展密切相關,可能參與了RFCA術后復發,但缺乏足夠循證學依據[4]。本文擬對接受RFCA治療的房顫患者術前血漿MPO水平進行分析,探討其對術后復發的影響。
1 資料與方法
1.1一般資料 選擇2017年1月至2018年6月在該院初次接受RFCA治療的房顫患者82例。納入標準:(1)均符合美國心臟協會/美國心臟病學會/美國心律學會(AHA/ACC/HRS)聯合發布的房顫指南[5],有反復房顫發作,并至少有2次經心電圖或動態心電圖證實者;(2)年齡≤80歲;(3)知情同意的患者。排除標準:(1)左心房內徑≤55 mm,無器質性心臟病變者;(2)既往行房顫消融術者;(3)嚴重肺、肝、腎功能不全者。其中男46例,女36例;年齡42~79(61.7±4.5)歲;陣發性房顫61例,持續性房顫21例。本研究均符合《赫爾辛基宣言》,患者或家屬均簽署知情同意書。
1.2方法
1.2.1RFCA治療方法 患者均于術前行超聲心動圖檢查,排除左心房血栓及心臟異常。術前1周停用抗心律失常藥物,術前1 d服用低分子肝素抗凝。局部麻醉下,穿刺右鎖骨下靜脈、左側股靜脈并放置6F血管鞘,送入冠狀靜脈竇和右心室心尖電極,再穿刺右側股靜脈,置入兩根Swartz鞘,送至左心房。給予肝素5 000 U,術中追加,保持活化凝血時間250~400 s。在三維電解剖標測系統(Ensite3000-Navx圣猶達公司,美國)指導下行環肺靜脈隔離術。消融參數設定:功率左心房前壁35 W,后壁30 W,溫控43 ℃,鹽水流速17 mL/min。按照預設徑線進行消融后,結束前用Lasso導管檢測肺靜脈電位確保完全電隔離,無隱匿性傳導恢復。
1.2.2術后隨訪 術后3個月(空白期),規律服用胺碘酮及抗凝藥。術后3個月內出現復發則視為手術失敗。術后前3個月每個月隨訪復查,之后每3個月隨訪復查一次,隨訪內容包括詢問臨床癥狀,12導聯心電圖和24 h動態心電圖檢查。復發標準參考文獻[6],若術后3個月起出現房顫、心房撲動、房性心動過速,且發作持續時間≥30 s則判定為房顫復發。根據術后3~12個月是否復發分為復發組(n=30)、未復發組(n=52)。
1.3觀察指標 收集患者的性別、年齡、身高、體質量、房顫類型、房顫病程等臨床基本資料,采用GE公司生產的LOGIQ C9彩色超聲診斷儀,選擇左心室長軸切面位置,在竇性心律下測量患者同一心動周期的心功能指標,測量左心房內徑(LAD)等心功能招標,取5個心動周期的平均值作為最終值,并采用Simpson法計算左心室射血分數(LVEF)。術前抽取空腹肘靜脈血3 mL,檢測總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)等血脂指標。同型半胱氨酸(HCY)、C反應蛋白(CRP)等炎癥指標,采用酶聯免疫吸附法(ELISA)測定血漿中MPO水平,試劑盒由上海酶聯生物科技有限公司提供,嚴格按照說明書操作。根據吳建榕等[7]研究結果,以血漿MPO值94.1 ng/mL為臨界值,將患者分為低MPO組、高MPO組。
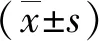
2 結 果
2.1復發組和未復發組臨床基本資料比較 與未復發組比較,復發組患者持續性房顫比例、病程、LAD、HCY、CRP、MPO水平均明顯升高,HDL-C水平明顯下降,差異均有統計學意義(P<0.05),而兩組年齡、性別、BMI、LVEF、TC、TG、LDL-C比較,差異均無統計學意義(P>0.05)。見表1。
2.2高MPO組和低MPO組患者術后復發率比較 低MPO組復發47例,高MPO組復發35例。與高MPO組比較,低MPO組隨訪6、12個月時術后復發率均明顯降低,差異有統計學意義(P<0.05)。見表2。

表1 復發組和未復發組臨床基本資料比較

續表1 復發組和未復發組臨床基本資料比較

表2 高MPO組和低MPO組患者術后復發率比較[n(%)]
2.3RFCA術后復發的多影響因素分析 以隨訪1年后是否復發(復發=1,未復發=0)為因變量,將房顫類型(陣發性房顫=0,持續性房顫=1)、病程、LAD、HCY、CRP、MPO作為自變量引入模型進行多因素逐步logistic回歸分析。結果顯示,陣發性房顫、病程、LAD、HCY、MPO均是RFCA術后復發的獨立危險因素(P<0.05)。見表3。

表3 RFCA術后復發影響因素的logistic回歸分析
3 討 論
RFCA治療房顫的優勢已被廣泛證實,但高復發率的問題始終無法得到有效解決。有研究顯示,首次消融后1~5年復發率為11%~29%,重復消融后復發率為7%~24%,且并發癥發生率約為5.3%[8]。目前,RFCA術后復發的機制尚不十分明確,多數觀點認為其與心房的電重構、結構重構、心房纖維化、炎性反應、氧化應激水平等多種因素密切相關[9]。盡管如此,臨床上對房顫RFCA術后復發的預測能力仍不盡如人意。因此,尋求更多預測因素將為房顫RFCA術后易復發患者的早期甄別、術式選擇及臨床干預提供更有力的理論依據。
在本研究中,持續性房顫、LAD是RFCA患者術后復發房顫的獨立危險因素,且復發組的病程明顯長于未復發組,與以往研究相符[10]。長期的房顫可導致心房肌細胞內鈣超載、心房肌細胞損傷,進而促使炎癥的發生,且隨著心房重構不僅使轉為竇性節律和維持竇性節律的概率下降,還會進一步促進房顫發展,形成房顫致房顫的惡性循環[11]。有研究認為,HCY可能參與了房顫的電重構[12-13]。本研究發現,術前同型半胱氨酸水平可作為房顫患者術后復發的獨立預測因素,對于合并高同型半胱氨酸血癥的房顫患者能否通過降低HCY水平達到減少復發的風險仍有待進一步研究。
MPO作為一種由中性粒細胞產生的過氧化物酶,已成為評價血管炎性反應的重要生物標志物,其水平的高低與組織浸潤程度密切相關[14]。MPO參與多種病理生理過程,其水平升高及活性增加可促進動脈硬化形成、損傷內皮功能、降低斑塊穩定性,從而誘發急性冠脈綜合征(ACS),常用于冠心病的發病及心血管事件的預測[15-16]。有研究發現,中性粒細胞活化是ACS的早期原發事件,MPO的合成與分泌早于心肌損傷,而非心肌損傷所致,外周血MPO水平的升高先于CRP等炎性介質,是預測心臟損傷的良好指標[17]。本研究顯示,與高MPO組比較,低MPO組隨訪6、12個月時術后復發率均明顯降低,且血漿MPO是RFCA術后復發的獨立危險因素,與吳聰等[18]研究結果一致,推測可能與MPO誘發心肌纖維化有關。有研究認為,MPO可通過催化合成次氯酸等反應性物質,誘導上調基質金屬蛋白酶(MMPs)的活性和表達水平,后者是參與心肌組織纖維化的關鍵酶,從而造成心房電重構和結構重塑[19]。PULLI等[20]研究發現,中性粒細胞來源的MPO是心肌纖維化必不可少的介質,術前血漿MPO水平越高,心房纖維化程度越重,RFCA術后房顫復發率越高。
綜上所述,房顫患者的術前血漿MPO水平與RFCA術后復發密切相關,可作為RFCA患者術后復發的獨立評估指標之一。鑒于本研究為回顧性分析,樣本量有限,MPO水平干預的臨界值仍需進一步研究。

