TKIs聯合自體造血干細胞移植治療成人費成染色體陽性急性淋巴細胞白血病的Meta分析
隆耀瑩,徐柳月,唐曉瓊
重慶醫科大學附屬第一醫院血液內科,重慶 400016
費城染色體陽性急性淋巴細胞白血病(Ph+ALL)是一組預后極差的惡性血液系統腫瘤。僅用標準化療方案治療的成年Ph+ALL患者預后非常差。盡管誘導化療的完全緩解(CR)率高達90%,但緩解持續時間短,5年總體生存率(OS)不超過20%[1]。而異基因造血干細胞移植(allo-HSCT)是Ph+ALL有效的治療手段,尤其是首次CR狀態下移植,但移植后仍有39%的復發率和67%的病死率,長期生存率僅為38%[2]。酪氨酸激酶抑制劑(TKIs)的出現使Ph+ALL的治療療效顯著改善[3]。研究報道,針對Ph+ALL,TKIs聯合化療CR率可達92%,4年總體生存率達38%,但復發率與病死率仍然較高[4]。而與TKIs聯合化療相比,TKIs聯合allo-HSCT治療使Ph+ALL患者的OS、無病生存率(DFS)均提高到75%[5]。因此,目前TKIs聯合allo-HSCT已經成為治療Ph+ALL的一線方案。對于年齡大、由于無合適供者及移植費用高等原因而無法進行allo-HSCT的患者,自體造血干細胞移植(auto-HSCT)是否可以考慮作為一種替代治療方案?近年來,TKIs聯合auto-HSCT治療Ph+ALL的研究備受關注,有研究表明TKIs聯合auto-HSCT可以改善患者OS和DFS[6]。但與TKIs聯合allo-HSCT相比,TKIs聯合auto-HSCT治療Ph+ALL的作用和有效性仍存在爭議。本研究旨在探討TKIs聯合auto-HSCT與TKIs聯合allo-HSCT治療Ph+ALL的療效差異,為臨床醫生針對Ph+ALL患者制訂個體化治療方案提供依據。
1 資料與方法
1.1一般資料
1.1.1研究類型 隨機對照試驗(RCT)、隊列研究,語種不限。
1.1.2研究對象 已確診為Ph+ALL的患者,年齡>15歲,國籍、種族不限。
1.1.3干預措施 (1)auto-HSCT組:TKIs聯合auto-HSCT。(2)allo-HSCT組:TKIs聯合allo-HSCT。
1.1.4觀察指標 主要指標:OS、DFS、非復發死亡率(NRM)。
1.2檢索策略 計算機檢索PubMed、Embase、Cochrane library、CNKI、萬方、維普等數據庫,收集有關TKIs聯合造血干細胞移植治療成人Ph+ALL的研究,檢索日期為建庫至 2019年6月30日。聯合主題詞與關鍵詞進行檢索。中文檢索詞包括“酪氨酸激酶抑制劑”“造血干細胞移植”“費城染色體陽性”“急性淋巴細胞白血病”。英文檢索詞為“tyrosine kinase inhibitors” “hematopoietic stem cell transplantation” “philadelphia chromosome positive” “acute lymphoblastic leukemia”。
1.3文獻篩選、資料提取與質量評價 由2名評價員按照上述納入與排除標準獨立進行文獻檢索、篩選及資料提取。通過閱讀題目及摘要排除明顯不相關的文獻,閱讀全文對文獻進一步篩選。如有分歧,征求第三方意見并通過討論解決。如有需要,通過郵件、電話聯系原始研究作者獲取未確定但對本研究非常重要的信息。提取的信息包括作者、發表年份、樣本量、年齡、性別、疾病情況、隨訪時間、干預措施、結局指標及方法學等內容[7]。納入研究的方法學質量評價采用隊列研究評價工具紐卡斯爾-渥太華量表 (NOS)的8個給分條目和9個給分點進行評價[8]。
1.4統計分析 研究結果由 Cochrane 協作網免費提供的 RevMan 5.3 軟件進行統計分析。使用固定效應模型計算治療對結果影響的匯總估計值,即優勢比(OR)及其95%置信區間(CI)。以P<0.05 為差異有統計學意義。用χ2檢驗(檢驗水準為α= 0.10)結合I2對納入研究進行異質性分析,依據I2結果判斷使用固定效應模型或隨機效應模型。若P>0.1、I2<50%,認為研究結果異質性無統計學意義,采用固定效應模型進行分析;如果P<0.1、I2≥50%,則認為異質性存在統計學意義,分析異質性的可能原因,采用隨機效應模型進行分析。最后使用漏斗圖評估納入文獻是否存在發表偏倚,若圖形呈對稱的倒漏斗狀,則不存在偏倚。
2 結 果
2.1文獻檢索結果 檢索中文、英文共892篇文獻,通過剔除重復記錄152篇、閱讀文題和摘要進行初篩共513篇,剩余227篇供復篩。閱讀全文后,排除不符合納入標準222篇(綜述或其他無關研究、缺乏是auto-HSCT組或allo-HSCT組、研究對象無可用的結局數據)。最終5篇文獻納入評價[6,9-12],均為隊列研究。文獻選取流程如圖1所示。

圖1 文獻篩選流程及結果
2.2納入研究的特點 納入的5篇研究共 872例Ph+ALL 患者,其中auto-HSCT組136例,allo-HSCT組736例。使用的TKIs包括伊馬替尼、達沙替尼、尼洛替尼、帕納替尼等。絕大多數患者在CR期行auto-HSCT或allo-HSCT。納入研究的基本特征見表1。
2.3各指標分析結果
2.3.1OS 共5項研究報道了TKIs聯合auto-HSCT與TKIs聯合allo-HSCT的OS率,共納入患者872例,包括auto-HSCT組136例,allo-HSCT 組736例,異質性檢驗結果顯示各研究之間異質性較低(P=0.35,I2=10%),因此采用固定效應模型進行Meta分析,結果顯示,auto-HSCT組與allo-HSCT 組相比,在患者的總體生存率比較,差異無統計學意義(OR=1.14,95%CI:0.77~1.70,P=0.52)。
2.3.2DFS 在所納入的研究中,共計3項研究報道了auto-HSCT組和allo-HSCT組的DFS,共納入患者107例,其中auto-HSCT組34例,allo-HSCT 組73例,各研究結果間不存在統計學異質性(P=0.50,I2=0%),故而采用固定效應模型進行Meta分析,結果顯示,auto-HSCT組與allo-HSCT組相比,在患者的DFS方面,差異無統計學意義(OR=1.35,95%CI:0.56~3.28,P=0.50)。
2.3.3NRM 在所納入的研究中,共計2項研究對NRM進行了報道。共納入患者765例,其中auto-HSCT組102例,allo-HSCT組663例,各研究結果間存在統計學異質性(P<0.001,I2=96%),因此采用隨機效應模型進行Meta分析,結果顯示,auto-HSCT組與allo-HSCT組比較,在患者的NRM率方面,差異無統計學意義(OR=0.42,95%CI:0.00~60.76),P=0.73)。
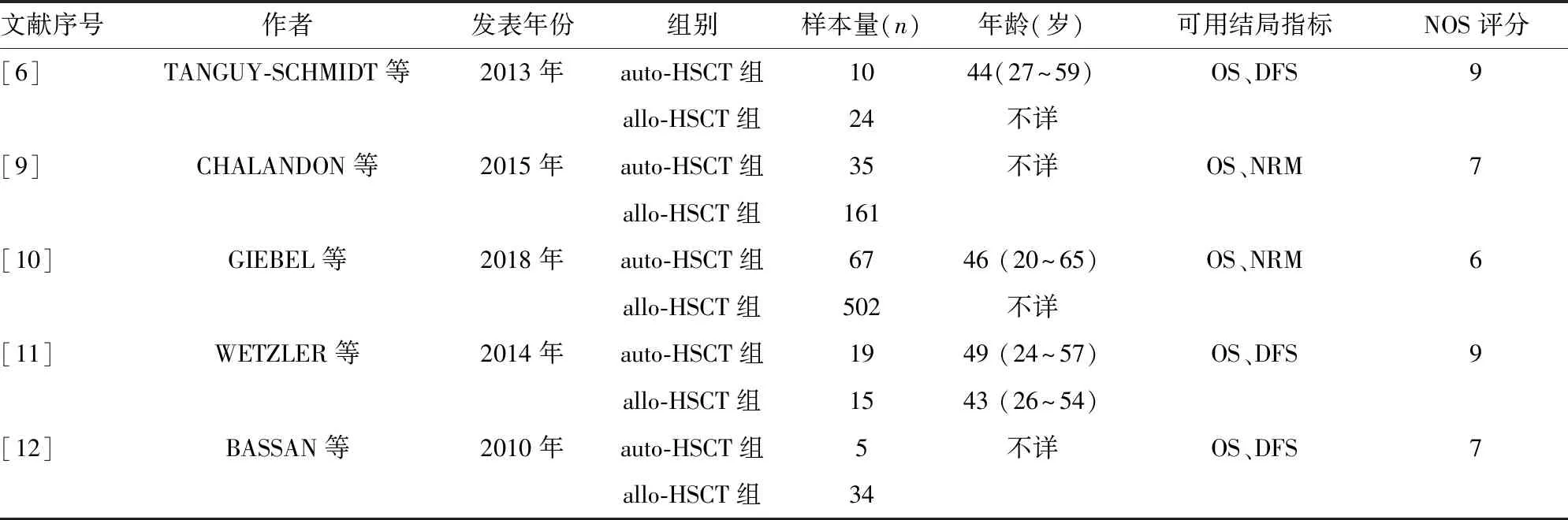
表1 納入研究的基本特征
3 討 論
Ph染色體陽性被認為是ALL的一個非常高的風險特征,在成人ALL中的發病率約30%,Ph+ALL是一組預后極差的惡性血液系統腫瘤[13]。隨著TKIs的問世,國內外多項研究證實TKIs在Ph+ALL的治療中扮演著重要角色。無論使用第一代TKIs伊馬替尼,還是第二代抑制劑達沙替尼、尼洛替尼或第三代抑制劑泊那替尼,聯合化療誘導治療CR率均超過90%[14-17]。
近年來,伊馬替尼聯合allo-HSCT治療Ph+ALL的相關研究表明,伊馬替尼聯合allo-HSCT雖然降低患者的病死率及并發癥,但部分患者因年齡大、無合適供者及移植費用高等原因而無法進行allo-HSCT。因此,TKIs聯合auto-HSCT治療Ph+ALL引起了研究者的重視,然而是否有TKIs聯合allo-HSCT治療Ph+ALL相似的療效,結論尚不確定。
國外一項研究根據治療的時間段分為1996-2001年、2002-2006年、2007-2010年,分別代表未接受伊馬替尼、部分接受伊馬替尼和全部接受伊馬替尼,結果發現,177例Ph+ALL患者auto-HSCT術后3年OS分別為16%、48%和57%,DFS分別為11%、39%和52%,表明OS和DFS逐年明顯增加[18]。
本Meta分析目的是比較TKIs聯合auto-HSCT與TKIs聯合allo-HSCT治療Ph+ALL患者的療效,以期為臨床醫生在工作中治療Ph+ALL和改善患者預后提供依據。研究結果發現,TKIs聯合auto-HSCT與TKIs聯合allo-HSCT在OS、DFS、NRM方面的差異均無統計學意義(P>0.05)。這說明對于成人Ph+ALL患者,TKIs聯合auto-HSCT和TKIs聯合allo-HSCT在OS、DFS、NRM方面均有相似的獲益。LI等[19]研究表明,移植前TKIs聯合化療較單純化療可以降低BCR-ABL基因水平;而DOMBRET等[20]研究表明,移植前BCR-ABL基因陰性預示著較高的DFS和OS。本研究納入的患者均在移植前使用TKIs聯合化療,結果發現,TKIs無論是聯合auto-HSCT還是聯合allo-HSCT,都能使Ph+ALL患者在DFS、OS方面一致獲益,但結果還需要大樣本量臨床試驗進一步證實。
綜上所述,TKIs聯合auto-HSCT與TKIs聯合auto-HSCT移植治療成人Ph+ALL患者的OS、DFS、NRM無明顯差異。在TKIs時代,雖然allo-HSCT仍然是符合條件的成人Ph+ALL患者首選的治療方法,但目前已經不是唯一的選擇。對于那些對allo-HSCT不耐受的Ph+ALL患者,TKIs聯合auto-HSCT可能讓這部分患者同樣獲益。這結果仍需要更多前瞻性、創新性的研究來驗證。

