經皮內鏡椎間孔入路治療伴后方鈣化腰椎間盤突出癥
張文武,柳申鵬,劉 睿,李庭葦,梁秋冬
經皮內鏡腰椎間盤切除術因能實現靶點手術,在腰椎間盤突出癥的治療中療效顯著,也因具有創傷小、恢復快等特點,逐漸成為治療該疾病的主流技術[1]。隨著脊柱微創外科技術的發展,椎間孔鏡手術適應證不斷擴大,腰椎間盤突出癥合并后方鈣化及腰椎管狹窄癥也由以往的相對禁忌證逐漸成為適應證。目前已有經椎板間入路內鏡下切除鈣化腰椎間盤突出癥的報道[2],臨床效果滿意,但經椎間孔入路微創治療伴后方鈣化腰椎間盤突出癥的相關報道不多。2016年8月~2017年8月,我科采用經皮內鏡椎間孔入路進行椎間孔成形+腰椎間盤突出髓核摘除+神經根松解術治療21例合并后方鈣化腰椎間盤突出癥患者,本研究評估其安全性及有效性,報道如下。
1 材料與方法
1.1 病例資料納入標準:① 主訴為腰痛伴下肢放射性疼痛、麻木,且以下肢癥狀明顯;② MRI、CT檢查顯示腰椎間盤突出,且責任間隙后方(椎管前方)存在鈣化影像改變;③ 責任間隙明確且為單一節段,與影像學資料相一致;④ 非手術治療3個月以上無效。排除標準:① 合并腰椎滑脫、不穩、感染、腫瘤等疾病;② 既往有腰椎手術史;③ 責任節段為2個及以上節段。本組21例,男12例,女9例,年齡28~65(47.78±9.74)歲。L4~514例,L5~S17例。病程3~14(7.05±2.77)個月。
1.2 治療方法
1.2.1術前準備 行腰椎X線(正位、側位、動力位)、腰椎MRI、腰椎間盤CT、雙髖關節X線正位影像學檢查,并行肌電圖檢查。通過詳細詢問病史、體格檢查及閱讀影像學資料進一步明確責任節段。指導患者在手術過程中如何與手術醫師交流及配合,告知患者及時反饋術中可能出現的腰痛、下肢疼痛癥狀。術前靜脈滴注氟吡洛芬酯注射液50 mg。
1.2.2手術方法 患者俯臥位(不能俯臥者則采用側臥位),腹部墊空,調整手術床,使患者腰椎保持輕度后凸以增大椎間孔,利于置入手術內鏡。根據標準腰椎正、側位片確定穿刺位置及穿刺點,穿刺點一般位于中線旁11~14 cm。采用0.5%利多卡因(2%利多卡因5 ml×3支+0.9%生理鹽水35 ml)皮下至關節突關節逐層麻醉,重點是皮下、筋膜層及關節突關節。在穿刺點皮膚做7 mm切口,緩慢穿刺至目標位置,置入導絲,沿導絲由細到粗逐級先置入擴張器,再置入工作套管。置入工作套管的過程中若遇關節突阻擋,則用環鋸切除上關節突外側緣部分骨質,擴大椎間孔至可插入工作套管。透視工作套管開口端位于目標位置。通過工作套管插入椎間孔鏡。連續沖洗下辨別椎管內組織,探查椎管內、神經根周圍組織以及黃韌帶、后縱韌帶情況,用鏡下鉗鈍性分離并夾出椎管內突出的髓核及疑似鈣化組織,可配合鏡下環鋸、骨刀切除更多鈣化組織,仔細清理殘余的鈣化組織及髓核,使用低溫等離子射頻消融止血。探查見神經根、硬膜囊松解徹底并搏動良好,術中行直腿抬高實驗可見神經根滑動,反復沖洗殘存髓核組織,抽吸椎管內積血、積液,退出工作套管,縫合切口,無菌敷料包扎。
1.2.3術后處理 術后48 h內應用抗生素預防感染,并用甘露醇及地塞米松預防激惹性神經根水腫,肌電圖提示存在神經根損害的患者酌情予以神經營養藥物治療。床上練習直腿抬高,防止神經根粘連。術后3 d在腰圍保護下適當下地活動,術后1個月內以臥床休息為主,術后3個月內避免彎腰、負重及劇烈活動,以降低術后復發風險。術后復查腰椎MRI、腰椎間盤CT,定期門診隨訪。
1.3 觀察指標與療效評價記錄手術時間、術中出血量、術后并發癥。采用疼痛VAS評分、Oswestry功能障礙指數(ODI)和改良MacNab療效評定標準評價臨床效果。

2 結果
2.1 手術情況手術時間65~135(87.78±18.09) min;術中出血量10~50(26.00±9.11) ml。20例患者順利完成手術,1例因硬膜囊撕裂馬尾神經疝出轉為開放手術。20例順利完成手術的患者中2例失訪,18例獲得隨訪,時間11~23(17.17±3.88)個月。
2.2 手術前后VAS評分及ODI比較見表1。術后即刻、術后3個月及末次隨訪時VAS評分、ODI與術前比較差異均有統計學意義(P<0.05)。
2.3 臨床療效與并發癥情況術后1個月采用改良MacNab療效評定標準評價臨床效果:優6例,良9例,可2例,差1例,優良率為15/18。1例術后6周影像學檢查提示原節段復發,應患者要求行開放融合手術治療。3例術后復查腰椎間盤CT顯示鈣化組織切除不徹底,但臨床癥狀明顯改善,故未做相關處理。
2.4 典型病例見圖1。
3 討論
3.1 鈣化形成概況近年來,文獻報道[3]伴后方鈣化腰椎間盤突出癥發病率高達4.7%~15.95%,且有逐年增高及發病年齡年輕化趨勢。鈣化的腰椎間盤突出多由破裂型腰椎間盤突出轉變而來,鈣化部分占據椎管或椎間孔部分有效容積,往往提示患者病程較長,解剖結構復雜[4-5]。突出椎間盤后方的鈣化組織常見為椎體終板后緣骨折、后縱韌帶的骨化、椎體后緣骨贅、部分側壁黃韌帶骨化或破裂纖維環骨化,多與椎管內神經根及硬膜等組織緊密粘連,鈣化范圍較大時,常伴有側隱窩狹窄、關節突內聚。在此病理基礎上,若再發生髓核突出并加重,神經根卡壓因素往往持續存在,容易造成神經根急、慢性損害。故突出椎間盤后方存在鈣化的患者若出現明顯神經受壓癥狀,明確診斷后應積極手術治療[6]。
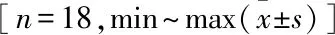
表1 手術前后VAS評分及ODI比較
與術前比較:*P<0.05
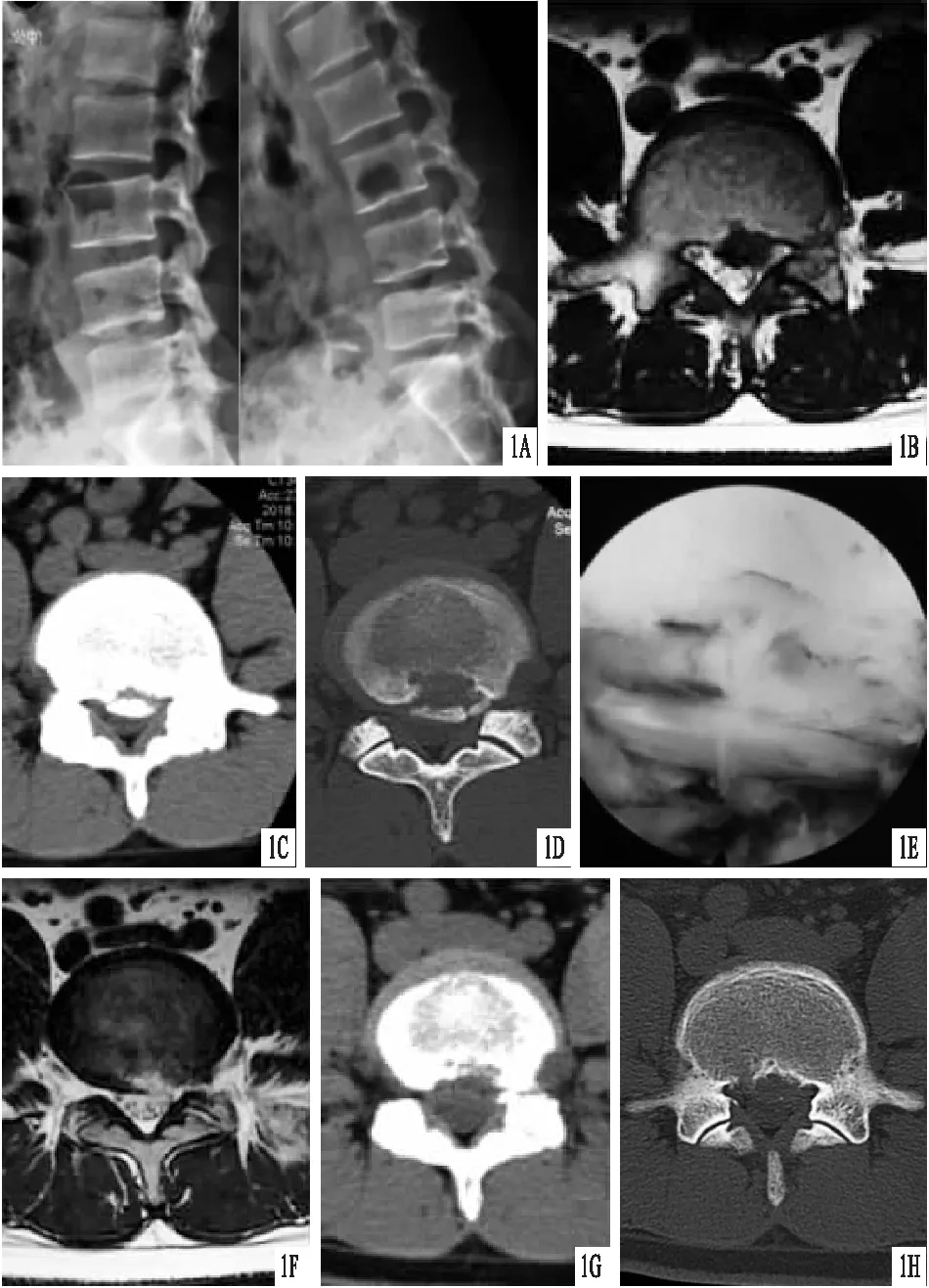
圖1 患者,男,28歲,伴后方鈣化腰椎間盤突出癥 A.術前X線片,顯示腰椎無滑脫、不穩及椎體破壞等情況;B~D.術前MRI橫斷面及CT軟組織、骨窗,顯示L4~5節段椎間盤突出并相應間盤后方存在鈣化影像,左側神經根受壓;E.術中椎間孔鏡下顯露左側L5神經根,松解徹底;F~H.經皮內鏡椎間孔入路行椎間孔成形+腰椎間盤突出髓核摘除+神經根松解術后腰椎MRI橫斷面及腰椎間盤CT軟組織、骨窗,顯示突出髓核及鈣化組織切除徹底,神經根壓迫解除
3.2 手術方式選擇以往受脊柱微創技術水平、微創配套器械及傳統觀念等諸多因素限制,大多數醫生選擇開放手術治療后方伴有鈣化的腰椎間盤突出癥。開放手術常采用開窗、半椎板切除及全椎板切除聯合內固定等術式,因開放手術可在直視下操作,切除突出髓核及鈣化組織較徹底,療效顯著。但開放手術需剝離后方椎旁肌,切除后方部分骨性結構,存在手術創傷較大、出血較多、術后恢復慢等缺點。近年來,脊柱內鏡技術得以迅猛發展,手術適應證范圍獲得擴大,腰椎間盤突出癥合并后方鈣化及腰椎管狹窄癥也由以往的禁忌證逐漸成為適應證[7]。目前,經椎板間及經椎間孔入路內鏡下切除鈣化腰椎間盤突出均可取得滿意療效[2,8]。
3.3 手術操作體會本組20例責任間隙后方伴有鈣化影的腰椎間盤突出癥患者,經皮內鏡椎間孔入路利用鏡下環鋸、骨鑿及咬骨鉗等專用工具對突出髓核及鈣化組織進行切除,均有效解除了硬膜囊、神經根的壓迫,受累神經根得到徹底松解。有學者認為[9],經椎間孔入路暴露范圍有限,很難對鈣化灶完全暴露,且鏡下分離鈣化灶操作困難,存在鈣化物切除不完全現象。目前有諸多文獻提出[8-11],在切除合并鈣化的椎間盤突出時并不需要將鈣化組織完全切除,手術重點應是對受累神經根的減壓。本組有3例患者術后復查腰椎間盤CT顯示鈣化組織切除不徹底,但癥狀均得到顯著改善,故我們也認為,手術目的主要是目標神經根的減壓、松解,不強求切除所有鈣化組織,尤其是硬膜囊后方鈣化,因硬膜囊自身具備緩沖能力,即使存在少許壓迫,一般也不會產生癥狀,而且鈣化為突出椎間盤后方組織結構“穩定”的表現,無需刻意徹底切除。在切除鈣化組織時,可用鏡下環鋸切割鈣化物后分塊取出,可降低損傷硬膜及神經根風險,也可減少髓核鉗及內鏡等器械的損毀。
3.4 手術并發癥及預防經皮內鏡椎間孔入路治療伴后方鈣化腰椎間盤突出癥主要并發癥有出血、硬膜囊撕裂腦脊液漏、神經損傷、減壓不徹底、術后椎間隙感染及術后復發等。① 術中出血:對術野影響大,影響手術進程,我們的經驗是擺體位時腹部要懸空,減少腹壓,術前常規應用止血藥物,可明顯減少術中出血量。當術中硬膜外出血難以避免時,術中除射頻消融止血外,也可用止血材料壓迫出血灶。② 硬膜囊撕裂:此并發癥雖不多見,一旦術中出現,可能就需要轉開放手術。本組1例硬膜囊撕裂患者,既往有椎管內注射藥物治療史,椎管內粘連嚴重,術中旋轉工作套筒時出現硬膜撕裂,馬尾神經疝出,視野受馬尾神經影響,及時改為開放手術。③ 神經損傷:常在椎間孔擴大成形時出現,我們的經驗是,術前詳細研究腰椎間盤CT,測量確定旁開距離、進針點、穿刺方向及角度、關節突關節大小,術中在透視監測下緩慢進行椎間孔擴大成形。④ 術后復發:本組1例術后6周影像學提示原節段復發,應患者要求行開放融合手術治療。黃先育 等[12]認為,腰椎間盤突出復發可能與髓核摘除不徹底或有遺漏有關,往往由靶向穿刺定位不準確所導致。由此可見,術前靶點的確定、穿刺方向和角度的設計至關重要。
綜上所述,經皮內鏡椎間孔入路治療伴后方鈣化腰椎間盤突出癥患者具有創傷小、出血少及術后恢復快等優點,體現了微創理念,也符合腰椎間盤突出癥階梯治療的原則,即便治療結果不滿意,仍可行二次開放手術治療[13]。當然,內鏡下視野有限,操作范圍有限,存在術后癥狀不緩解或復發風險,所以術前需嚴格把握手術適應證,而且需根據術者經驗,結合患者腰椎解剖結構及突出髓核位置選擇合適入路,實現個體化設計是脊柱內鏡手術成功的關鍵。

