訶子酸抗腎間質纖維化的作用及機制研究
柳敏娜,王謹涵,潘 剛,劉天龍,丁 一,席春生
腎間質纖維化是各種慢性腎臟病進展至終末期的共同病理表現,以肌成纖維細胞的增殖及細胞外基質過度沉積為主要特征,導致腎臟功能隨時間進行性下降[1-2]。目前,在臨床上沒有針對腎臟纖維化有效的治療方法。因此,尋找新型安全高效的藥物防治腎間質纖維化和腎功能進展是臨床亟待解決的重大問題。傳統中藥能在機體組織修復過程中發揮良好的治療作用。訶子是使君子科植物訶子或絨毛訶子的干燥成熟果實,其作為藥物最早記載于《唐本草》,在藏藥學經典著作《晶珠本草》中被稱為“藏藥之王”[3]。以訶子為主要成分的中成藥十味訶子片是臨床治療腎炎的常用藥之一[4]。另有研究表明,訶子藥效成分對肝纖維化有顯著抑制作用[5]。本研究以單側輸尿管結扎(UUO)和腎小管上皮細胞缺氧處理制作腎間質纖維化的小鼠和細胞模型,探討訶子藥效成分訶子酸(C41H32O27)對腎間質纖維化的影響及其作用機制。
1 材料與方法
1.1實驗動物與試劑 SPF級雄性C57/BL小鼠購自空軍軍醫大學實驗動物中心,飼養環境為溫度(20±2)℃,濕度45%~60%,小鼠自由飲水、進食。本實驗經動物實驗倫理委員會批準。人腎小管上皮HK-2細胞購自美國ATCC細胞庫。訶子酸(CAS號:18942-26-2)購自成都普瑞法科技開發有限公司。血尿素氮(BUN)和肌酐(Scr)檢測試劑盒購自南京建成生物工程研究所。轉化生長因子-β1(TGF-β1)、α-平滑肌肌動蛋白(α-SMA)抗體購自美國Cell Signaling Technology公司。Klotho、成纖維細胞生長因子2(FGF2)抗體購自美國Abcam公司。
1.2實驗方法
1.2.1小鼠腎間質纖維化模型制作及給藥:根據隨機數字表將36只小鼠分為假手術組、模型組和訶子酸組,每組12只。模型組和訶子酸組行單側輸尿管結扎術制作腎間質纖維化模型。主要步驟:3%戊巴比妥鈉腹腔注射麻醉小鼠,仰臥位固定后,打開左下側腹腔,分離并結扎左側輸尿管后縫合腹腔。假手術組小鼠只分離輸尿管不結扎。造模結束后訶子酸組給予50 mg/kg的訶子酸灌胃治療,假手術組和模型組給予同等體積的生理鹽水灌胃。每天上午固定時間給藥1次,給藥21 d后處死取材檢測。
1.2.2生化指標及腎臟質量指數檢測:每組取6只小鼠麻醉后摘眼球取血,常溫下3000 r/min離心10 min后獲取血清。分別按照試劑盒操作說明檢測血清BUN和Scr水平。小鼠處死后,剝離左側腎臟,并進行稱重,腎臟重量與處死前小鼠體重之比即為小鼠的腎臟質量指數。
1.2.3腎臟病理學觀察:小鼠麻醉后,用生理鹽水和多聚甲醛分別進行灌注固定。腎臟剝離后繼續放入多聚甲醛固定24 h。石蠟包埋處理后切片(5 μm),組織切片根據實驗目的分別進行常規HE染色和Masson染色。病理學結果由不了解實驗分組的病理醫師判讀。每張切片隨機選取腎臟皮質區域6個視野(×200)觀察。
1.2.4免疫組織化學檢測:石蠟包埋的腎臟組織切片后脫蠟脫水處理,用0.3%甲醇-過氧化氫滅活內源性過氧化物酶,用枸櫞酸抗原修復液修復抗原并用血清封閉。根據實驗目的分別滴加anti-TGF-β1(1∶200)和anti-α-SMA(1∶200)抗體后,在4℃冰箱孵育過夜。滴加二抗后室溫孵育1 h。滴加DAB顯色,蘇木素復染。顯微鏡下在腎皮質層隨機選擇5個視野拍照。以前期研究中明確的TGF-β1和α-SMA高表達腎間質纖維化小鼠腎臟組織樣本為陽性判別標準[6]。
1.2.5Western blot檢測:提取腎臟皮質中的總蛋白,BCA法測定蛋白濃度。同體積的樣本加入SDS-PAGE凝膠中電泳分離蛋白,隨后用半干法將蛋白轉移到甲醇活化的PVDF膜上。5%脫脂奶粉封閉1 h后加入anti-Klotho(1∶100)和anti-FGF2(1∶1000)抗體,4℃過夜孵育。二抗室溫孵育1 h后用ECL法顯色。條帶用Quantity One系統曝光拍照。
1.2.6細胞模型制作及給藥:人腎小管上皮HK-2細胞分為對照組、缺氧組、給藥組,均用DMEM培養基在37℃孵箱中進行常規培養(37℃,21% O2,5% CO2)。缺氧組和給藥組細胞轉入三氣培養箱中缺氧培養(1% O2,5% CO2)48 h。給藥組細胞在培養基中加入50 μg/ml的訶子酸進行處理。
1.2.7細胞活力及乳酸脫氫酶(LDH)測定:細胞活力用MTT法檢測,主要操作步驟為3組細胞接種于96孔板,造模給藥處理結束后,更換無血清培養基,加入0.5%的MTT溶液15 μl,孵育4 h后加入二甲基亞砜100 μl振蕩約15 min,酶標儀在490 nm波長處測吸光度值。LDH水平用微板法根據說明書操作,主要步驟為:培養板中依次加入雙蒸水、丙酮酸/待測樣本、基質緩沖液、輔酶Ⅰ、2,4-二硝基苯肼和NaOH溶液,孵育5 min后在450 nm波長處測吸光度值。
1.2.8細胞轉染:Klotho特異性小干擾RNA(siRNA-Klotho)由上海吉凱基因化學技術有限公司合成。根據Lipofectamine 3000轉染試劑操作說明,HK-2細胞(1×106個)進行siRNA-Klotho轉染作為轉染組,24 h后轉染組進行缺氧培養和50 μg/ml的訶子酸處理。然后進行Western blot檢測4組HK-2細胞的Klotho和FGF2蛋白表達水平。

2 結果
2.1腎臟質量指數、BUN和Scr水平比較 假手術組的腎臟質量指數在正常范圍內,而模型組腎臟質量指數較假手術組顯著下降,血清BUN和Scr水平較假手術組均顯著升高(P<0.05)。訶子酸組腎臟質量指數顯著高于模型組,血清BUN和Scr水平顯著低于模型組(P<0.05)。見表1。
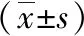
表1 3組小鼠腎臟質量指數、BUN和Scr水平比較
注:BUN為血尿素氮,Scr為血肌酐;與假手術組比較,aP<0.05;與模型組比較,cP<0.05
2.2腎臟病理學觀察 HE染色結果顯示,假手術組腎臟組織結構完好,形態正常。模型組腎臟結構分布錯亂,出現小管上皮細胞萎縮,小管管腔擴張,腎小球硬化。訶子酸組較模型組病理變化明顯緩解。Masson染色結果顯示,模型組腎小管間質出現大量藍色膠原沉積,間質纖維組織增生明顯。訶子酸組的纖維化程度較模型組顯著降低。見圖1。
2.3腎臟組織TGF-β1和α-SMA免疫組織化學檢測 假手術組腎臟組織TGF-β1和α-SMA表達較低。模型組腎小管、間質可見大量的TGF-β1表達和α-SMA沉積。訶子酸組TGF-β1和α-SMA表達水平較模型組顯著降低。見圖2。
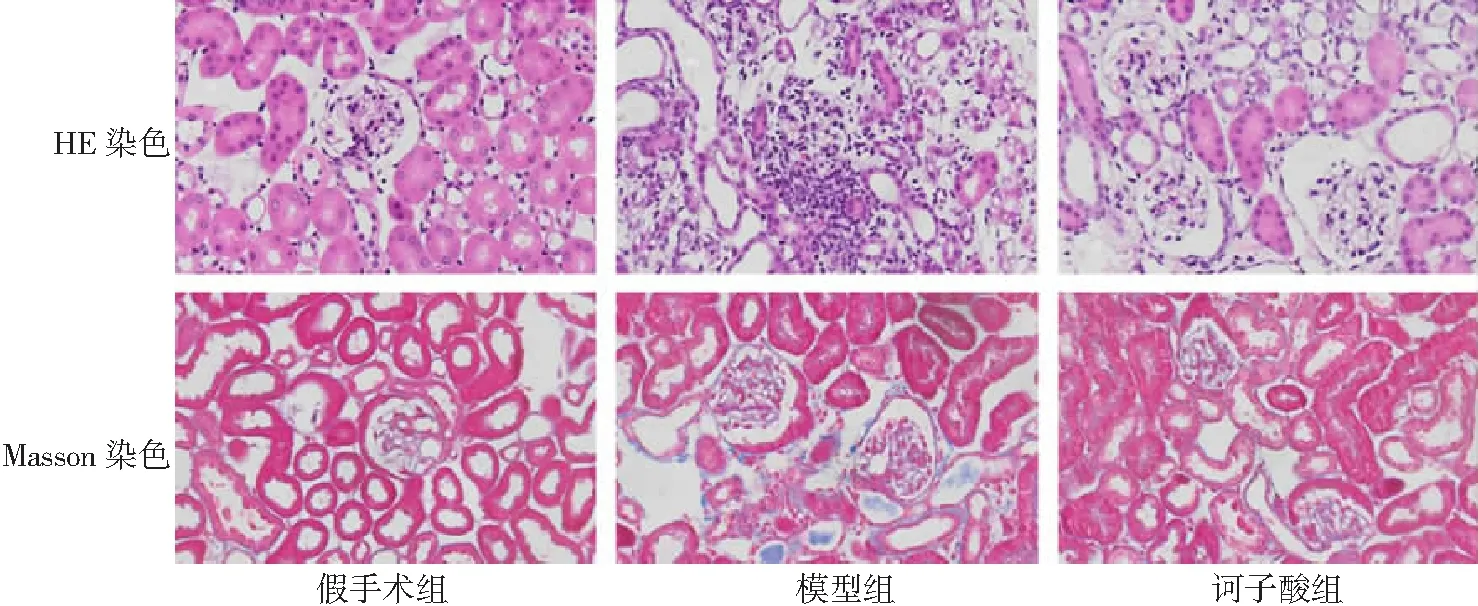
圖1 3組小鼠腎臟組織的HE和Masson染色結果(×200)
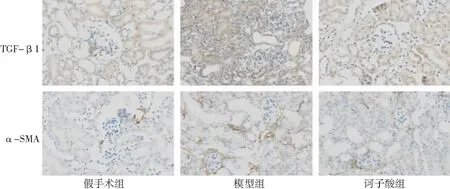
圖2 3組小鼠腎臟組織TGF-β1和α-SMA免疫組織化學染色(×200)TGF-β1為轉化生長因子-β1,α-SMA為α-平滑肌肌動蛋白
2.4腎臟Klotho和FGF2蛋白表達水平 Western blot檢測結果表明,模型組腎臟組織Klotho蛋白表達水平較假手術組顯著下降,FGF2蛋白表達水平較假手術組顯著升高(P<0.05)。訶子酸組腎臟組織Klotho蛋白表達水平顯著高于模型組,FGF2蛋白表達水平顯著低于模型組(P<0.05)。見圖3。

圖3 3組小鼠腎臟組織Klotho和FGF2蛋白表達FGF2為成纖維細胞生長因子2;與假手術組比較,aP<0.05;與模型組比較,cP<0.05
2.5HK-2細胞活力和LDH水平比較 細胞活力實驗表明,缺氧組的細胞活力較對照組顯著下降,而LDH水平較對照組顯著升高(P<0.05)。給藥組的細胞活力顯著高于缺氧組,LDH水平顯著低于缺氧組(P<0.05)。見圖4。
2.6HK-2細胞Klotho和FGF2蛋白表達水平 Western blot檢測結果表明,缺氧組的Klotho蛋白表達水平較對照組顯著下降,FGF2蛋白表達水平較對照組顯著升高(P<0.05)。給藥組的Klotho蛋白表達水平顯著高于缺氧組,FGF2蛋白表達水平顯著低于缺氧組(P<0.05)。轉染組的Klotho蛋白表達水平顯著低于給藥組,FGF2蛋白表達水平顯著高于給藥組(P<0.05)。見圖5。
圖4 3組HK-2細胞的細胞活力及乳酸脫氫酶水平比較
與對照組比較,aP<0.05;與缺氧組比較,cP<0.05
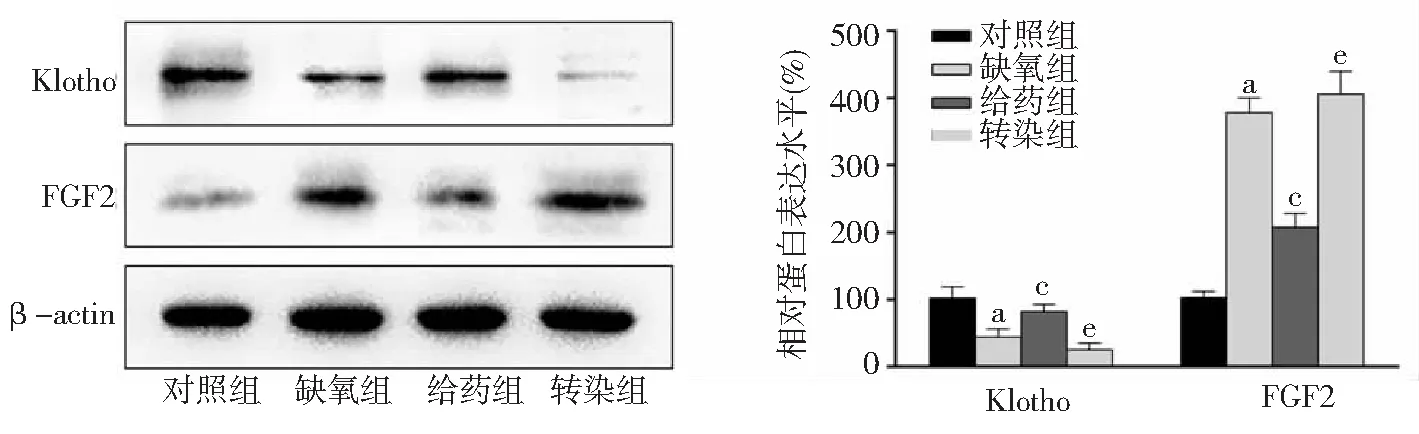
圖5 4組HK-2細胞的Klotho和FGF2蛋白表達FGF2為成纖維細胞生長因子2;與對照組比較,aP<0.05;與缺氧組比較,cP<0.05;與給藥組比較,eP<0.05
3 討論
隨著人口老齡化的加劇以及高血壓病、糖尿病等患病率的增加,慢性腎臟病人群也逐年遞增,目前其全球發病率為10%~15%[7],已經成為一種嚴重威脅人類健康的全球公共衛生問題。諸多研究表明,腎間質纖維化是腎功能逐漸喪失的主要病理因素,且纖維化程度與預后密切相關[8-9]。近年來對腎間質纖維化的分子機制研究有了長足發展,其分子機制也被逐漸揭示,但目前并沒有針對性的有效治療藥物[10]。因此,尋找新型安全高效防治腎間質纖維化和延緩腎病進展的藥物是臨床亟待解決的重大問題[11]。
訶子,又名訶黎、訶黎勒等,在中國古代藥典《唐本草》《金匱要略》《千金方》等中均有記載,在中、藏、蒙醫藥中應用廣泛[12]。訶子化學成分復雜,訶子酸是其主要藥效成分之一[13]。現代研究表明,訶子提取物有顯著的治療糖尿病和腎臟保護作用。另有研究顯示,訶子有效成分可顯著抑制四氯化碳誘導的肝纖維化[5]。這提示訶子酸對腎臟纖維化有潛在的治療作用。本研究中,給予腎纖維化模型小鼠訶子酸治療后,腎功能和病理學纖維化水平均顯著改善,證實了訶子酸的抗腎纖維化作用。
近年來,Klotho蛋白在慢性腎臟病中的重要作用受到越來越多的關注。Klotho是一種抗衰老蛋白,在腎臟組織尤其是近曲小管和遠曲小管細胞膜上高表達[14]。在生理情況下,腎臟作為一個重要的調控器官維持Klotho的高水平狀態,而在慢性腎臟病患者和動物模型中,Klotho的表達顯著降低,且Klotho的降低與疾病進展密切相關[15]。因此,Klotho被認為是慢性腎臟病的重要生物標志物和潛在治療靶點[16]。據報道,小鼠缺乏Klotho后導致壽命縮短、骨質疏松、認知功能障礙及血管鈣化等,過表達Klotho則可延長小鼠壽命,緩解腎臟疾病進展[17]。有研究表明,相比雜合子Klotho小鼠,Klotho敲除小鼠腎臟表型和病理變化明顯加重[18]。相反,相比于野生型小鼠,Klotho在小鼠體內的過表達則可導致纖維化相關蛋白(如Ⅳ型膠原蛋白和α-SMA)表達減少[19]。另一項研究提示,Klotho的缺乏可誘導和促進腎小管間質纖維化的進展,而過表達Klotho后可發揮抗腎纖維化的作用[20]。以上研究提示,Klotho作為腎臟纖維化的重要調控蛋白,可能是訶子酸抗腎臟纖維化的關鍵通路。FGF2是成纖維細胞生長因子家族中的一員,廣泛分布在腎臟、心臟、大腦和肝臟等組織[21]。有研究表明,FGF2可通過誘導肌成纖維細胞標志物高表達,加速腎纖維化的發生[22-23]。本研究中,腎間質纖維化模型小鼠和缺氧誘導的HK-2細胞中,均發現Klotho蛋白表達水平降低,FGF2蛋白表達水平升高,而訶子酸給藥后可顯著逆轉Klotho和FGF2蛋白的表達。說明訶子酸可促進Klotho蛋白表達,同時抑制FGF2蛋白的表達。這表明訶子酸的抗腎纖維化作用與Klotho和FGF2密切相關。但Klotho和FGF2之間的上下游調控關系并不明確。有研究發現,腎間質纖維化模型小鼠腹腔注射Klotho后,可顯著抑制FGF2的表達,進而緩解纖維化進展[24]。因此,本研究為確認Klotho是否調控FGF2,通過在缺氧和訶子酸處理的HK-2細胞中轉染siRNA-Klotho敲減了Klotho的表達。結果發現,轉染siRNA-Klotho后,訶子酸對Klotho的促進作用被顯著抑制,對FGF2蛋白表達的抑制作用被部分逆轉。這表明訶子酸是通過促進Klotho蛋白表達,進而抑制FGF2蛋白表達發揮抗腎間質纖維化作用。
綜上所述,訶子酸可顯著緩解腎臟纖維化水平、改善腎臟功能,其作用機制可能是通過調控Klotho/FGF2通路發揮作用。訶子酸是抗腎臟纖維化的潛在治療藥物。

