戈舍瑞林聯(lián)合替勃龍治療子宮內(nèi)膜異位癥的臨床效果
楊華琴,胡 霞,王 慧,李 剛
子宮內(nèi)膜異位癥為女性常見婦科疾病,多發(fā)于育齡期女性,常表現(xiàn)為痛經(jīng)、慢性盆腔痛、月經(jīng)異常,易導致不孕癥[1]。異位結節(jié)以發(fā)生于卵巢最為常見,即卵巢巧克力樣囊腫。由于囊腫病變體積相對較大,藥物控制不佳,常需進行手術切除。為了保留子宮內(nèi)膜異位癥患者的生育能力,臨床上常采取腹腔鏡保守手術治療,將內(nèi)膜異位的病變切除而保留子宮與卵巢。但保守手術治療容易復發(fā),故通常聯(lián)合藥物治療[2]。促性腺激素釋放激素激動劑(GnRHa)能強烈抑制卵巢功能,使子宮內(nèi)膜萎縮,從而達到治療子宮內(nèi)膜異位癥的目的[3]。臨床常用的GnRHa為戈舍瑞林,但使用后絕經(jīng)期癥狀明顯,會造成骨密度丟失,停藥也易復發(fā)。近年來反向添加雌激素療法在臨床上應用良好,可發(fā)揮藥物間的協(xié)同作用[4]。故本研究回顧性分析108例子宮內(nèi)膜異位癥患者應用戈舍瑞林聯(lián)合替勃龍治療的效果,現(xiàn)報告如下。
1 資料與方法
1.1一般資料 回顧性分析2017年5月—2018年6月眉山市中醫(yī)醫(yī)院收治的子宮內(nèi)膜異位癥患者108例。①納入標準:均符合子宮內(nèi)膜異位癥的診斷標準[5],經(jīng)三合診檢查、B超、腹腔鏡、實驗室檢查、組織病理檢查確診;卵巢巧克力囊腫,子宮內(nèi)膜異位結節(jié)直徑5 cm以上;美國生殖醫(yī)學會制定的子宮內(nèi)膜異位癥分期(r-AFS)為Ⅲ~Ⅳ期;育齡期女性,年齡18~45歲;病例資料與檢查結果齊全。②排除標準:合并子宮肌瘤、子宮內(nèi)膜癌等;合并其他生殖系統(tǒng)疾病;6個月內(nèi)口服避孕藥史;合并肝腎功能不全、內(nèi)分泌疾病;既往盆腔手術史;絕經(jīng)期女性。根據(jù)治療方案不同將患者分為A組30例、B組42例和C組36例。A組年齡24~41(32.66±3.46)歲;囊腫直徑5~10(7.51±1.34)cm;未婚5例,已婚25例,已育16例;r-AFS分期:Ⅲ期19例,Ⅳ期11例。B組年齡19~43(31.57±3.25)歲;囊腫直徑5~9(6.93±1.52)cm;未婚10例,已婚32例,已育18例;r-AFS分期:Ⅲ期28例,Ⅳ期14例。C組年齡26~40(32.86±3.43)歲;囊腫直徑5~10(7.22±1.41)cm;未婚7例,已婚29例,已育15例;r-AFS分期:Ⅲ期21例,Ⅳ期15例。3組年齡、囊腫直徑、婚育情況、r-AFS分期等一般資料比較差異無統(tǒng)計學意義(P>0.05),具有可比性。
1.2方法
1.2.1A組:患者采用腹腔鏡保守手術治療,月經(jīng)后3~7 d進行腹腔鏡手術,全身麻醉誘導成功后,行1 cm長縱切口,常規(guī)建立CO2氣腹,壓力20 mmHg,拔出氣腹針,插入10 cm套管針,穿刺進入腹腔并置入腹腔鏡。檢查上腹部和下腹部,探查腹腔定位。進行粘連松解術,分離盆腔粘連。實施卵巢囊腫剝除術,用有齒爪鉗鉗夾卵巢韌帶,側面旋轉暴露卵巢。卵巢門系膜邊緣包膜切口,暴露囊腫壁,輕輕分離卵巢包膜,將囊腫從卵巢包膜上切割分離。將囊腫送病理檢測。檢查手術創(chuàng)面并止血,縫合剩余卵巢組織。常規(guī)行子宮輸卵管美藍通液檢查,確保輸卵管恢復通暢。術后常規(guī)抗感染治療。
1.2.2B組:患者行腹腔鏡保守手術治療,具體方法同A組,并使用戈舍瑞林(英國AstraZeneca公司,國藥準字J20160052)治療。患者于術后月經(jīng)來潮第1天皮下注射戈舍瑞林3.6 mg,每4周1次,持續(xù)3個月。治療期間每1個月1次門診復查,停藥后每3個月1次門診復查,持續(xù)隨訪1年。
1.2.3C組:患者行腹腔鏡保守手術治療,具體方法同A組,并使用戈舍瑞林聯(lián)合替勃龍(荷蘭N.V.Organon公司,批準文號H20160575)治療。患者于術后月經(jīng)來潮第1天皮下注射戈舍瑞林3.6 mg,用法同B組。第2次皮下注射戈舍瑞林后開始口服替勃龍片每次1.25 mg,每天1次,持續(xù)服用3個月。期間門診復查同B組。
1.3觀察指標
1.3.1臨床療效與妊娠情況:①根據(jù)臨床療效評定標準對治療效果進行評定[6];顯效:子宮直腸陷凹、子宮骶韌帶包塊消失,痛經(jīng)、月經(jīng)異常等癥狀消失;有效:包塊明顯縮小,且痛經(jīng)、月經(jīng)異常等癥狀明顯減輕;無效:包塊、痛經(jīng)、月經(jīng)異常等癥狀無緩解,或緩解后復發(fā)。總有效率=(顯效+有效)/總例數(shù)×100%。②觀察患者治療后1年內(nèi)的妊娠情況,并計算妊娠率。
1.3.2實驗室檢查:①血清癌抗原125(CA125)檢測應用雙抗體夾心法,檢測儀器為Elecsys 1010全自動電化學發(fā)光免疫分析儀(瑞士羅氏公司),使用配套試劑。按照儀器操作步驟,將血清標本與抗CA125單克隆抗體試劑混勻,形成夾心復合物,加入鏈霉親和素包被顆粒,使復合物結合到微粒上,將反應混合液吸到測量池中,微粒通過磁鐵吸附到電極中,采用清洗液重復洗滌,通過光電倍增管在450 nm波長下測定吸光度。②抗子宮內(nèi)膜抗體(EMAb)檢測應用膠體金法,在反應板中滴入待測血清和配套試劑(上海江萊生物科技有限公司),按操作流程5 min后觀察反應孔。陽性:反應孔中顯現(xiàn)清晰的紅色質控線和紅色圓斑;陰性:反應孔中只顯現(xiàn)紅色質控線,無紅色圓斑。
1.3.3不良反應:①觀察患者治療過程中的不良反應,主要包括潮熱多汗、煩躁失眠、肌肉骨關節(jié)痛、骨量減少。②使用女性絕經(jīng)期癥狀Kupperman評分量表評價患者癥狀的嚴重程度[7],總分大于30分為重度,16~30分為中度,6~15分為輕度,小于6分為正常。

2 結果
2.1臨床療效與妊娠情況比較 B組和C組的治療總有效率均明顯高于A組,差異有統(tǒng)計學意義(P<0.05)。B組的治療總有效率與C組比較差異無統(tǒng)計學意義(P>0.05)。3組的妊娠率比較差異無統(tǒng)計學意義(P>0.05)。見表1。
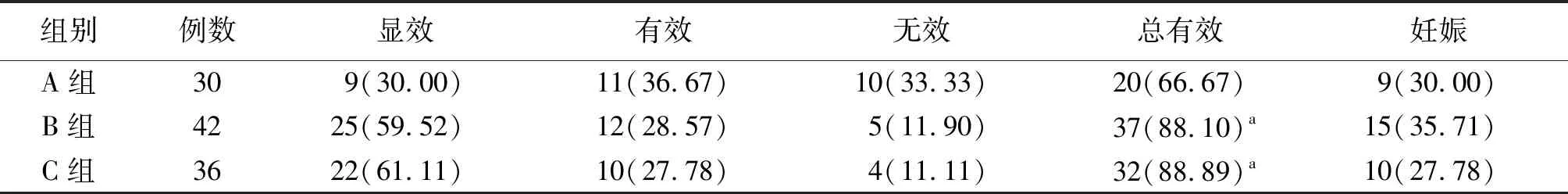
表1 3組子宮內(nèi)膜異位癥患者臨床療效與妊娠情況比較[例(%)]
注:A組采用腹腔鏡保守手術治療,B組在A組的基礎上給予戈舍瑞林治療,C組在A組的基礎上給予戈舍瑞林聯(lián)合替勃龍治療;與A組比較,aP<0.05
2.2治療前后血清CA125水平和EMAb陽性率比較 治療前,3組的血清CA125水平和EMAb陽性率比較差異無統(tǒng)計學意義(P>0.05)。治療后,3組的血清CA125水平和EMAb陽性率均明顯低于治療前,且B組和C組明顯低于A組,差異有統(tǒng)計學意義(P<0.05)。治療后,B組的血清CA125水平和EMAb陽性率與C組比較差異無統(tǒng)計學意義(P>0.05)。見表2。

表2 3組子宮內(nèi)膜異位癥患者治療前后血清CA125水平和EMAb陽性率比較
注:A組采用腹腔鏡保守手術治療,B組在A組的基礎上給予戈舍瑞林治療,C組在A組的基礎上給予戈舍瑞林聯(lián)合替勃龍治療;CA125為癌抗原125,EMAb為抗子宮內(nèi)膜抗體;與治療前比較,aP<0.05;與A組比較,cP<0.05
2.3不良反應比較 B組和C組的Kupperman評分明顯高于A組,且B組明顯高于C組,差異有統(tǒng)計學意義(P<0.05)。B組的潮熱多汗、煩躁失眠、肌肉骨關節(jié)痛和骨量減少發(fā)生率明顯高于A組,潮熱多汗和煩躁失眠發(fā)生率明顯高于C組,差異有統(tǒng)計學意義(P<0.05)。見表3。

表3 3組子宮內(nèi)膜異位癥患者的不良反應情況比較
注:A組采用腹腔鏡保守手術治療,B組在A組的基礎上給予戈舍瑞林治療,C組在A組的基礎上給予戈舍瑞林聯(lián)合替勃龍治療;與A組比較,aP<0.05;與B組比較,cP<0.05
3 討論
子宮內(nèi)膜異位癥主要表現(xiàn)為卵巢巧克力樣囊腫,約占80%。有調查表明,該病在育齡期女性發(fā)病率為10%~15%,絕經(jīng)后異位病灶可逐漸萎縮退化[8]。目前,子宮內(nèi)膜異位癥的病因尚不明朗,被普遍認可的是子宮內(nèi)膜種植學說,即月經(jīng)期間脫落的子宮內(nèi)膜碎片由輸卵管反流種植在卵巢、盆腔,形成異位病灶[9]。也有研究認為,醫(yī)源性的內(nèi)膜移植如剖宮產(chǎn)、人流刮宮術等,也能造成子宮內(nèi)膜異位移植[10]。隨著腹腔鏡的普及應用,在子宮內(nèi)膜異位癥治療上發(fā)揮重要作用。由于異位病變囊腫較大,單純藥物治療效果不佳。手術治療通常有3種方案,保守手術將子宮、卵巢保留,相比根治性手術,復發(fā)概率高。Alborzi等[11]研究顯示,腹腔鏡手術治療2年復發(fā)率高達29.4%。
假絕經(jīng)療法是一種常見的藥物治療方案,可以抑制卵巢的周期性內(nèi)分泌刺激。通常采用GnRHa,強烈抑制卵巢功能,減少機體雌激素分泌,使子宮內(nèi)膜萎縮,減少異位病灶。臨床常用的GnRHa包括戈舍瑞林、醋酸亮丙瑞林等。本研究使用的戈舍瑞林,為長效緩釋制劑,只需每月皮下注射1次,應用便捷,易被患者接受。本研究結果發(fā)現(xiàn),B組和C組采用腹腔鏡手術聯(lián)合戈舍瑞林藥物治療,有效率為88.10%和88.89%,說明了腹腔鏡手術聯(lián)合GnRHa的治療效果良好。本研究結果與胡燕和盧昆林的[12]研究相符,該研究還表示手術聯(lián)合GnRHa藥物治療的復發(fā)率為9.09%,相比單一手術治療復發(fā)率較低。此外,本研究患者治療后1年內(nèi)的妊娠率為27.78%~35.71%,3種不同治療方案的妊娠率無明顯差異。徐蕾等[13]研究表明,腹腔鏡手術后,未用藥組妊娠率為31.3%,GnRHa用藥組妊娠率為74.4%,孕三烯酮組為53.6%,認為術后適當用藥可提高妊娠率。本研究結果與之不同,可能原因為隨訪時間僅為1年,未能觀察長期情況。
盡管戈舍瑞林療效顯著,但不良反應明顯,突出表現(xiàn)為絕經(jīng)期癥狀,如潮熱多汗、煩躁失眠、肌肉骨關節(jié)痛等。反向添加雌激素治療,基于雌激素閾值學說理論,主張增加使用小劑量雌激素,將雌激素控制在理想水平,從而減少體內(nèi)雌激素低水平導致的絕經(jīng)期癥狀。本研究使用的替勃龍通常作為絕經(jīng)后婦女雌激素缺乏的替代治療藥物,可改善絕經(jīng)期癥狀。本研究結果發(fā)現(xiàn),比較3組的Kupperman評分,B組明顯高于C組,且B組潮熱多汗、煩躁失眠、肌肉骨關節(jié)痛、骨量減少的發(fā)生率也較高。這說明了應用替勃龍可明顯改善雌激素低水平狀態(tài),減少圍絕經(jīng)期癥狀,患者更容易耐受,從而提高治療效果。張黎和吳忠新[14]將GnRHa聯(lián)合反向添加雌孕激素治療重度子宮內(nèi)膜異位癥,發(fā)現(xiàn)治療后聯(lián)合用藥的血清雌二醇水平顯著高于GnRHa,疼痛視覺模擬評分無明顯差異。陳韋君等[15]探討聯(lián)合用藥對骨密度的影響,發(fā)現(xiàn)GnRHa組的骨密度明顯下降,而聯(lián)合用藥的骨密度大于GnRHa組。以上均說明反向添加雌激素療法可明顯改善雌激素低水平狀態(tài)。
近年來,免疫標志物在診斷子宮內(nèi)膜異位癥中發(fā)揮了重要作用[16]。糖類抗原CA125為腫瘤相關抗原,在子宮內(nèi)膜異位癥患者中CA125值明顯升高,且隨著r-AFS分期增高而增高[17-18]。有研究表示CA125的敏感性為79.54%,特異性為92.0%[19]。EMAb是子宮內(nèi)膜標志抗體,在子宮內(nèi)膜異位癥血清中EMAb的檢出率可達70%~80%[20]。有研究表示,CA125和EMAb聯(lián)合診斷子宮內(nèi)膜異位癥的特異性為100%,具有較好的輔助診斷價值,可作為評價該病治療效果的敏感指標[21]。本研究結果發(fā)現(xiàn),B組和C組的血清CA125水平和EMAb陽性率均低于A組,這與王媛等[22]研究結果相符,說明了戈舍瑞林藥物治療的有效性。
綜上所述,子宮內(nèi)膜異位癥行腹腔鏡保守手術后,采用戈舍瑞林藥物治療,能明顯提高治療效果,反向添加替勃龍可明顯改善雌激素低水平導致的圍絕經(jīng)期癥狀,耐受性更好。

