三疣梭子蟹可食用部位鎘組分的逐級提取及分子質量分布特征
田姣姣,林 洪,劉天紅,隋建新,王 穎,馮瑞雪,李紅艷,曹立民,*
(1.中國海洋大學食品科學與工程學院,山東青島 266003;2.山東省海洋生物研究院,山東青島 266104)
貝類、蟹類等海產品由于滋味鮮美而深受消費者喜愛。但是由于自身的強蓄積特性,這些海產品中的重金屬容易富集至很高的濃度,從而導致顯著的食用安全風險,其中鎘的超標問題尤為突出[1-3],關于其賦存形態及危害評估,一直是研究的重點和熱點[4-8],但受限于分離分析手段等制約,迄今關鍵的科學問題仍未得以明確闡釋[9-13]。三疣梭子蟹(Portunustrituberculatus)是典型的養殖海產品之一,同樣面臨鎘等重金屬所引發的安全危害;與魚貝類等其它海產品不同的是,其性腺、肝胰腺等(即俗稱的“蟹黃”、“蟹膏”)是最受喜愛的可食用部位,恰恰又是重金屬富集的主要區域[9,14],從而顯著增加了鎘形態及其危害分析的復雜程度和難度。
充分、完整地提取分離生物體內不同形態的鎘組分,是準確開展風險評估的前提條件。已有研究表明,海洋生物體內有相當數量的鎘是與金屬硫蛋白等生物分子相結合而存在(metallothionine-Cd等),強酸、有機溶劑、酶的引入,已被證明能導致有機鎘復合物的解離而破壞其初始狀態或存在提取不完全的現象,比如李敏等[15]的研究證明,有機溶劑對水產飼料鎘提取率低于1.6%,而高濃度鹽酸(>1%)又會導致有機鎘發生解離,在鹽酸pH=2.5~3.5(濃度0.025%~0.0025%)的條件下,含鎘的水產飼料中鎘的提取率為9.01%~10.56%,但該部分鎘屬于有機鎘還是無機游離態離子鎘沒有表明,無法確定pH=2.5~3.5的鹽酸是否造成了MT-Cd解離,廖琳[4]的研究則證明堿性蛋白酶對海豚肝臟鎘的提取率只有45%;目前一般采用與生物體生理條件相似的中性Tris-HCl緩沖液進行提取,以最大程度保證鎘的形態不發生顯著改變[5,9,16],但是對貝類、魚類等海產品的研究表明,該種方法存在無法將鎘提取完全的問題,甚至可能高達60%以上的鎘存在于難溶于Tris-HCl的殘渣中[10-11]。
目前關于蟹類產品中鎘形態的分析,僅有趙艷芳等[9]采用HPLC-ICP-MS確定了金屬硫蛋白鎘(MT-Cd)、谷胱甘肽鎘(GSH-Cd)、半胱氨酸鎘(Cys-Cd)等部分含鎘組分的存在,但仍未實現充分的分離提取、形態表征及定性定量分析,說明有關海產品鎘形態的研究技術仍存在缺陷。本研究擬以三疣梭子蟹可食用部位的鎘為研究對象,研究分析Tris-HCl、pH=3.5鹽酸、堿性蛋白酶等不同提取體系的逐級提取效果,從中篩選有效的提取分離方法;在此基礎上,針對其中主要的鎘組分進行分子質量及其分布特征的初步分析,以期為下步更加深入準確地研究闡釋鎘在蟹類中的賦存形態及食用風險提供技術手段和參考依據。
1 材料與方法
1.1 材料與儀器
三疣梭子蟹 購于北方沿海某城市農貿市場;1000 μg/mL鎘標準溶液(GBW(E)081581) 國家有色金屬及電子材料分析測試中心;堿性蛋白酶、5×蛋白上樣緩沖液(含巰基還原劑)、彩虹180廣譜蛋白Marker、5 mg/mL牛血清白蛋白標準溶液(BSA)、Tris-Tricine-SDS-PAGE凝膠制備試劑盒、3.5 kDa透析袋、500 Da透析袋 北京索萊寶科技有限公司;10 kDa超濾離心管 Millipore 公司;0.22、0.45 μm醋酸纖維素濾膜 邁博瑞生物膜技術有限公司;實驗用水 為超純水,電阻率18.2 MΩ·cm;實驗玻璃器皿 均用硝酸溶液(1+4)浸泡24 h以上,并用超純水沖洗干凈;Tris-HCl緩沖液 為pH7.4,10 mmol/L,含0.1 mol/L氯化鈉和5 mmol/Lβ-巰基乙醇。
3k15臺式高速冷凍離心機 德國Sigma公司;H1850離心機 湖南湘儀離心機儀器有限公司;SX2-4-10GJ箱式馬弗爐 蘇州江東精密儀器有限公司;EHD-24電熱消解儀 北京東航科儀儀器有限公司;AA-6800原子吸收分光光度計 島津儀器設備有限公司。
1.2 實驗方法
1.2.1 樣品預處理 三疣梭子蟹去掉蟹殼和不可食用部位,取出其肌肉(包括雌蟹的肌肉和雄蟹的肌肉)、雌蟹性腺和雌蟹肝胰腺(二者合稱蟹黃)、蟹膏(包括雄蟹的性腺和肝胰腺)等可食用部位,分別勻漿分裝,然后于-40 ℃凍存備用。
1.2.2 三疣梭子蟹可食用部位總鎘含量的測定 參照國標GB 5009.15-2014《食品安全國家標準 食品中鎘的測定》中干法灰化法用馬弗爐進行灰化,之后采用火焰原子吸收法測定鎘含量,每個部位平行3次,同時做試劑空白。火焰原子吸收法工作參數為:波長:228.8 nm;狹縫:1.0 nm;燈電流:8 mA;乙炔空氣流量:1.8 mL/min;背景校正D2。
1.2.3 三疣梭子蟹可食用部位鎘的逐級提取 稱取2~3 g勻漿樣品(肌肉部位3 g,雌蟹性腺、雌蟹肝胰腺、蟹膏分別2 g,精確到0.001 g)于50 mL離心管中,然后加入一定體積(m∶V=1∶5)經4 ℃預冷的Tris-HCl 緩沖液(10 mmol/L、pH7.4),渦旋搖勻后于4 ℃,8000 r/min 下離心30 min,重復提取3次,合并上清液得Tris-HCl提取液[9,17-18]。各部位殘渣中加入一定體積(m∶V=1∶5)pH=3.5鹽酸,渦旋搖勻后于4 ℃,8000 r/min 下離心30 min,得HCl提取液[15]和雌蟹性腺、雌蟹肝胰腺、蟹膏的殘渣。繼續對肌肉部位鹽酸提取后的殘渣進行提取,加超純水(m∶V=1∶5)均質,NaOH調pH至10,加入3%肌肉質量的堿性蛋白酶,45 ℃水浴酶解30 min,4 ℃,8000 r/min離心10 min,得肌肉酶解提取液和殘渣[4,19],用HCl調節pH<7。將各步提取液和殘渣分別蒸干,干法灰化,火焰原子吸收法測鎘,比較逐級提取不同處理條件下的提取效果。
1.2.4 Tris-HCl提取液中不同分子量鎘組分的分離 將Tris-HCl提取液放入截留分子質量為10 kDa的超濾管中,8000 r/min離心10 min,收集殘留液用于分析>10 kDa組分;濾出液(<10 kDa)繼續放入截留分子質量為100~500 Da的透析袋,加入超純水(V樣品∶V超純水=1∶20),置于4 ℃靜止透析48 h(每隔12 h換一次水),收集殘留液用于分析>500 Da組分。另外將Tris-HCl提取液裝入截留分子質量為3.5 kDa的透析袋透析48 h(每隔12 h換一次水),分別收集透出液和殘留液,結合前述結果用于分析500 Da~3.5 kDa組分及3.5~10 kDa組分。所收集的各部分溶液分別蒸干消化,消化液定容到合適體積,用火焰原子吸收法檢測鎘含量,計算<500 Da、500 Da~3.5 kDa、3.5~10 kDa、>10 kDa等不同組分中鎘的含量及占比。
為了考察超濾效果并分析大分子鎘組分與蛋白質的關聯性,收集Tris-HCl提取液和10 kDa超濾殘留液、濾出液,利用考馬斯亮藍法測定蛋白濃度,然后將各提取液及超濾前后的溶液蛋白稀釋至1 mg/mL,按照Tris-Tricine-SDS-PAGE凝膠制備試劑盒說明書,制備分離膠、夾層膠、濃縮膠等,上樣電泳,電泳結束后進行染色、脫色掃描,操作過程參照文獻[20]。
1.2.5 可食用部位總鎘含量和逐步提取率的計算 可食用部位中鎘含量按公式(1)計算:
式(1)
式(1)中:X為可食用部位中鎘含量(mg/kg),C為消化液定容后鎘濃度(mg/L),V為消化液定容體積(mL),m為稱取可食用部位質量(g)。
可食用部位鎘的逐級提取率及殘渣剩余率按公式(2)計算:
式(2)
式中:Y為可食用部位鎘的逐級提取率(%)或殘渣剩余率(%);Mn表示所提取樣品在該步提取液或殘渣中的鎘含量(mg),M總表示所提取樣品中的總鎘含量(mg)。
1.3 數據處理
數據采用SPSS 24.0數理統計軟件進行分析處理及單因素方差分析,P<0.05表示顯著性差異,P<0.01表示極顯著性差異;采用Origin 8.5繪制圖。
2 結果與分析
2.1 三疣梭子蟹各部位的總鎘含量
由于難以進行準確有效的分離,雄蟹體內的肝胰腺和性腺等未作進一步區分,而合并作為傳統消費習俗中的蟹膏進行分析測試。從三疣梭子蟹體內主要的可食用部位來看,總鎘含量為雌蟹肝胰腺(15.662 mg/kg)>蟹膏(13.758 mg/kg)>雌蟹性腺(1.411 mg/kg)>肌肉(0.184 mg/kg)(圖1),這與前人的研究結果一致[14,21]。肝胰腺在甲殼類動物中相當于脊椎動物的肝臟,一般認為是重金屬蓄積和解毒的主要部位[14],這可能是肝胰腺鎘含量高于蟹類的其他可食用部位的主要原因;蟹膏包括雄蟹的肝胰腺和精巢等性腺器官,因此鎘含量僅次于雌蟹肝胰腺,但大于雌蟹性腺和肌肉。
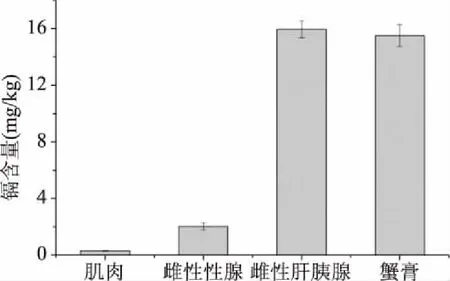
圖1 三疣梭子蟹可食用部位總鎘的分布Fig.1 Distribution of cadmium inedible parts of Portunus trituberculatus
依照我國及許多亞洲國家的習俗,性腺和肝胰腺等均屬于可食部位,并有蟹黃醬等相應的加工制品。按照GB 2762-2017《食品安全國家標準 食品中污染物限量》規定,甲殼類生物體內鎘含量≤0.5 mg/kg[22],由此來看單純的肌肉中鎘未超標,而性腺和肝胰腺均超標嚴重,并導致可食用部位總體的鎘含量達到2 mg/kg以上。此外Wiech等[21]針對面包蟹的研究表明,冷凍解凍以及蒸煮等加工流通過程中,肝胰腺內的鎘可以遷移至肌肉并由此導致其含量超標。因此,蟹黃和蟹膏等部位的鎘含量及形態特征,對于蟹類的安全評價具有重要意義。
2.2 逐級提取對可食用部位鎘的提取效果
生物體內鎘賦存形態研究中,提取劑多采用中性Tris-HCl緩沖液。本研究的結果顯示,對于全部可食用部位整體而言,單一采用中性Tris-HCl能達到約92%的總鎘提取率,各部位的提取率則在60.95%~93.93%之間(圖2),尤其是性腺和肝胰腺均能達到90%以上。這表明三疣梭子蟹中鎘的溶解特性與之前報道的魚貝類有所不同,之前關于海產品的相關研究中,只有貝類中證實有40%以上的鎘存在于Tris-HCl提取液中[10],而魚類和蟹類中均未有明確的定量分析,例如Heidi等[11]采用Tris-HCl提取鯉魚和鰻魚腎臟中的鎘,測定出的含重金屬片段之和小于總鎘含量,趙艷芳等[9]采用Tris-HCl提取梭子蟹體內的鎘,HPLC-ICP-MS分離檢測鑒定出一些鎘的形態,但未將生物體內的總鎘與提取出的鎘量比較,沒有說明是否提取完全。而本研究發現,蟹黃和蟹膏等鎘富集程度較高的部位,總體上主要以Tris-HCl提取物存在,通過這一方式既可以較為充分地將絕大多數鎘組分提取分離出來,同時可以較為完整地保持其原有形態。進一步采用酸處理和堿性蛋白酶處理,可以將各部位總鎘的提取率進一步提高到93%~99%左右(圖2),基本達到了完全提取的程度[23],但是考慮到其對于鎘復合物賦存形態的潛在破壞,用于下步形態分析、危害評估等研究的價值可能是非常有限的。
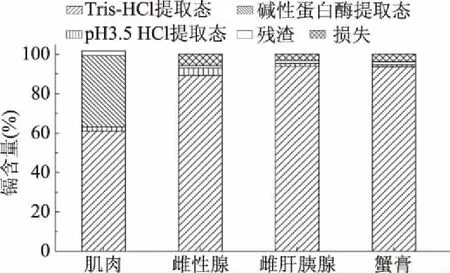
圖2 梭子蟹各食用部位中鎘的逐級提取結果Fig.2 Illustration of the ratio of sequential extractionfor cadmium in different tissues of Portunus trituberculatus
肌肉部位鎘的Tris-HCl提取率只能達到60.95%,進一步采用鹽酸處理后效果并不明顯,仍有37%左右殘留,繼續經過堿性蛋白酶處理后則可以充分溶出(圖2),這也從側面證明,其賦存形態與內臟和性腺等部位存在明顯差異,有相當數量的鎘并非以簡單的游離狀態存在,而是與生物組織緊密結合或者已經成為結構組分,這一點是之前的研究有所忽略的[11]。綜上,考慮到Tris-HCl既可以將三疣梭子蟹可食用部位中絕大多數的鎘提取出來,且能最大程度不破壞鎘形態,故將該部分提取物優先作為后續研究對象。
2.3 Tris-HCl提取物中不同分子質量鎘組分的分布
由電泳結果可知(圖3A、3B),梭子蟹各部位Tris-HCl提取液中蛋白組分的分子質量均大于24 kDa。依據超濾管(Amicon-Ultra-15,Millipore)的選擇和使用原則,截留分子質量不應大于目的蛋白分子質量的1/3。結合市面上現有的超濾管種類,實驗中選擇截留分子質量為10 kDa的超濾管,來實現蛋白鎘等大分子鎘復合物與小分子鎘復合物的初步分離。肌肉、蟹膏、雌肝胰腺等三個部位的超濾透出液中蛋白濃度均低于0.01 mg/mL(表1),說明采用截留分子質量10 kDa超濾管基本上可將不同部位Tris-HCl提取液中的蛋白超濾完全;而雌性腺的透出液中仍有少量蛋白質殘余。這一結果也得到了SDS-PAGE電泳的驗證,蟹膏、雌蟹肝胰腺、肌肉等三個部位的透出液(<10 kDa)中均未出現蛋白條帶,而雌蟹性腺的透出液中在75~135 kDa之間出現電泳條帶,猜測可能是該部位存在較多的大分子蛋白,而且可能不是常見的球形分子,因此有少量未被Millipore超濾管特有的再生纖維素膜(截留率90%以上)有效截留而混入<10 kDa溶液中。
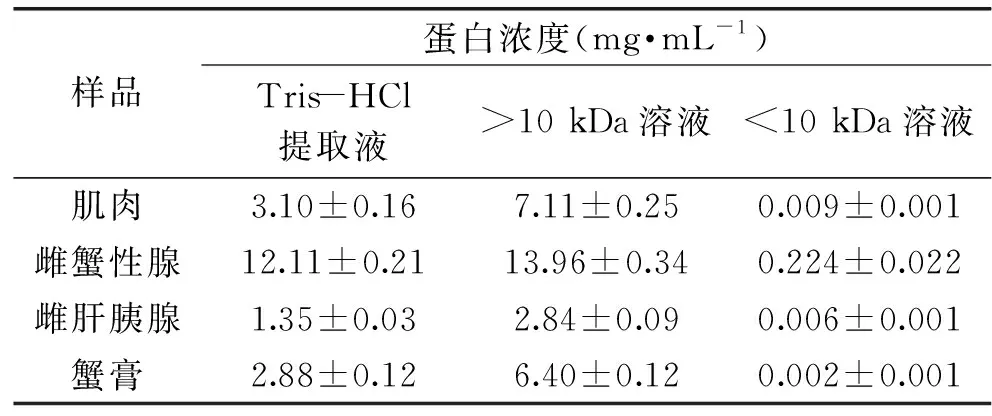
表1 三疣梭子蟹各部位Tris-HCl提取液超濾前后的蛋白含量Table 1 Protein concentrations of Tris-HCl extractsfrom Portunus trituberculatus before and after ultrafiltration
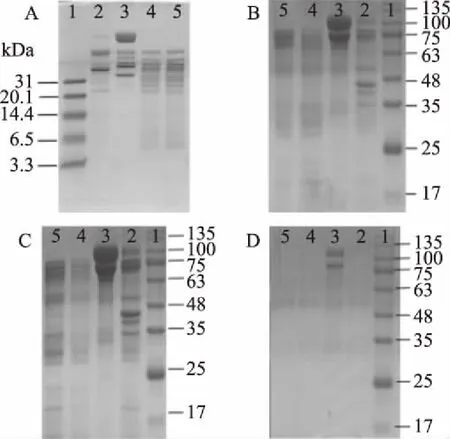
圖3 梭子蟹各部位Tris-HCl提取液SDS-PAGE結果Fig.3 SDS-PAGE of Tris-HClextracts from Portunus trituberculatus注:A,B:Tris-HCl提取液;C:>10 kDa組分;D:<10 kDa組分;A:超低分子量電泳;B、C、D:大分子電泳;1:Marker;2:肌肉;3:雌性腺;4:雌蟹肝胰腺;5:蟹膏。
采用超濾結合透析的方式對Tris-HCl提取液中不同分子質量鎘復合物的分離測定結果如圖4所示,發現各部位分子質量>10 kDa的鎘復合物占比最高,分別達到90.8%、49.25%、67.6%、64.6%,表明鎘進入生物體內后主要是與一些大分子物質結合,而這可能是大分子物質(如蛋白質等)含有較多的基團-SH、-NH4、-COOH等活性基團所導致,這些基團一般認為具有較強的鎘親和能力[24]。但是這些大分子具體是何種物質,是否全部是蛋白鎘需要進一步研究:以往研究較多的金屬硫蛋白鎘分子質量一般在6~7 kDa,即使發生橋連,也在15~20 kDa左右[17],而從本研究結果來看,提取液中蛋白分子質量主要處于24 kDa以上,因此該類鎘組分應較少含有金屬硫蛋白鎘,或更可能是其它大分子蛋白或者多糖、脂類等與鎘形成的復合物,例如廖艷等[13]也在企鵝珍珠貝的體內發現了可能與糖類、脂溶性大分子結合的鎘。這一點與之前認為的鎘進入生物體主要是與金屬硫蛋白結合[25-28]存在明顯差異的。
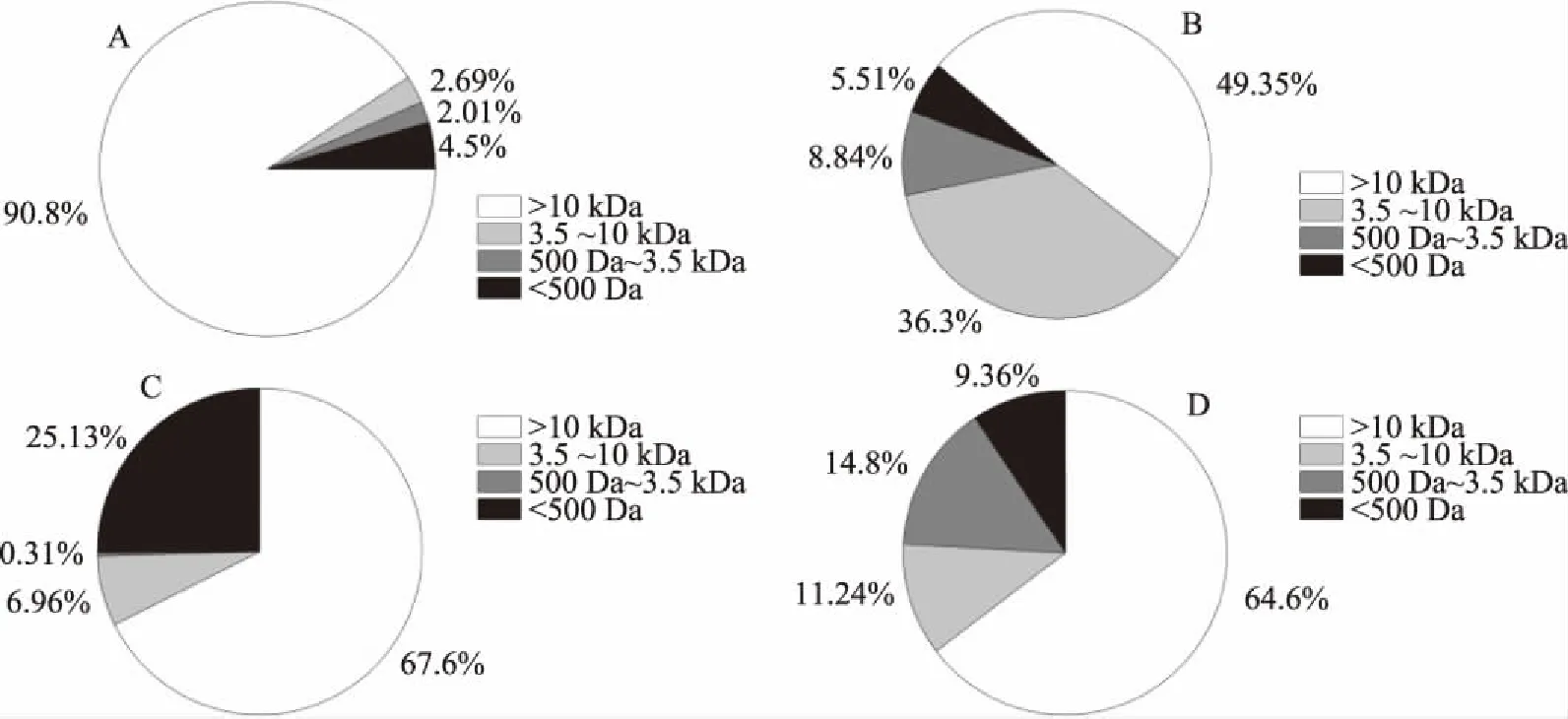
圖4 不同分子質量鎘復合物在Tris-HCl提取鎘中的比例Fig.4 Proportion of cadmium complex of different molecular weight in Tris-HCl extracts注:A:肌肉;B:雌性腺;C:雌蟹肝胰腺;D:蟹膏。
同時發現Tris-HCl提取物中<500 Da的鎘組分占比也較大,分別達到了4.50%、5.51%、25.13%、9.36%。目前已發現的離子態鎘(Cd2+)、GSH-Cd、Cys-Cd均屬于<500 Da小分子鎘組分,但其毒性可能存在顯著差異,因此明確毒性較大的離子鎘(Cd2+)占比,確定其它小分子鎘復合物的毒理學特征,將是下步研究重點。除此之外,Tris-HCl提取液中分子量介于500 Da~10 kDa之間的鎘組分,在雌性腺部位可達45.14%,但在其余部位均占比較低,其可能含有MT-Cd,也可能是其它未知鎘復合物,目前仍難以確定。
3 結論
本文針對三疣梭子蟹肌肉、蟹黃和蟹膏等不同可食用部位中的鎘,通過對不同提取方法的效果探究,表明Tris-HCl法具備溫和及保留鎘賦存形態完整性的優勢,其溶于Tris-HCl提取液的鎘是梭子蟹可食部位主要的賦存形態,占內臟和性腺的90%以上;而肌肉組織含37%鎘需要堿性蛋白酶處理才可釋放,表明肌肉中部分鎘已經牢固地與肌肉組織締合在一起,甚至可能已經通過同化作用成為生物結構的組成成分,而這些對于進一步研究探討海產品中鎘的蓄積轉化具有較好的提示意義。
基于超濾透析等手段研究Tris-HCl提取物中不同分子量鎘組分的分布特征,發現49%以上均屬于分子質量>10 kDa的鎘復合物,表明梭子蟹中的鎘可能與金屬硫蛋白以外的其它大分子如蛋白或者多糖、脂類等形成復合物,在金屬硫蛋白所介導的途徑之外,可能存在其它的蓄積代謝機制;分子質量處于500 Da~10 kDa之間的鎘組分占比相對較少,而包含高毒性離子態鎘分子質量<500 Da的鎘組分約占4%~25%。考慮到有機鎘與無機鎘之間的毒性差異,三疣梭子蟹中鎘的實際危害很可能與之前基于總鎘的評估結論有所不同。
重金屬在水產品體內的蓄積和分布狀況可能受多種因素影響,如生物遺傳特性、生活的水質、養殖條件等,不同個體之間可能因此存在差異。因此后續工作仍需要不斷進行驗證和完善,以更加精準地解析三疣梭子蟹中鎘的賦存形態和分布特征。

