食品中乳酸菌定量檢測方法研究進展
劉艷容,舒永紅,楊佳瑋,顧慧丹,楊 瑤,*
(1.南京市產品質量監督檢驗院,國家加工食品及食品添加劑質檢中心,江蘇南京 210019;2.南京師范大學食品與制藥工程學院,江蘇南京 210023)
乳酸菌(lactic acid bacteria,LAB)是一類能發酵糖產生乳酸的微好氧、厭氧或兼性厭氧的革蘭氏陽性細菌[1]。乳酸菌很早就被人們應用到各種食品的生產中,如奶酪、泡菜、酸奶等。如今,隨著乳酸菌健胃整腸、抑制致病菌、抗氧化、增強機體免疫等益生功能被不斷揭示,乳酸菌在農牧業、食品乃至醫藥行業的應用更為廣泛[2],而食品中乳酸菌的檢測則成為相關食品生產企業及食品監督檢測部門重要的工作內容。
2014年,由國際益生菌與益生元科學聯合會(ISAPP)發布的關于益生菌的共識中突出強調了益生菌的3個核心特征,即足夠數量、活菌狀態、有益健康功能[3]。2018年我國修訂的《益生菌類保健食品申報與審評規定(征求意見稿)》已采納了這一概念。由于益生菌食品功效的發揮主要取決于活菌的作用,因此,食品中乳酸菌的活菌數量是該類食品檢驗的核心內容。目前我國產品標準規定發酵乳制品及活菌型乳酸菌飲料中乳酸菌活菌數不得少于1×106CFU/g(mL)[4-5],其檢測方法標準為GB 4789.35-2016[6],采用的是平板計數法,但是該方法在實際應用中存在耗時長(一般為72 h)、工作量大和操作繁瑣等缺點。隨著分析檢測技術的蓬勃發展,一些快速檢測方法在食品中乳酸菌檢驗應用越來越廣泛。2015年,國際標準化組織(ISO)頒布了采用流式細胞術測定乳及乳制品、發酵劑及發酵產品和益生菌制品中乳酸菌數量的方法標準[7],該方法檢測時間短,大大提高了檢測效率,但是檢測特異性存在不足。
熒光定量PCR法(qPCR)作為快速、靈敏且特異性強的分子生物學檢測技術已經廣泛應用于食品微生物檢驗領域,在qPCR法基礎上通過研發新型DNA染料建立的EMA-qPCR和PMA-qPCR法可有效區分活和死的微生物,是近些年來興起的活菌檢測技術,在食品乳酸菌活菌檢測中的研究報道日益增多。本文綜述了近年來國內外研究學者對食品中乳酸菌定量檢測方法的研究進展,以平板計數法和流式細胞術為基礎,重點闡述了熒光定量PCR法及前沿的 PMA-qPCR法在食品乳酸菌定量檢測中的方法原理、應用現狀和技術優勢,引發研究者對該方法的深入思考,也為更好地開發熒光定量PCR技術在食品乳酸菌活菌檢測中的應用提供參考。
1 平板菌落計數法
平板菌落計數法是一種統計菌落總數的常用微生物學方法,目前我國食品中乳酸菌的檢測方法標準為GB 4789.35-2016[6],采用的就是平板計數法,具體方法如表1所示。

表1 現行國標GB 4789.35-2016檢測食品中乳酸菌數量Table 1 Number of lactic acid bacteria in food detected by current national standard GB 4789.35-2016
平板菌落計數法作為最常用的也是現行國標中的檢測方法,其中平板培養基成分、培養條件和接種方法等對計數結果的準確性有很大的影響,現有研究對培養基成分優化的研究報道最多。方改霞等[8]報道了向MRS培養基中加入適量硫酸多粘菌素和放線菌酮可抑制大腸菌群和致病菌等雜菌生長,從而增加對活菌型乳酸菌飲料中乳酸菌計數結果的準確性。蔡芷荷等[9]研究表明添加2.5 mg/100 mL莫匹羅星鋰鹽(Li-MUP)能明顯區分保加利亞乳桿菌和嗜酸乳桿菌與雙歧桿菌。蔣曙光等[10]開發了用于區分雙歧桿菌和其他乳酸菌的顯色培養基。黃寶瑩等[11]研究表明含氧量對不同乳酸菌樣品的計數結果影響較大。多篇文獻[8,11-13]研究表明傾注法接種的乳酸菌生長情況更好,計數結果也較涂布法更為準確。
平板菌落計數法操作簡便,結果直觀準確。然而,該方法也存在弊端,主要表現在操作工作量大,此外,檢驗周期長(72 h左右)是最大的缺點,尤其對原本貨架期較短的發酵乳制品的檢測更為不利[14]。因此,快速檢測食品中乳酸菌數量則是對食品企業及監管部門提出的更高要求。
2 流式細胞術
2.1 流式細胞術的檢測原理
流式細胞術(Flow cytometry,FCM)是基于流式細胞儀的一種檢測技術,當帶有熒光標記的細胞進入儀器內液流系統時被鞘液包裹而形成單細胞懸液,單細胞懸液經過噴嘴進入光學檢測系統,被激光激發而產生特異性熒光,熒光的強弱與細胞標記的熒光分子多少相關,從而可定量分析出細胞中DNA、RNA或者某蛋白質的含量以及細胞數量[15]。FCM在微生物學領域如菌體計數、活性判斷、在線監測等方面的應用廣泛[16]。
2.2 FCM定量檢測乳酸菌
FCM在分析乳酸菌過程中通常與免疫熒光技術結合,熒光染料的選擇對于檢測的成敗至關重要。Bunthof等[17]研究表明5(6)-羧基二乙酸熒光素琥珀酰亞胺酯(CFDA)和噻唑橙二聚體-1(TOTO-1)的聯合使用更適用于多種乳酸菌檢測。Bensch等[18]采用了SYBR Green I和碘化丙酸丙酯PI對植物乳桿菌發酵劑進行染色,準確地測定活細胞濃度。Salma等[19]報道了運用FCM和BOX/PI染料的組合測定葡萄酒中乳酸菌。熊濤等[20]運用CFDA和PI對細胞進行雙染,通過熒光強度對比分析出細胞膜受損與未受損細胞的量。劉洋等[21]建立了FCM結合SYTO?24和碘化丙錠染色的乳酸菌檢測方法。
除了染料的選擇,樣品的預處理方法也是FCM定量檢測乳酸菌的關鍵影響因素。發酵乳是最常見的檢測乳酸菌的食品,其主要成分為生乳,而生乳的成分復雜,含有多種微粒和膠體物質,檢測的干擾因素多。Gunasekera等[22]報道先用酶法清除乳中的蛋白和脂粒,應用FCM在1 h內快速測定出牛奶中的總細菌。Bunthof等[23]通過優化原料的清潔處理方法提高了信噪比,并使乳中植物乳桿菌WCFS1的提取率保持較高水平且菌體活力不受此步驟的影響。王寧等[7]通過對生乳采用酶法消化蛋白質顆粒、高速離心脫脂的方式來消除大顆粒物質對流式檢測的影響,并對菌體進行熱處理,使其易于被熒光性染料PI染色。
如今FCM對食品中乳酸菌定量檢測日趨成熟。2015年,國際標準化組織(ISO)已經頒布了FCM測定乳及乳制品、發酵劑及發酵產品和益生菌制品中乳酸菌數量的方法標準[7]。該標準通過對DNA、原生質體和膜電位三處進行染色的方法實現了對活性乳酸菌的準確計數,檢測范圍為104~108CFU/mL。國內杜耿記等[24]對29種商品乳的FCM檢測結果與GB 4789.35-2010 國標方法對比顯示出較高的一致性,且FCM檢測單一樣品僅需13 min。
2.3 FCM的優勢與問題
FCM在檢測過程中無需培養細菌,大大縮短了檢測時間。此外,FCM檢測具有更高的準確度,且能辨別活/死菌分別進行計數[21]。雖然國際上已確定FCM為檢測發酵品中乳酸菌的標準方法,但是該方法仍存在一定的缺陷:儀器昂貴,運行操作費用高;染料對于待檢菌株靈敏度的不同可能引起檢測數據的不準確;對于復雜樣品如生乳,需要進行前處理才能得到準確結果[7,22-23];不能特異性針對樣品中的某一種或多個菌株分別進行檢測。因此,關于FCM檢測乳酸菌的研究仍舊需要優化和完善,如Geng等[25]將FCM與多克隆抗體結合建立了一種乳品中動物雙歧桿菌的快速特異性計數方法。
3 熒光定量PCR法
3.1 檢測原理
熒光定量PCR法(簡稱qPCR法)是通過熒光染料或熒光標記的特異性探針,對PCR產物進行標記跟蹤,通過儀器和相應軟件分析結果,對待測樣品中的初始模板進行定量分析,包括SYBR Green染料和TaqMan熒光探針的方法(下文簡稱染料法和探針法)。
3.2 qPCR法檢測食品中的乳酸菌
本文就我國近年來使用qPCR技術對食品中乳酸菌定量檢測的研究方法列表見表2。實際操作中該方法主要受引物設計、DNA模板制備、qPCR反應條件等關鍵因素的影響。
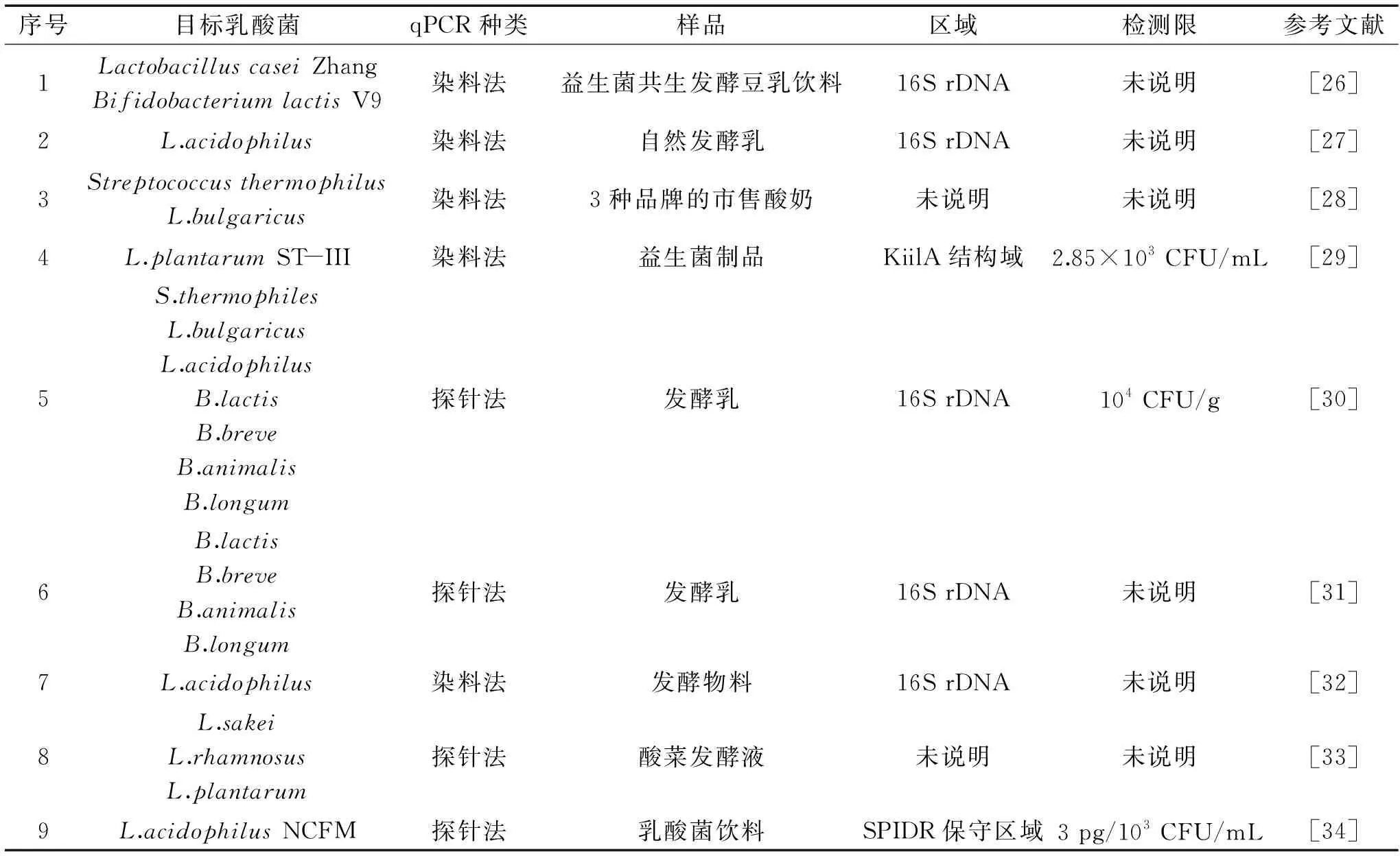
表2 qPCR技術檢測食品中乳酸菌數量Table 2 Numbers of lactic acid bacteria in food detected by qPCR
3.2.1 引物及其設計 根據待測菌株的基因信息設計特異性引物,通過qPCR法,能夠高效、靈敏和準確的檢出目標微生物。目前特異性引物的設計主要是針對菌株16S rDNA可變區序列設計的,如其木格蘇都等[26]報道通過對待測菌株16S rDNA區域設計引物,在益生菌共生發酵豆乳飲料中分別檢測了LactobacilluscaseiZhang和BifidobacteriumlactisV9兩種乳酸菌的數量。如果待檢微生物具有獨有基因,那么針對該基因序列設計引物將有助于提高檢測的準確性,如陳臣等[29]報道利用L.plantarumST-III菌株獨有的KilA結構域蛋白(YP_003924036.1)設計引物,檢測限達到2.85×103CFU/mL。為了進一步提高qPCR法檢測的特異性,有研究學者選擇用探針法對復雜樣品中的目標乳酸菌進行定量檢驗,如張娜娜等[34]通過增加設計一條探針引物,對乳酸菌飲料樣品中的L.acidophilusNCFM菌株進行定量檢測,檢測的絕對靈敏度達到3 pg,相對靈敏度達到了103CFU/mL。
3.2.2 樣品DNA提取 選擇合適的DNA提取方法以獲得高質量的模板DNA也是qPCR法成功的一個決定因素。由于含乳酸菌的食品樣本如酸奶、乳酸菌飲料或奶酪等一般成分復雜,偏酸性且不均一,因此食品中乳酸菌DNA的提取需要先除雜[23]。由于乳酸菌是革蘭氏陽性細菌,其細胞壁具有致密的肽聚糖層而不易破碎,因此,乳酸菌DNA的提取具有較大的難度,目前提取含乳酸菌的食品樣本或乳酸菌菌液DNA主要采用酶解法、堿式提取法、試劑盒法等[31,35]。劉紅娟等[36]利用溶菌酶破壞乳球菌KLDS4.0309、KLDS4.0311和乳桿菌KLDS1.0316、KLDS14-1的細胞壁。吳艷濤等[31]使用鏈霉蛋白酶E處理提取發酵乳中的雙歧桿菌。臧凱麗等[37]采用球磨-CTAB法結合堿式提取法提取嗜酸乳桿菌基因組DNA。如今文獻報道最多的提取乳酸菌DNA的方法是試劑盒法[27,30,38],該方法具有普遍的適用性。
3.2.3 qPCR反應條件 qPCR反應的重要條件包括模板DNA濃度、退火溫度以及PCR的循環次數等。魏霜等[39]為了檢測微生物肥料中的鼠李糖乳桿菌設計了DPO引物,同時探究了不同退火溫度下該引物的特異性;張娜娜等[34]根據L.acidophilusNCFM的SPIDR保守區域設計特異性引物與探針,并對擴增溫度進行優化,結果表明60 ℃擴增效率最高。
綜上所述,qPCR法具有快速、準確、靈敏度高和重復性好等優點,在乳酸菌檢測方面的研究報道較多。但是,由于活的乳酸菌數量才具有實際檢測意義,因此無法對活/死菌進行區分是該方法的嚴重不足[40]。
4 PMA-qPCR法
4.1 檢測原理
疊氮溴化乙錠(EMA)和疊氮溴化丙錠(PMA)是一類新型DNA高親和力的光敏反應染料,染料嵌入雙鏈DNA中在強烈的可見光下可形成共價連接的化學修飾,修飾后的DNA不能經PCR擴增[41]。由于EMA和PMA完全不能透過細胞膜,這一特性使得它們可以和qPCR法聯合使用,進行選擇性的擴增活細胞DNA,而不擴增死細胞(細胞壁和細胞膜已破損的細胞)DNA,大大提高了活菌檢測的準確性,原理如圖1所示[42]。有研究者發現,EMA處理會造成活菌的基因組DNA的損失,因此選用PMA染料的該類研究更多[43]。
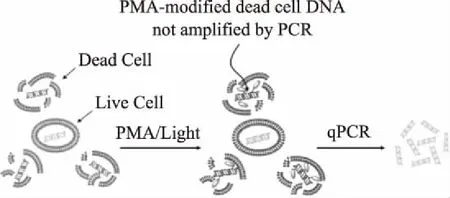
圖1 利用PMA染料選擇性檢測活細胞的原理Fig.1 Principle of selective detection ofviable cells using PMA dye
4.2 PMA-qPCR法檢測食品中的乳酸菌
目前PMA-qPCR技術已經廣泛應用在食品、食品接觸材料和水環境中的致病微生物的安全檢測中[44-45]。自2009年García-Cayuela等[46]首次報道了利用PMA-qPCR技術檢測發酵乳中的乳酸菌活菌數量之后,近幾年相關報道逐漸增多,但國內的相關研究很少。本文將已報道的PMA-qPCR技術用于乳酸菌活菌數量檢測的研究結果列于表3,并對該技術的關鍵因素控制展開討論。
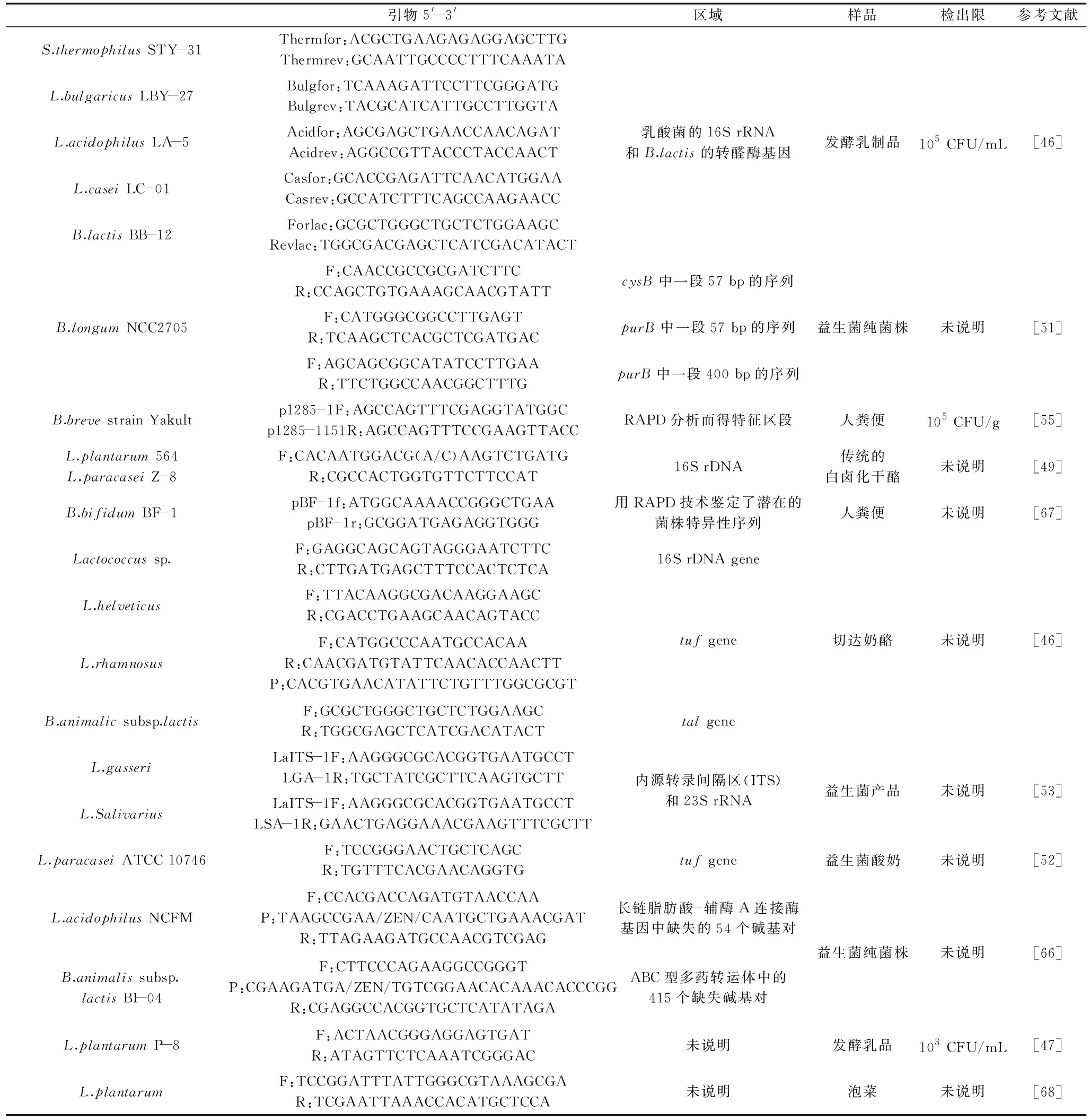
表3 PMA-qPCR技術檢測乳酸菌食品Table 3 Lactic acid bacteria food detected by PMA-qPCR
4.2.1 引物及其設計 與常規qPCR技術相類似,目前PMA-qPCR技術檢測單一乳酸菌的活菌數量已經在很多乳酸菌菌株中研究成功,如副干酪乳桿菌、保加利亞乳桿菌、嗜熱鏈球菌和雙歧桿菌BB12[46]等。我國張和平團隊也報道了PMA-qPCR技術檢測植物乳桿菌P-8的研究[47]。Desfossés-Foucault等[48]在定量檢測鼠李糖乳桿菌時,還設計了一條探針引物以進一步確保對目標菌株計數的靈敏性和準確性。但是,由于在乳酸菌食品中,一般是多種乳酸菌混合添加的,因此,同時檢測不同種乳酸菌的活菌數將更符合乳酸菌檢驗的實際需要。Zorica等[49]報道了利用設計的兼并引物,同時對Lb.plantarum564和Lb.paracaseiZ-8進行檢測。Desfossés-Foucault等[46]報道了設計通用引物對契達奶酪中乳球菌屬菌株進行活菌檢測。此外,在腸道菌群的研究中,通過設計通用引物對腸道中雙歧桿菌屬、乳桿菌屬等不同種屬微生物進行定量檢測可為乳酸菌食品中分類檢測乳酸菌提供有利參考條件。
4.2.2 膜損傷菌的制備 膜損傷菌的制備直接影響到PMA染料與“死細胞”DNA的結合效率,是建立PMA-qPCR法檢測標準曲線的關鍵環節。目前,膜損傷菌的制備方法報道有熱致死法、玻璃珠破碎法、有機溶劑處理法、紫外線處理法和凍融法等多種[50],而在乳酸菌的研究中,大都采用熱致死處理法,但熱處理的具體條件不一致。Reimann等[51]采用56 ℃處理B.longumNCC2705。Scariot等[52]研究結果顯示對副干酪乳桿菌60- ℃處理30 min效果最佳。Lai等[53]研究表明,在100 ℃熱處理30 min的條件下,干酪乳桿菌死菌的DNA已不再被檢出,而唾液酸乳桿菌死菌的DNA仍舊有少量被檢出。
4.2.3 PMA染料的工作條件優化 PMA染料的工作條件具體包括PMA染料濃度、光反應時間和暗反應時間等因素[54],需要根據檢測菌株特性、菌株數量和實際檢測樣品中活菌數量的不同而優化研究。García-Cayuela等[46]檢測發酵酸奶中的雙歧桿菌的PMA處理條件為濃度50 μmol/L,暗反應5 min和光反應15 min,而Fujimoto等[55]檢測短雙歧桿菌時PMA處理光反應2 min。Pinheiro等[56]檢測糞腸球菌的最佳PMA工作條件為濃度100 μmol/L,暗反應5 min和光反應10 min。
5 數字PCR法
5.1 檢測原理
數字PCR(dPCR)技術是一種核酸分子的絕對定量技術,主要分為基于芯片的dPCR(chip digital PCR,cdPCR)和基于微滴的dPCR(droplet dPCR,ddPCR)這兩大類。其中cdPCR的主要原理是將反應體系通過微流控等技術均勻地導入到含有數萬個小孔的芯片上,每個小孔作為一個反應室;而ddPCR則是將PCR反應體系均勻地分割成大量的乳液包裹的微小液滴,實現每個反應微滴只有單個或幾個模板分子進行擴增[57-58]。由于dPCR是通過采集陽性信號與陰性信號的比例,按照泊松分布統計學方法直接確定原始反應體系中樣品的數量,因此從原理上克服了傳統PCR易受引物之間的相互干擾以及DNA樣品的純度等因素的影響的缺點,可實現對復雜樣本模板的各自不同引物PCR檢測[59]。
5.2 dPCR法在食品領域中的應用
目前,dPCR技術在食品領域中的應用研究日益增多[60]。Li等[61]利用dPCR技術與測序技術相結合,特異性檢測食品樣本中產溶血素的副溶血性弧菌,該研究結果比傳統基于副溶血性弧菌分離的方法所得的結果更準確,降低了假陰性結果的風險。蔡教英等[58]利用dPCR技術精準定量轉基因油菜中RF1基因含量,檢測限和最低檢測限分別為18拷貝/反應和3.7拷貝/反應。Floren等[62]報道了dPCR法對加工肉制品中牛、馬和豬肉含量的精確定量,結果顯示dPCR法在不同肉制品中的定量限和檢測限分別為0.01%和0.001%,顯著優于qPCR法。近年來dPCR法已納入多項食品檢測國家標準中,主要涉及轉基因食品的檢測[63-64]和食源性病原微生物的檢測[65]。2018年Hansen等[66]報道了PMA結合基因芯片dPCR技術同時檢測混菌樣品中L.acidophilusNCFM和B.animalissubsp.lactisBl-04的活菌數量,得出的相對標準偏差分別為5%和4%,顯著優于平板計數法(15%),可見該方法精確度高,穩定性強。目前,國內還未有dPCR技術應用于乳酸菌食品檢測的文獻報道,可以預見,隨著dPCR技術的研究與推廣,其在乳酸菌檢測中的應用也會愈加廣泛。
6 展望
食品中乳酸菌定量檢測的核心是活菌檢測。現行的國家標準采用平板計數法,該方法直觀易行,是活菌檢測的“金標準”,但是該方法最大的缺點是耗時長,不能滿足食品行業快速檢測的發展需要,開發快速檢測方法勢在必行。此外,平板計數法得到結果的準確性也存在一些爭議。一些研究者指出平板計數法檢測的是可培養的活菌,而實際樣品中存在未能培養的活菌[69],這些活菌也可能對產品功效起作用,因此其數量也需要準確測量。
流式細胞術(FCM)的應用極大縮短了樣品的檢驗時間,根據歐盟標準采用FCM對食品中乳酸菌活菌定量測定,檢測時間約20~30 min,極大提高了檢測效率。該方法的檢測原理是針對標記的微生物直接計數,因此檢測結果比依賴培養的平板計數法更為準確。但是FCM法的局限性在于不能特異性檢測食品中特定乳酸菌,因此不適用于樣品中存在污染雜菌等情況。此外,由于含乳酸菌食品常為發酵乳,樣品成分復雜,檢測背景高,會干擾檢測結果的準確性。因此,FCM技術的發展需要結合特異性檢驗技術、預處理方法的優化及靈敏度更高的熒光染料的開發以增強該方法的適用范圍及提高檢測的準確度。
熒光定量PCR(qPCR)技術通過設計特異性引物有效地檢驗樣本中的特定微生物,該方法快速、靈敏,在食品微生物檢驗中廣泛應用,對食品中特定乳酸菌的檢驗研究報道有很多[61,70-71]。但是由于不能區分活/死菌,qPCR法在乳酸菌食品檢驗中遇到難題。近年來,隨著EMA/PMA染料的開發,EMA/PMA結合qPCR法檢測食品中特定活菌的研究報道日益增多,但該方法在食品乳酸菌檢驗的應用研究報道不多。通過本文對PMA-qPCR法的工作原理、操作步驟及應用實例的詳細闡述,不難判斷,選用PMA-qPCR法對食品中乳酸菌活菌定量分析是可行的,且該方法靈敏度高、檢測時間短,符合快速檢驗的食品檢測行業發展需求。但是,隨著越來越多不同種類的益生菌開發并添加至食品中,對食品中多種乳酸菌的同時定量檢測將成為乳酸菌食品的更高的檢測要求,因此qPCR技術不僅需要結合PMA等染料的研發區分活/死菌,還需要結合更前沿的微流控、基因芯片等高通量檢測技術(如dPCR技術)等,才能符合乳酸菌食品更高的檢驗要求。這將是對每一位乳酸菌檢驗研究的工作者的挑戰。
綜上所述,國內外對食品中乳酸菌的活菌檢驗的研究不斷發展,涌現出基于不同工作原理下的檢測方法,主要有平板計數法、FCM法及熒光定量PCR法。本文綜述了各方法的工作原理、研究現狀及發展動態,總結了各自的優缺點,為把握食品中乳酸菌活菌定量檢測的行業方向提供依據。可以預見,隨著多學科交叉,更多檢測技術將不斷深入研究與完善,對食品中乳酸菌“快速”和“精準”檢測的目標不久將會實現。

