電項針干預對腦出血大鼠急性期腦組織中血紅素加氧酶-1表達及神經損傷的影響?
柳依江 沈詩彥 杜若桑 張曉輝 邵文娜 崔 海△
(1.首都醫科大學,北京 100069;2.浙江省杭州市杭州種福堂中醫醫院,浙江 杭州 310011)
腦出血是一種嚴重的,有著高死亡率和不良預后的卒中類型[1-4]。在我國,相比30年前的同類調查,腦出血流行狀況十分嚴峻,其患病率、發病率大幅上升,為患者及社會帶來沉重負擔[5],其病理過程主要為血液在腦實質中快速蓄積,導致顱內壓增高、腦組織損傷[6]。腦出血致死的患者中,近半數出現在出血后2 d內[7],其中,血腫源性毒性產物、氧化應激反應和促炎性反應在繼發性損傷過程中起到重要作用[8-11]。
血紅素加氧酶-1(HO-1)及其代謝產物的活性能對氧化損傷、細胞凋亡、細胞增殖等生物過程起關鍵作用[12-13]。已有研究表明,藥物激活HO-1活性能夠調節氧化應激反應,抑制水腫進展,減輕早期腦損傷,給予抑制劑組則損傷加重[14]。本實驗以HO-1表達為關注點,通過觀察腦出血急性期腦組織中含量變化,探討電項針干預對腦出血大鼠繼發性損傷的治療作用。
1 材料與方法
1.1 實驗動物
30只SPF級雄性SD大鼠購自首都醫科大學實驗動物部,體質量(300±20)g。分籠飼養于首都醫科大學動物房屏障環境,光照周期為12 h模擬晝夜交替,溫度為(23±2)℃,自由飲水,SPF級飼料喂養,合格證號:SCXK(京)2016-0011。
1.2 試藥與儀器
鋅原卟啉-9(ZPP-Ⅸ)(美國 Frontier Scientific),qPCR試劑盒(美國KAPA Biosystems),逆轉錄試劑盒(北京百奧萊博科技有限公司)。桌面數顯腦立體定位儀(深圳RWD Life Science),華佗牌電子針療儀(蘇州醫療用品廠有限公司),分析天平(德國Sartorius),高速冷凍離心機(Beckman公司),實時定量PCR儀(美國ABI),分光光度計(上海菁華科技有限公司),電熱鼓風干燥箱(天津泰斯特儀器有限公司)。
1.3 分組與造模
實驗動物隨機分成5組,假手術組、模型組、電項針組、ZPP-Ⅸ模型組、ZPP-Ⅸ電項針組。實驗采用自體血注入尾狀核形成血腫,制備自體血腦出血模型[15]。操作步驟:使用20%烏拉坦(7 mL/kg)腹腔注射麻醉大鼠,俯臥位固定于腦立體定位儀上,頭部備皮,常規消毒后沿正中線切開約1 cm,確定前囟位置,根據大鼠腦定位圖譜確定右側尾狀核位置(前囟右3 mm,后0.2 mm)[16],使用牙科鉆打孔(d=1 mm),深度至硬腦膜且不傷及腦實質。用1 mL注射器尾靜脈抽取約100 μL,轉移到100 μL微量注射器后固定在定位儀上。微量注射器垂直方向緩慢進針,深度為5.5 mm,以5 μL/min速度勻速泵入50 μL血液,注射后留針10 min,緩慢退針。骨蠟封閉骨孔,縫合皮膚并消毒。ZPP-Ⅸ模型組、ZPP-Ⅸ電項針組在造模后30 min腹腔注射ZPP-Ⅸ(質量濃度10 mg/mL,劑量10 mg/kg)。假手術組除不注入自體血外,其余操作同模型組。造模1 d后,使用Longa評分[17]對大鼠神經功能進行評價,評分大于1分可認為造模成功,則納入實驗,否則剔除。數量不足則根據隨機分配補齊并造模。
1.4 干預方法
根據《實驗針灸學》選擇供血(頸4夾脊穴)、風池給予電項針干預[18]。常規消毒后使用毫針進針3 mm,華佗電子針療儀正極接風池,負極接供血。選擇疏波,頻率1 Hz,留針30 min。電項針組和ZPP-Ⅸ電項針組造模后連續3 d給予干預,其他組不干預。
1.5 檢測指標
1.5.1 腦組織HO-1 mRNA測定 造模后第3天給予麻醉并斷頭取腦,保存于-80℃。選擇血腫周圍組織,取100 mg使用試劑盒提取樣本總RNA。檢索HO-1核苷酸序列設計引物。引物合成反轉錄成cDNA并進行擴增,進行 Real-time PCR 檢測,采用 2(-ΔΔCt)值進行數據統計。引物序列信息見表1。
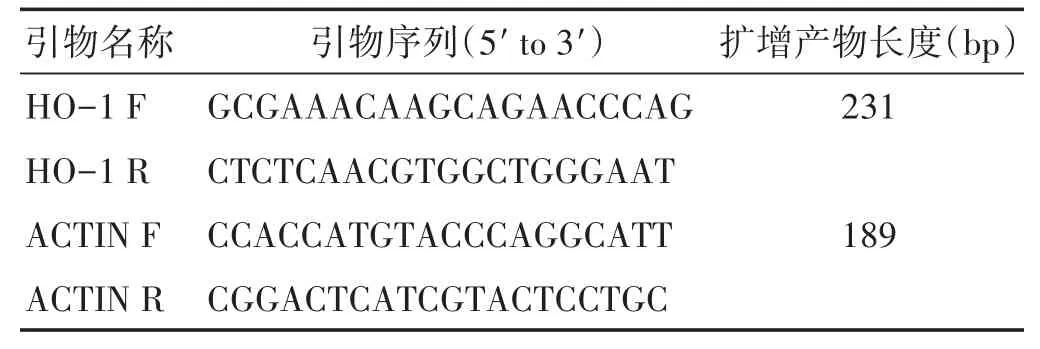
表1 目的基因引物序列
1.5.2 神經功能缺損程度評分 使用Longa評分[17]對大鼠神經功能進行評價。0分:未見任何神經損傷癥狀。1分:病灶對側前肢或后肢不能伸直。2分:行走時偏向患側偏轉。3分:行走過程向患側傾倒不能站立。4分:不能行走且有意識障礙。
1.5.3 腦組織含水量測定 在相應時間點取材,將用于測量含水量的腦組織用分析天平秤質量,得到濕質量;置于烘箱內用60℃烘干48 h以上,多次稱量至質量不再減少,得到干質量。腦含水量=(濕質量-干質量)/濕質量×100%。
1.6 統計學處理
應用GraphPad Prism7進行統計。計量資料以()表示,多組間比較采用單因素方差分析,方差齊時采用LSD分析,方差不齊時采用Dunnettt檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠腦組織HO-1 mRNA含量比較
見表2。相較于假手術組,其他各組HO-1 mRNA表達均顯著增加,并且電項針組HO-1表達高于模型組(P<0.01)。給予抑制劑后,ZPP-Ⅸ模型組、ZPP-Ⅸ電項針組較假手術組HO-1均有增高,但組間差異不具有統計學意義(P>0.05)。
表2 各組大鼠腦組織HO-1 mRNA的表達比較(2-ΔΔCt,±s)
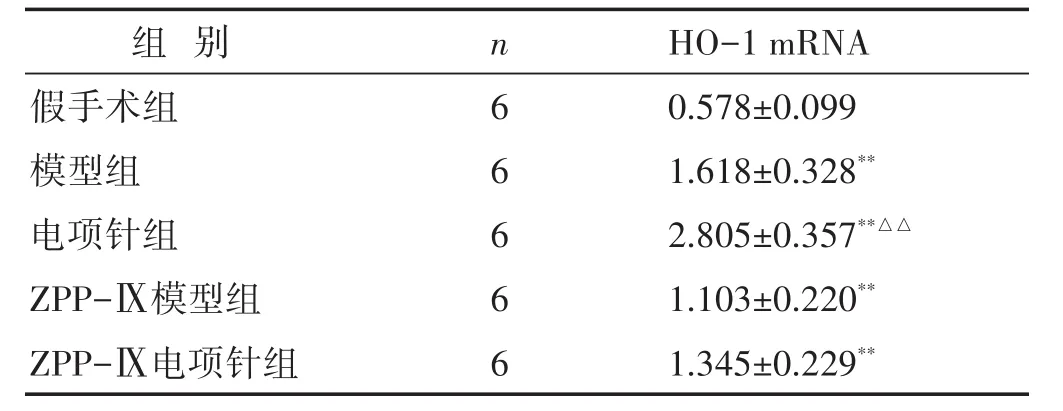
表2 各組大鼠腦組織HO-1 mRNA的表達比較(2-ΔΔCt,±s)
與假手術組比較,?P <0.05,??P < 0.01;與模型組比較,△P< 0.05,△△P<0.01。下同
組別HO-1 mRNA n假手術組模型組電項針組ZPP-Ⅸ模型組ZPP-Ⅸ電項針組0.578±0.099 1.618±0.328**2.805±0.357**△△1.103±0.220**1.345±0.229**6 6 6 6 6
2.2 各組大鼠腦含水量比較
見表3。造模1 d后大鼠腦含水量增高,在第3日腦含水量增高明顯。相較同時段假手術組,各組均有顯著統計學意義(P<0.01)。1 d時電項針組腦組織含水量低于模型組,但差異無統計學意義(P>0.05);在3 d時電項針組含水量增高,但仍低于模型組(P<0.05)。在抑制劑干預兩組中,兩時間點ZPP-Ⅸ模型組腦組織含水量均高于ZPP-Ⅸ電項針組(P<0.05)。
表3 各組大鼠腦含水量比較(%,±s)
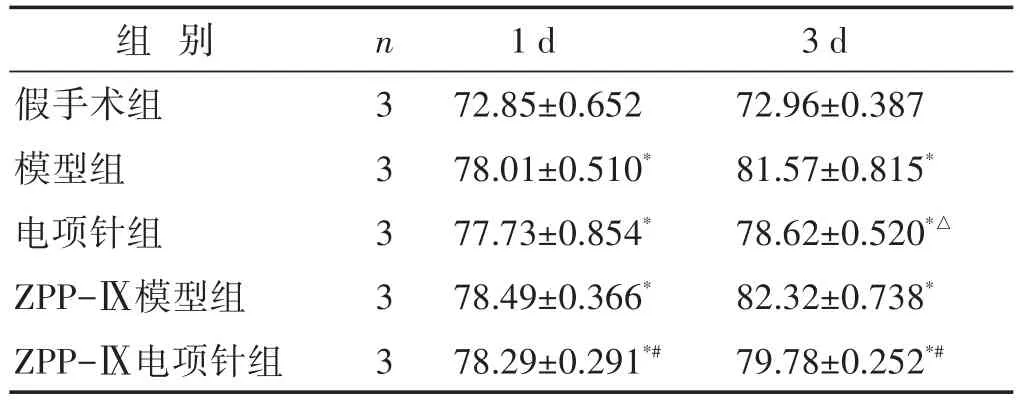
表3 各組大鼠腦含水量比較(%,±s)
與ZPP-Ⅸ模型組比較,#P<0.05。下同
組別假手術組模型組電項針組ZPP-Ⅸ模型組ZPP-Ⅸ電項針組3 d 72.96±0.387 81.57±0.815*78.62±0.520*△82.32±0.738*79.78±0.252*#n3 3 3 3 3 1 d 72.85±0.652 78.01±0.510*77.73±0.854*78.49±0.366*78.29±0.291*#
2.3 各組大鼠神經功能缺損評分比較 見表4。造模后1 d對比假手術組,各組神經功能評分均明顯增高(P<0.05),第3天神經功能評分較第1天有升高。對比ZPP-Ⅸ模型組,ZPP-Ⅸ電項針組神經功能評分改善(P<0.05)。模型組與電項針組比較仍可見神經功能損傷改善趨勢(P>0.05)。
表4 各組大鼠神經功能缺損程度評分比較(分,±s)
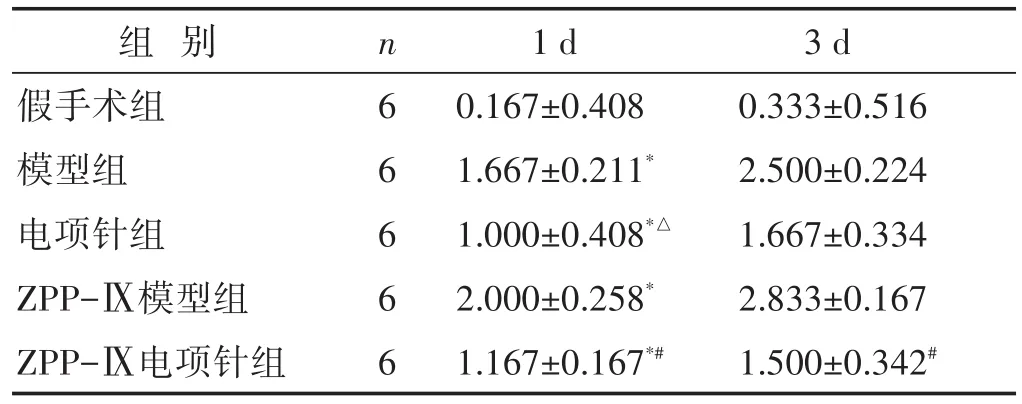
表4 各組大鼠神經功能缺損程度評分比較(分,±s)
組別假手術組模型組電項針組ZPP-Ⅸ模型組ZPP-Ⅸ電項針組n6 6 6 6 6 1 d 0.167±0.408 1.667±0.211*1.000±0.408*△2.000±0.258*1.167±0.167*#3 d 0.333±0.516 2.500±0.224 1.667±0.334 2.833±0.167 1.500±0.342#
3 討 論
中醫理論認為頭為諸陽之會,六陽經交接于頭部,督脈和足太陽經直接絡于腦,其他陽經與督脈交會于大椎穴,故通過刺激頸部穴位,激發陽氣達到活血化瘀的目的。實驗中選取的供血(頸4夾脊穴)、風池兩穴位于椎動脈上方,通過疏波刺激調節椎基底動脈、Willis環的血流,進而改善出血后腦功能。臨床上,給予電項針干預能夠通過改善血流供應、降低血液黏稠度、減緩急性期腦水腫發展等來治療腦出血,并對認知功能和運動功能損傷癥狀有明顯改善[19-22]。
HO-1是血紅素分解成一氧化碳、鐵和膽綠素過程中的限速酶,可以在血紅素、重金屬、生長因子、細胞因子等多種刺激物作用下高度上調。腦出血后,高濃度游離的血紅素能夠誘導HO-1表達增高,加速血紅素分解,減少自由基產生,減輕繼發性損傷。HO-1還可以保護內皮細胞防止凋亡,也可以調節血管緊張度,使血管松弛,減輕血管壁炎癥反應,同時還能夠參與血管生成[23-24]。有研究表明腦出血后,紅細胞溶解釋放血紅素,會消耗細胞內能量儲備、激活補體系統[25],進而導致腦水腫、氧化應激反應、神經元死亡[26]。腦出血后高濃度的游離血紅素則促使HO-1表達升高,使血紅素分解減輕繼發性損傷。
臨床研究表明,腦出血后3 d內HO-1表達達到高峰,且與急性期損傷同步[27],該過程與大鼠腦出血模型研究相一致[28]。有實驗發現,腦出血后血腫周圍組織HO-1表達升高同時,與TNF-α、IL-1β的表達呈負相關,能夠發揮抗炎作用[29]。戴曉紅等研究表明,給予腦出血大鼠頭針干預能夠上調病灶周圍HO-1表達,發揮其抗氧化作用,減輕損傷[30]。
本實驗中,與假手術組對比,各組HO-1表達均增高且差異具有統計學意義,電項針干預后HO-1表達較模型組增高。在給予ZPP-Ⅸ抑制劑的兩組中未見差異,說明電項針能夠通過提高HO-1水平來改善出血后損傷。通過腦含水量的測定表明,給予電項針干預的兩組均能夠抑制腦水腫的發展,并且作用途徑不僅限于HO-1通路。神經功能缺損程度評分,表明電項針干預能夠改善神經功能缺損,電項針與模型組對比雖然差異未見統計學意義,但可見評分降低,需進一步研究論證。
綜上,本實驗表明電項針可以提高HO-1表達,抑制腦水腫進展,減輕腦出血后繼發性損傷,并且能夠改善神經功能損傷,其具體機制需要進一步探究。

