基于富集放大反應的雙點電位滴定法測定谷物中氟含量
劉曉庚 吳李瑞 董思佳 楊奕明 劉季敏 胡妍君 張宇豪 秦怡航
(南京財經大學食品科學與工程學院;江蘇省現代糧食流通與安全協同創新中心; 江蘇高校糧油質量安全控制及深加工重點實驗室1,南京 210023) (安徽國星生物化學有限公司2,馬鞍山 243100)
氟既是人體必需微量元素,但又是一種累積性物質,體內含量超過一定程度會引起氟中毒。氟以氟離子形態廣泛存在于水體、土壤、動植物及食物中。目前測定食物中氟的方法主要有離子選擇電極電位滴定法(GB/T5009.18—2003)[1-5]、極譜法[6]、分光光度法[7,8]、熒光分析法[9]、氣相色譜法[10]、高效液相色譜法[11]和離子色譜法[12]等。電位滴定存在檢測限較高、極譜法有重現性不佳、光度法和熒光法有試劑不易得到和穩定性差、而色譜法又存在操作較繁瑣和測定成本高等不足[13]。人們對生態環境和食品安全的要求越來越高,為尋得既快速準確經濟且適合基層檢測的谷物微量氟測定新方法,在大量調研和測定方法的探究性實驗基礎上,探究出高倍富集放大雙點電位滴定法測定微量氟的新方法,并獲得了較理想的檢測效果。
1 高倍富集放大反應測定氟的原理
高倍富集放大反應測定法的基本原理是在一定條件下,Ca2+、F-與特定試劑組作用,定量生成是其氟含量5倍的具有較弱極性的難溶化合物氟磷酸鈣[Ca10(PO4)6F2,(Ksp(Ca10(PO4)6F2) = 2.48×10-6)][14,15],從而使氟富集并分離,在酸性環境下將氟磷酸鈣完全溶解,以EGTA為滴定劑,用雙電點電位滴定法[16]測其鈣含量[17],轉換成試樣中氟含量。其相關過程的反應式為:
①10Ca2++2F-+6(PO4)3-==Ca10(PO4)6F2↓
②Ca10(PO4)6F2+2HCl==10Ca2++Cl2-+2HF+6(PO4)3-
③Ca2++H2Y2-==CaY2-+2H+
其計算式為:
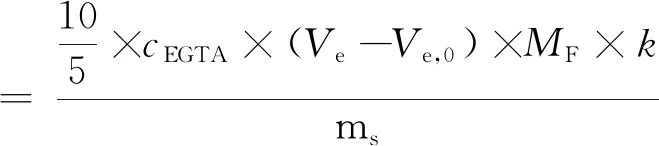
式中:Ve為滴定液體積/mL;Ve,0為樣品空白滴定體積/mL;cEGTA為EGTA標準液濃度/mol/L;ms為試樣質量/g;MF為氟的摩爾質量/g/mol;k為干物質含量。
2 材料與方法
2.1 材料與試劑
小麥、玉米、稻谷等由南京財經大學中加生態儲藏中心提供。
EGTA、NaF、CaCl2、NaCl、KOH、Na3PO4、NH4Cl、HCl、HNO3、HAc、明膠和過氧化鈉等均為分析純試劑。實驗用水為去離子純凈水。
總離子強度調節緩沖劑(TISAB)由NaCl 1.0 mol/L、HAc 0.25 mol/L、NaAc 0.75 mol/L、檸檬酸鈉0.05 mol/L組成,pH 5.0,總離子強度為2.75。
2.2 儀器與設備
ZDJ-4A型自動電位滴定儀;Ca離子選擇性電極;E-201-C pH復合電極。
2.3 方法
2.3.1 樣品前處理
參照粟智[19]的氧彈燃燒法進行預處理,即:將干燥測定水分(<8%)的試樣磨碎,過60目篩,稱取試樣5.00 g,與0.25 g過氧化鈉助燃劑混勻,壓片。將5 mL 0.5 mol/L KOH吸收液加入氧彈器中,放置壓好的試劑片,灰化,用吸收液洗凈彈壁,合并后用0.2 mol/L HNO3中和至pH 7,并定容至100 mL備用。
2.3.2 測定操作方法
按王洪友[15]的方法,取一定量試液于刻度試管,依次加一定量的2 mol/L Na3PO4、2 mol/L KOH、2 mol/L HAc和1 mol/L CaCl2(此4種溶液后簡稱為含Ca2+復合富集劑)混合均勻后,再加入明膠,定容,靜置,待明膠粉末完全吸水膨脹后,于60 ℃水浴中加熱,攪拌至明膠完全溶解,得均勻透明的溶膠;將此膠倒入聚乙烯杯中,室溫下冷卻至溶膠完全凝固;再于恒溫浴和40 W超聲波輔助下反應一定時間至沉淀層不再增加時,分出固體物并用35℃水洗至pH約7。再用2 mol/L HCl將固體物完全溶解,用1 mol/L KOH調至pH約7,并用TISAB定容至100 mL。取該試液20.00 mL,加1 mol/L KOH 5 mL,加鈣指示劑,混勻,于自動電位滴定儀用EGTA標準液(用碳酸鈣作基準物標定)滴定至終點,并記錄計量點附近兩組V,E數據(V1,E1;V2,E2)并用雙點法計算終點體積Ve,同一樣品平行測定3次。以水做空白實驗Ve,0。
2.3.3 富集放大反應條件的確定2.3.3.1 單因素考察方法
影響高倍富集放大反應的因素有:富集劑用量、反應時間、反應溫度、反應體系酸度(pH)和攪拌速度等。用單因素變量法考察這些因素對測定的影響(以氟含量和RSD為衡量指標),并確定其適宜條件。
2.3.3.2 優化實驗方法
在單因素實驗基礎上,為更準確地確定其主要因素的最優條件,對富集劑用量、反應時間、反應溫度、反應體系pH四個主要影響因素用L9(34)的正交實驗進行優化,以確定其最適宜條件。
2.3.4 方法學指標的考察2.3.4.1 標準曲線和檢測限的測定
在最適宜條件下,取氟標準液,濃度(-lgcF)分別為1.0, 2.0, 3.0, 4.0, 5.0,6.0, 7.0 mol/L,測得其雙點電位滴定法E~-lgcCa標準曲線,并根據其斜率(k)和空白值測定的標準偏差(Sb)算得鈣的檢測限(LODCa=3Sb/k)[17],再據氟與鈣的富集放大反應的計量關系便可求出本法測定氟的LODF(=LODCa/放大倍數)。
2.3.4.2 方法精密度和準確度的測定
方法的精密度以相對標準偏差(RSD)表示。方法準確度以加標實驗的回收率表示。
2.3.5 實際樣品的測定
在最適宜條件下,按2.3.1制得13個樣液,并用2.3.2操作方法對其分別進行測定。
2.3.6 數據處理
數據采用Excel 2017和Origin9.0繪圖和數據處理。
3 結果與討論
3.1 高倍富集放大反應的選定
在單用CaCl2富集F-,但效果不佳且無放大效應后。考慮到氟磷酸鈣含氟且難溶,特別是反應對氟的放大效應達10倍[14,15],實驗結果見圖1。0.1 mol/L含Ca2+復合富集液對微量F-有良好的富集放大效果。因此,選擇含Ca2+復合液作為F-的富集放大劑。

圖1 0.1 mol/L含Ca2+復合富集劑與 1.0×10-7~1.0×10-5mol/L NaF反應的富集放大效果
3.2 富集放大反應條件的單因素實驗
3.2.1 富集劑用量的影響
由圖1可見,當c(F-)≥1.0×10-6mol/L時富集產生沉淀層十分明顯,因此固定c(F-) 1.0×10-6mol/L,僅改變含Ca2+復合富集劑濃度且分別為1.0、0.5、0.2、0.1、0.05、0.01、0.005、0.001、0.000 5、0.000 1 mol/L作實驗,結果見圖2a。若復合富集劑用量太少,會因體系濃度過稀而達不到沉淀條件;如果用量過多則會導致配位效應突出而使沉淀富集作用削弱。實驗證明:1.00×10-6mol/LF-和0.05~0.20 mol/L含Ca2+復合富集劑反應產生的沉淀富集放大效果為佳,故選用Ca2+復合富集劑的用量為n(F-)∶n(復合富集劑)= 1∶5×104~2×105為宜。
3.2.2 富集放大反應酸度的影響
其他條件均不變,通過僅改變富集反應體系的酸度(pH)且分別為3、4、5、6、7、8、9、10、11、12下,測得其結果如圖2。富集反應體系酸度控制在pH5 ~7為宜。
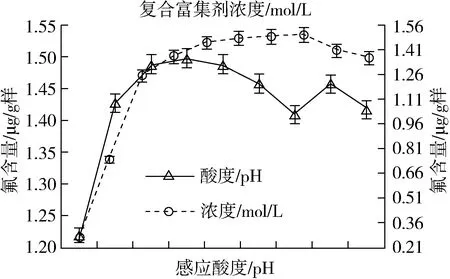
圖2 反應酸度和復合富集劑對測定的影響
3.2.3 富集放大反應溫度的影響
其他條件均不變,通過僅改變富集反應的溫度且分別為10、15、20、25、30、35、40、45 ℃,測得其結果如圖3,富集反應溫度控制在15~25 ℃為宜。
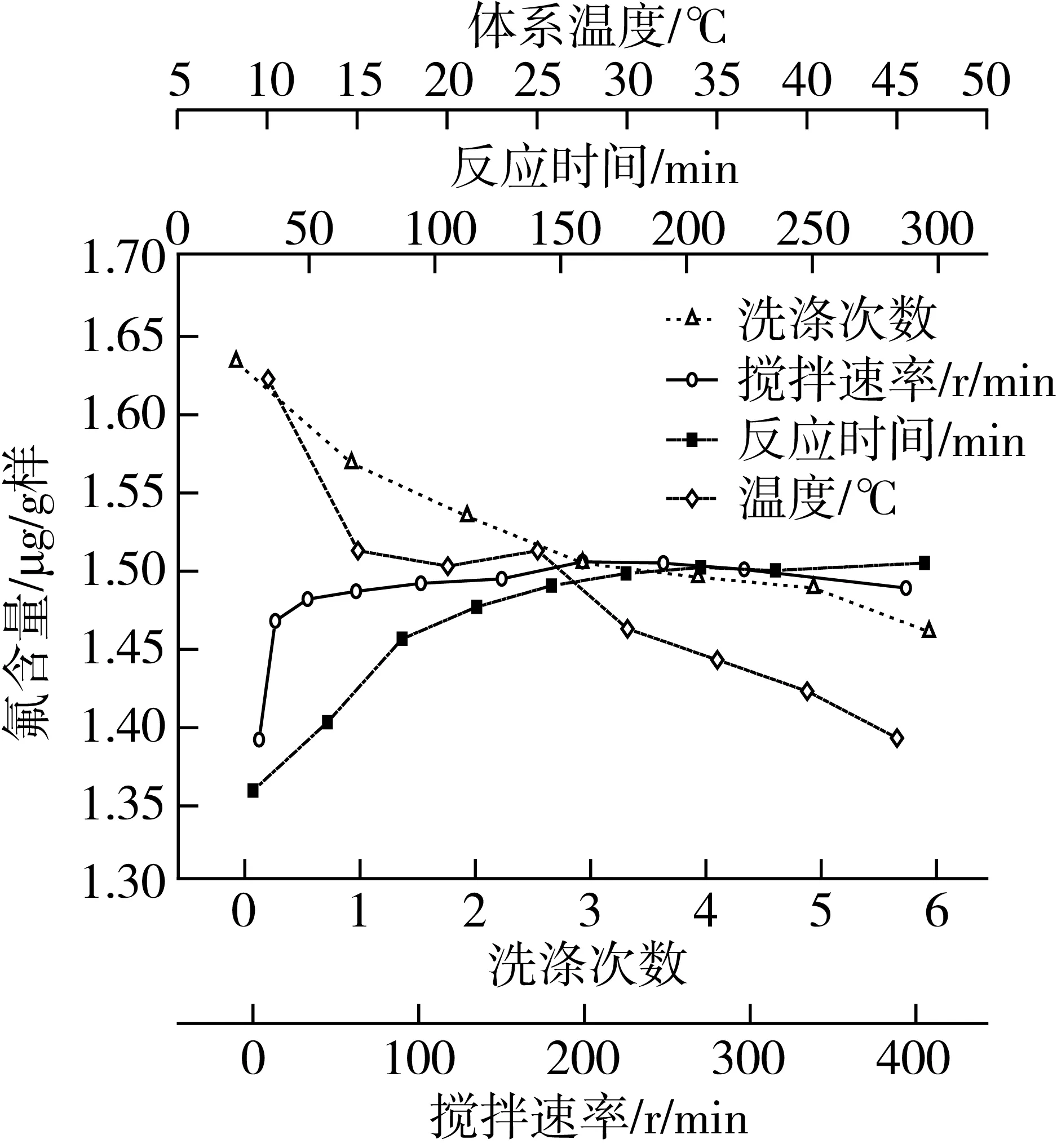
圖3 反應溫度、反應時間和洗滌次數對測定的影響
3.2.4 洗滌次數的影響
其他條件均不變,通過僅改變對富集所得固體物的洗滌次數且分別為0、1、2、3、4、5、6次下(洗滌的用水量相同),測得其結果見圖3。沉淀物的洗滌對測定有顯著影響,特別是當洗滌次數少于3次時,不僅測定結果嚴重偏高,而且測定的RSD大,重現性、穩定性和準確性均差,達不到分析要求;當洗滌次數達4次以上時,其回收率趨近100%和RSD小且穩定,完全符合微量分析要求;而洗滌次數太多不僅浪費而且會因過度洗滌使沉淀物流失而導致測定結果偏低。因此洗滌次數以4次為宜。
3.2.5 富集放大反應時間的影響
其他條件均不變,通過僅改變富集反應的時間且分別為30、60、90、120、150、180、210、240、300 h下,測得其結果見圖3。富集反應時間應控制在180 min以上為宜。
3.2.6 攪拌速率對富集放大反應的影響
其他條件均不變,通過僅改變富集反應的攪拌速率且分別為0、10、30、60、100、150、200、250、300、400 r/min下,測得其結果見圖3。攪拌速率對測定的影響不十分顯著。但攪拌過慢,反應充分,測量結果偏低,攪拌快,會產生氣泡形成大漩渦而富集不徹底,因此富集過程中攪拌速率在200~300 r/min為宜。
3.3 正交優化實驗
為獲得此富集放大反應的最適條件,根據單因素實驗結果,對富集劑用量、反應時間、反應溫度、反應體系pH四個主要影響因素采用L9(34)正交優化實驗,其實驗設計與結果見表1,結果分析見表2。
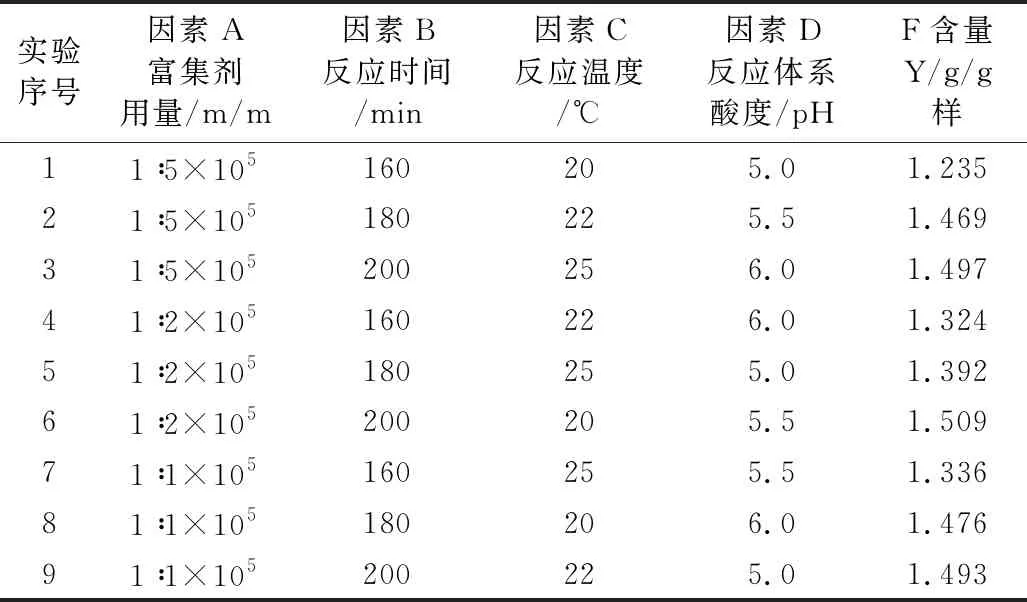
表1 正交實驗設計及結果 (n=3)
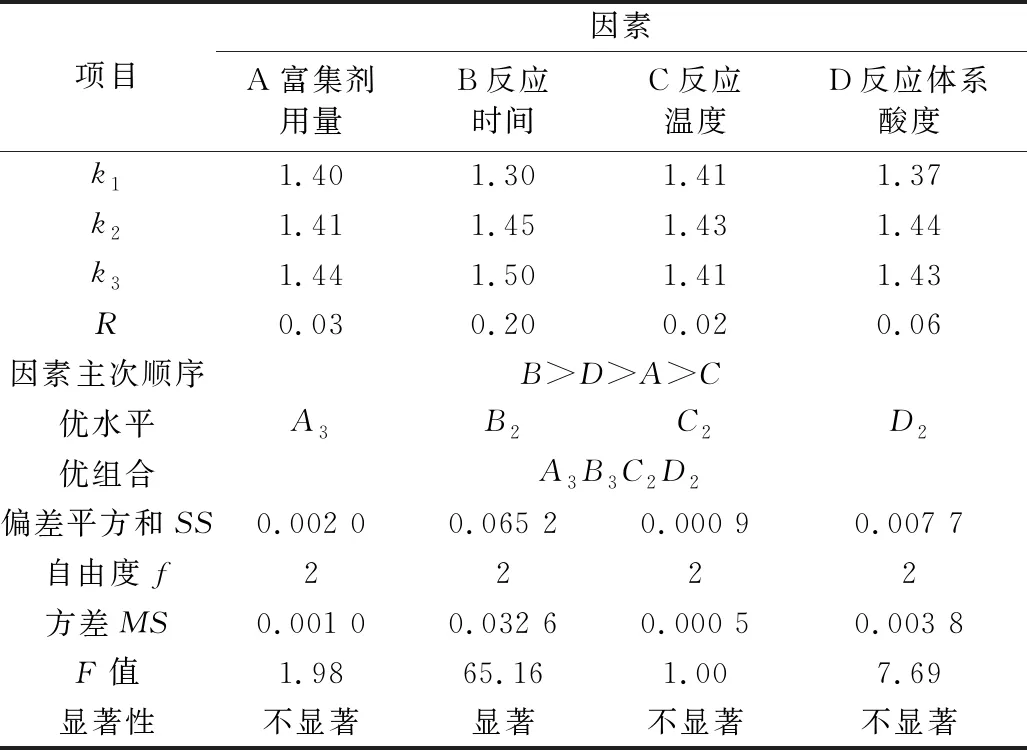
表2 正交實驗結果的分析
注:F0.05(2,2)=19.0,F0.01(2,2)=99.0。
從表2可見,四個被優化的主要因素對測定的影響程度是:B(富集反應時間)>D(反應體系酸度)>A(復合富集劑用量)>C(反應溫度);除富集反應時間影響顯著外,其他影響因素均不顯著(P<0.05),且反應的溫度對測定的影響則最小,原因是所考察的反應時間水平間跨度較大,而其它考察因素水平間相關甚小。正交優化所得最適宜條件為A3B3C2D2,即富集反應時間200 min,反應溫度22 ℃,反應體系酸度pH 5.5,復合富集劑用量為(m氟/m復合劑) = 1∶1×105。
3.4 標準曲線和最低檢測限的測定
在最適宜條件下按2.3.4.1的方法測得其E~-lgcCa標準曲線見圖4。從圖4可見,cF在1.0×10-6~1.0×10-1mol/L范圍內均有良好定量的函數關系:E=38.657 lgc-174.44 (R2=0.996)。并可求得雙點法測鈣的檢測限(LODCa=2.8×10-6mol/L)。再依據富集放大反應中鈣與氟的計量關系,便可得到本法測定氟的檢測限LODF=5.3×10-3μg/g,與高靈敏的極譜法[20]的檢測限相當。
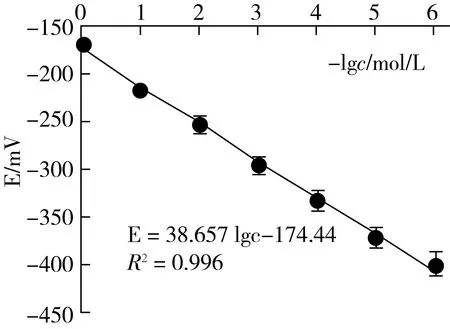
圖4 雙點電位滴定鈣離子的E~ (-lgcCa)標準曲線
3.5 精密度與準確度實驗的測定
在最適宜條件下按2.3.4.2的方法分別測得稻米和米皮中氟含量的RSD和加標實驗的回收率及其RSD,結果見表3。由表3知,測得含氟量相差甚大的稻米和受氟污染米皮的RSD為1.9%~3.9%和加標回收率為91.5%~100.3%,且氟含量低于200 μg/g樣的測定效果更佳。可見本法測氟的重現性和精確性均良好。
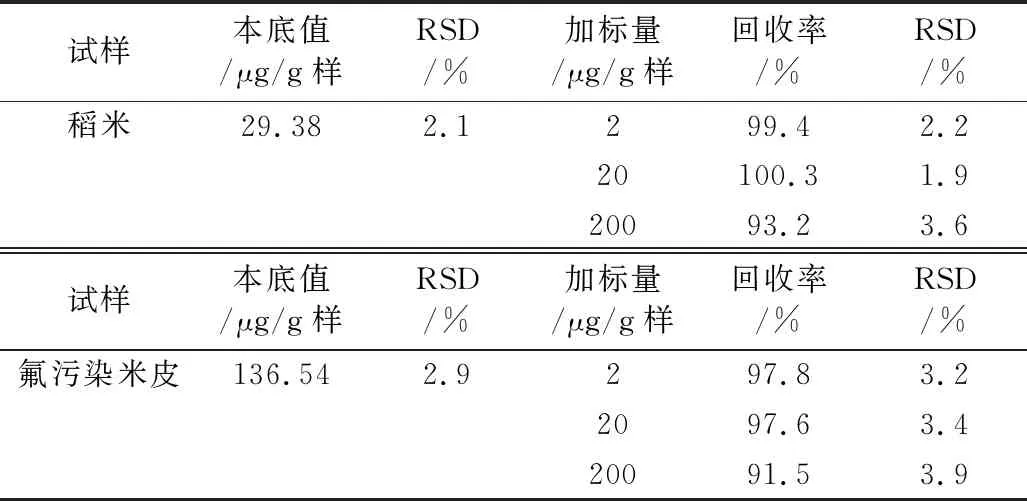
表3 本法精密度和準確度實驗結果 (n=3)
3.6 干擾因素實驗
谷物中存在的Mg2+和Fe3+會影響本法測定[15,17]。因此測量時采取的排除干擾措施是:①在復合富集劑和TISAB中均含對Mg2+和Fe3+有掩蔽作用的檸檬酸或其鹽。②雙點電位滴定法的滴定劑是對Ca2+選擇性強的EGTA而不是選擇弱的EDTA,因為在EGTA滴定Ca2+條件下Mg2+和Fe3+已轉化為難溶的氫氧化合物故不影響此測定[21]。可見本法測定均已設計了消除干擾的處理無需額外的相應措施。
3.7 實樣的測定
按2.3.1方法處理試樣,再按2.3.2在最適宜條件下進行測定,結果見表4。由表4可知,原糧中含氟量為1.27~1.48 μg/g樣,加工副產物中含氟量為1.84 ~ 2.67 μg/g樣,加工制品的小麥粉和稻米中含氟量分別為0.63 μg/g樣和0.57 μg/g樣;試樣本底和加標的測定的RSD分別為1.9%~2.7%、0.8%~2.3%,均比較穩定,但本底值的RSD比加標的稍大,且不同測定對象RSD有差異(這可能是測定對象的組成成分存在明顯差異所致)。但實驗結果是完全符合微量分析的要求。

表4 實樣及其回收率測定結果(n=3)
4 結論
通過富集放大反應和雙點電位滴定相結合的方法,可以快速、準確地測定谷物中微量至常量的氟。對谷物中氟的富集、測定方法與條件進行了驗證分析,對影響富集反應的主要參數進行了優化,所得最適條件是:含Ca2+復合富集劑用量為(m氟/m復合劑)=1∶1×105,富集反應200 min,反應溫度22 ℃,反應體系酸度pH 5.5,攪拌速率200~300 r/min,沉淀物洗滌4次。該法的LODF=5.3×10-3μg/g樣,當cF在1.0×10-6mol/L~1.0×10-1mol/L內呈良好定量關系:E= 38.657 lgc-174.44 (R2=0.996);且加標回收率為91.5%~100.3%,測定結果較穩定(RSD≤2.7%)。本法集合了富集反應的高倍放大效果和雙點電位滴定法高精準的特點,測定選擇性高,Mg2+、Fe3+干擾小,測定濃度范圍大,測定速度快,靈敏度較高,可作為微量氟的定量分析方法,為修訂GB/T5009.18-2003《食品中氟的測定》提供參考。

