光敏色素的結構及其信號調控機制
張媛媛

摘要:光信號參與并調節植物生命周期中的許多生理過程,而植物可通過自身的光感受器來感知多樣的光照信息。光敏色素(Phytochromes,phy)作為一種感知紅光/遠紅光的植物色素蛋白,在植物種子發芽、開花、發育轉變、趨光性、避陰反應等適應性應答中發揮著重要作用。光敏色素以吸收紅光的非活性形式Pr和吸收遠紅光的活性形式Pfr存在,這一差別明顯體現在二者的結構中。綜述了光敏色素兩種形式的結構差異及其信號調控機制,并以光敏色素在植物光合作用中的調節作用為例,進一步理解光敏色素對于植物生長發育的重要性,最后對未來的研究方向進行了展望。
關鍵詞:光敏色素;結構;信號調控;光合作用
中圖分類號:Q94? ? ? ? ?文獻標識碼:A
文章編號:0439-8114(2020)04-0005-05
Abstract: Light signals participate in and regulate multiple reactions in plant life cycles, and plants can obtain diverse optical information through their own photoreceptors. Phytochrome(phy) is one of the phytochrome proteins that sense red/far-red light, which plays an important role in developmental transitions such as germination and flowering, and adaptive responses such as phototropism and shade avoidance. Phytochromes exist in two interchangeable forms, the Pr form absorbs R light, whereas the Pfr form absorbs FR light, and this difference is evident in the structure of them. The structural differences and signal regulation mechanisms of the two forms of photopigmentation are reviewed. Moreover, we take the regulation of phytochrome on plant photosynthesis as an example to illustrate the significance of phytochrome for plant growth and development. Finally, the directions for future studies are discussed.
Key words: phytochrome; structure; signal regulation; photosynthesis
植物可以在兩種截然不同的光環境下完成生長發育的過程:在無光條件下的暗形態建成和光存在條件下的光形態建成[1]。暗生長的植物為黃化表型,表現為細長的下胚軸、封閉的子葉和頂端鉤,這些特征可以使幼苗在黑暗條件下利用種子中儲備的能量快速生長;光信號會抑制下胚軸的延伸,開放并擴增子葉的面積,使幼苗可以獲得最佳的捕光能力而生長[2]。但是光的波長、方向、質量和持續時間等因素會由于環境的不同而呈現出明顯的差異,如植物冠層下的光照就具有典型的特征,其中光合色素可吸收的藍光和紅光顯著減少,而綠光和遠紅光的吸收水平則相對升高。為了感知多樣的光照條件,植物自身進化出多個光感受器,包括感應UV-A/藍光的隱花素(Cryptochromes,cry)、光敏素(Phototropins)及ZTL/FKF1/LKP2;感應紅光(Red Light,RL)/遠紅光(Far-Red Light,FRL)的光敏色素等[3]。隨著分子遺傳學的發展,擬南芥已成為研究光感受器的主要模式植物。綜述了擬南芥中的光敏色素家族,以期對光敏色素的結構及其信號調控機制有更深入的理解。
1? 光敏色素的分類
擬南芥共編碼5種光敏色素蛋白,包括phyA~phyE。根據其穩定性可分為兩類:Ⅰ型是相對不穩定的蛋白,僅有phyA;Ⅱ型是相對穩定的蛋白,包含phyB~phyE[4]。光敏色素以兩種可轉化的形式存在:Pr吸收RL(λmax=660 nm),Pfr吸收FRL(λmax=730 nm)。在黑暗中生長的幼苗會合成Pr的形式,吸收RL后轉化為具有生物活性的Pfr形式;而Pfr形式又會吸收FRL快速逆轉到Pr形式,該逆轉過程也可發生在無光條件下,稱為暗逆轉或熱弛豫[5]。這一轉化機制使光敏色素具有RL/FRL依賴性的分子開關,進而表現出可控的生物活性。Pr到Pfr的轉化會觸發Pfr由細胞質向細胞核移動,從而促進光敏色素與核內轉錄因子的相互作用[6]。但不是所有的光敏色素都會在光信號下發揮作用,phyA主要存在于暗生長的黃化幼苗中,當遇到光照時,其表達量會迅速下降。Ⅱ型光敏色素普遍存在于大多數植物中,其中phyB在綠色組織中的表達最為豐富[7]。
2? 光敏色素的結構
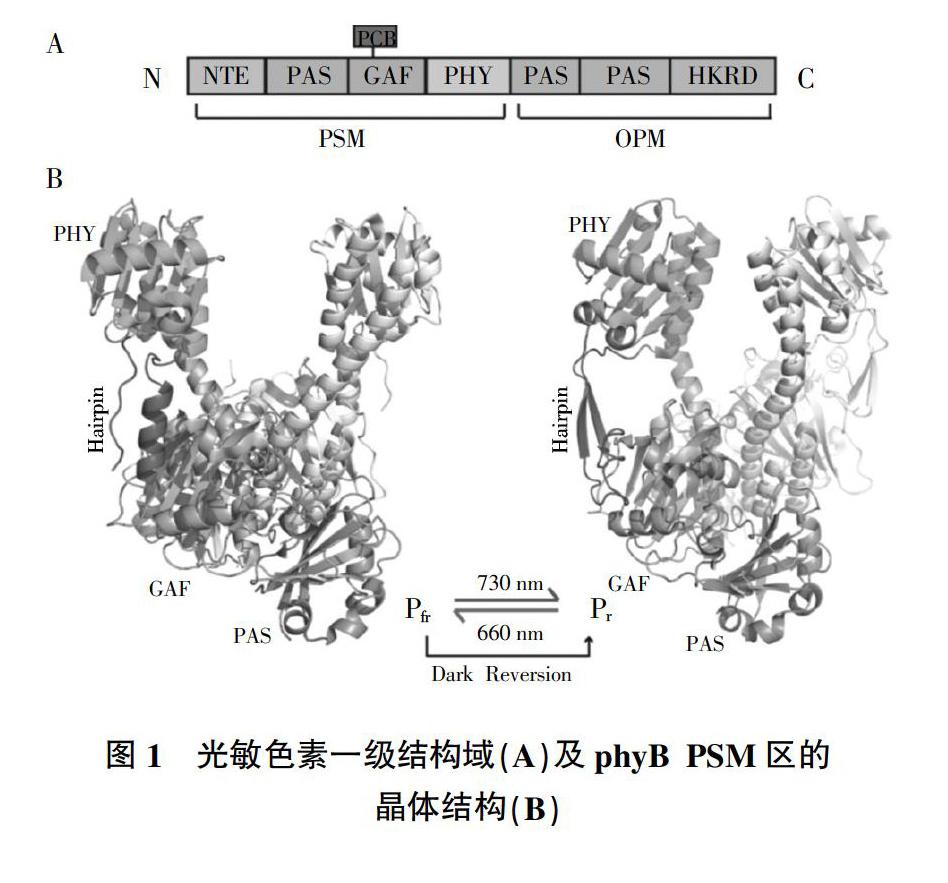
光敏色素是一種含有bilin(或稱為開四吡咯)發色團的光感受器,可以感知光的信息及變化[8]。光敏色素通常以同源二聚體的形式存在(分子質量約為250 kDa),每個單體由N端的光敏模塊(Photosensory Module,PSM)和C端的輸出模塊(Output Module,OPM)組成,其中PSM可吸收光;OPM可促進二聚化并傳遞光信號[9]。PSM依次包括N端的延伸區(N-Terminal Extension,NTE)、Per/Arnt/Sim(PAS)結構域、連接bilin的cGMP磷酸二酯酶/腺苷酸環化酶/FhlA(cGMP Phosphodiesterase/Adenylyl cyclase/FhlA,GAF)結構域及可以穩定活化形式的phy特異性(Phy-Specific,PHY)結構域;OPM包含2個連續的PAS結構域和1個組氨酸激酶相關結構域(Histidine Kinase-Related Domains,HKRD),HKRD可能通過與下游效應因子相互作用或自身的激酶活性來參與信號傳導(圖1)[10]。
2.1? GAF及發色團結構域
植物中的光敏色素以植物色素(Phytochromobilin,PCB)作為發色團,PCB通過硫醚鍵與GAF上保守的半胱氨酸結合[11]。PCB最初是在無活性的Pr形式下合成,表現為封閉的四吡咯環,吸收RL后轉化為具有生物活性的Pfr形式,封閉的四吡咯環打開并與GAF結合。轉化完成后的PCB構象發生了明顯變化,四吡咯中的環A、B、C是固定的,而環D在吸收RL后會發生旋轉(約60°),導致Z到E的異構轉換發生[12]。發生異構時,Pr首先經歷Lumi-R形式,隨后熱弛豫到Meta-R形式,最后到達Pfr形式;反之,Pfr吸收FRL后也會先形成Lumi-F和Meta-F的中間體,最后轉化為Pr形式(圖2)。有學者將bilin與GAF結合域的關鍵氨基酸突變,發現Pr到Pfr的轉化過程幾乎未受到影響,但Pfr到Pr的轉化卻受到了嚴重影響。如D307A的突變阻斷了Pfr的光轉化,使其出現脫色現象;H358A的突變中僅存在部分的bilin蛋白仍保留感光的能力,而大多數無法正確折疊[10]。這些研究結果表明,PCB發色團與GAF的結合口袋會影響光敏色素生物學功能的正常發揮。
2.2? PHY結構域
PHY結構域對于光敏色素的光化學反應也至關重要。缺失PHY序列的片段(PCB仍結合在PSM上)可以產生Pr,但不能實現光轉化。觀察Pr和Pfr的結構,可以發現PHY結構域中發夾結構的構象發生了明顯改變,由Pr中反向平行的β-折疊重新排列為Pfr中的α-螺旋,進而使發夾結構與GAF的接觸也發生改變(圖1B)[12]。發夾結構與GAF的接觸對于Pr形式的形成不是必要的,但對于Pr/Pfr互換及Pfr的熱穩定性是非常關鍵的。如R582A的突變會使其熱轉變減慢25倍;S584A和S584E的突變會使其熱轉變加快750倍[10]。同時,發夾結構的變化信息可能會傳輸到OPM區域,導致姐妹單體的位置發生變化而觸發下游信號。
此外,富含甘氨酸/絲氨酸的NTE結構域對于光的吸收及Pfr的穩定性和生物活性至關重要。缺失NTE序列的突變體最大光吸收值向短波段移動,熱轉化的速率也明顯加快。
3? 光敏色素的信號調控機制
在光照條件下,phyA和phyB的表達被顯著抑制,由黑暗至RL的轉化期間,phyA的表達水平會迅速降低50到100倍,phyB的表達水平會逐漸降低4到5倍[13]。
phyA的表達受到轉錄及翻譯后水平上多種因子的負調控,且RL/FRL也會強烈降低phyA基因的轉錄,這與phyA座位處組蛋白修飾的變化存在一定關聯,如H3K9/14ac、H3K27ac和H3K4me3可以增強黑暗中phyA的活化;H3K27me3可以抑制光照下phyA的表達[14]。PhyA的Pfr形式會經歷由E3泛素連接酶Cullin4(CUL4)、DNA損傷結合蛋白1(Damaged DNA Binding Protein1,DDB1)、組成型光形態建成1(Constitutively Photomorphogenic1,COP1)和表面活性物質A(Surfactant Protein A,SPA)組成的復合物所介導的泛素-蛋白酶體依賴性的降解過程[15]。光照中磷酸化的phyA可以增強COP1-SPA復合物與phyA的識別,因為未磷酸化的phyA會優先與FHY1/FHY3相互作用[16]。phyA的降解主要發生在細胞質與細胞核中,在細胞核中的降解速度更快[17]。
phyB的表達調控主要發生在翻譯后水平上,因為擬南芥中phyB基因的轉錄相對不受到光的影響。phyB的降解主要由COP1介導[18],且光條件下的phyB會受到光敏色素相互作用因子(Phytochrome Interacting Factor,PIF)的負調節,PIF也可通過增強phyB和COP1之間的相互作用來促進phyB的泛素化[19]。
3.1? Cullin4-RING泛素連接酶抑制光形態建成
CUL4是多亞基的Cullin-RING泛素連接酶超家族中的一員,成員間具有相似的結構特征,其N末端可與適配體及底物結合以識別靶蛋白,C末端可與催化亞基RING結合[20]。在無光情況下,幼苗抑制光形態建成的研究可利用去黃化(De-etiolated,DET)或COP表型的擬南芥植株實現,通過遺傳學篩選并鑒定出一組抑制光形態建成的因子,如DET1、COP1、COP10、SPA1-4和COP9信號小體(COP9 Signalosome,CSN)[13]。這些阻遏蛋白質主要參與3種由泛素-蛋白酶體介導的蛋白質降解過程,包括2種CUL4-E3泛素連接酶(CUL4-DDB1-DET1-COP10復合物和CUL4-DDB1-COP1-SPA復合物)和CSN,CSN是一種高度保守的蛋白質復合物,可催化Cullin的類泛素化修飾反應[21]。也有研究表明,光敏色素可抑制DET-COP在光環境中的功能,然而其機制尚未完全清楚[22]。有學者猜測可能是通過調節COP1在核/質中的定位或是下調SPA1和SPA2的蛋白表達來調節COP1-SPA復合物的形成,也有人認為該機制和隱花素在調節COP1-SPA1形成及COP1-SPA1與靶蛋白相互作用中的機制類似[23]。
3.2? PIF調節光敏色素信號
在細胞核中,光敏色素可與多個因子相互作用,通過調節下游靶基因的轉錄來調控光應答反應。PIF是其中一類具有廣泛調節能力的轉錄因子,由堿性螺旋-環-螺旋(Basic Helix-Loop-Helix,bHLH)轉錄因子超家族的子集編碼[24]。擬南芥中包含8種PIFs,分別為PIF1~PIF8。所有的PIFs都具有與phyB結合的能力,PIF1和PIF3可同時與phyA和phyB結合[25]。除PIF2外,其余的PIFs都可以和光調節基因中的G-box(CACGTG)基序結合,表現為轉錄過程中的激活子或抑制子。PIFs的生物學功能常出現重疊,在去黃化期間,PIF1、PIF3、PIF4、PIF5和PIF7均可參與下胚軸的生長抑制[26];PIF1、PIF3和PIF5可通過下調編碼葉綠素合成酶中關鍵基因的表達來抑制葉綠體的發育[27]。PIF2的功能是比較獨特的,其可在體內與COP1和phyB相互作用(COP1在無光條件下降解PIF2,phyB在光照條件下穩定PIF2),且PIF2還會與PIF1、PIF3、PIF4和PIF5相互作用來抑制其表達[28]。
PIF的N末端含有與光敏色素相互作用的結構域,C末端為bHLH的DNA結合域和形成二聚化的結構域,PIF會優先與光敏色素的活性形式Pfr結合[29]。PIF是光敏色素由暗反應到光反應過渡的關鍵調節器,可以抑制光形態建成并維持黃化幼苗在黑暗中的生長,通常作為光應答的負調節子發揮作用(PIF6為正調節子)[30,31]。在光照條件下,光敏色素可通過快速磷酸化、泛素化及蛋白酶體介導的降解過程來抑制PIF的功能,實現光形態建成的過程。此外,PIF還在介導生物鐘相關的新陳代謝信號[32]、調節熱形態發生[33]和控制生長調節劑信號[34]等途徑中發揮重要的作用。
4? 光敏色素對光合作用的調節
光敏色素參與調控了植物生長周期中的多個生理過程,如種子萌發、幼苗生長、開花等發育轉變和趨光性、晝夜節律、避陰反應等適應性應答,而關于光敏色素在光合作用中的功能研究是相對少的[35]。由環境中的壓力因素引起的氧化應激抗性是表征光合作用元件(Photosynthetic Apparatus,PA)狀態的重要參數之一[36]。光敏色素有助于植物的PA適應氧化應激的發展,數據表明,提高Pfr/Ptotal(Ptotal=Pfr+Pr)比例或光敏色素的表達量可以幫助光合作用在脅迫條件下的正常發生[37]。
Pfr含量通常取決于植物所處環境的RL/FRL[38],將長時間暴露在黑暗中的植物進行短期的RL照射后,Pfr含量會明顯增加。足夠高的Pfr/Ptotal比例對于維持成熟葉片中的葉綠素水平和老化葉片中葉綠體的結構完整性是必要的[39]。使用365 nm的UV照射會加速葉綠素的流失,再以5 min/d的低強度的RL照射7 d后,由UV-A照射導致的葉綠素減少可被部分消除[40]。UV-A會增強脂質過氧化,這可能是由于其照射時會產生較高水平的活性氧。當使用UV-A和RL的組合照射時,葉綠素的流失會明顯減緩,可見高Pfr/Ptotal比例會降低植物對氧化應激的敏感性。
此外,光敏色素的表達量也會影響光合作用的進行。擬南芥下胚軸的hy1和hy2突變體會由于PCB的生物合成減少而下調所有光敏色素的表達[41];hy3突變體會使phyB的蛋白表達量下降20~50倍,轉錄物下降20~30倍,但phyA不受影響[42]。已知用RL照射的植物會降低由UV照射引起的葉綠素損失,然而對于hy2和hy3突變體,RL的照射幾乎是無作用的,表明phyB的存在對于葉綠素生物合成是必要的[43]。同時,擬南芥phyA-211和phyB-9雙突變體與野生型相比會顯示出較大的UV-C抗性差異,僅phyB-9突變體與野生型無明顯差別,表明phyA與phyB類似,對于植物氧化應激的抗性維持非常重要[44,45]。此外,在馬鈴薯、番茄、棉花和水稻中的多組試驗也體現了phyA和phyB對于葉綠素生物合成的重要性[37]。可見phyA和phyB是葉綠素生物合成的重要參與者,二者對于脅迫條件下光合作用的正常進行至關重要。
5? 討論
植物不僅通過光合作用將太陽能轉化為化學能,還可利用光來調節生命周期中的多個生理過程,因此針對光敏色素的結構與信號調控機制的研究由來已久,但是仍然存在許多問題亟待解決。目前,雖然擬南芥phyB的晶體結構已被解析,但是相比于原核生物,對植物中光敏色素結構信息的了解還不夠,如PSM和OPM間有怎樣的相互作用,PAS結構域對于光敏色素的功能有怎樣的影響,對于結構中各個模塊的功能及相互聯系的認識,是深入探究光敏色素的信號與功能的前提。
許多因子都會與光敏色素相互作用以調控其信號傳導,而轉錄后及翻譯后的修飾更加顯著地增加了其信號傳導的多樣性,使光敏色素表現出更為豐富的功能。此外,光敏色素自身的表達也存在時空特異性,根據特定細胞器、組織及器官中感受光及光反應的不同而表現出更多的可能性。多因素介導的復雜的調控機制增加了對于光敏色素信號調控機制的研究難度,而光敏色素調節的生物學應答及介導的生理學功能都需要深入研究。
目前,光敏色素的研究主要集中在擬南芥、藍細菌等生物中[46],那么在擬南芥中的調節機制是否適用于農作物呢,尤其是在光對于養分的吸收和利用等問題的研究中,這對于改良并發展可持續農業至關重要。同時,光遺傳學的發展也使研究者將更多的目光聚集在感光蛋白的研究上,利用光敏色素的激活系統可能會開發出更為強大的新型系統控制機制。因而,闡明光敏色素的結構與信號調控機制對于深入理解其功能,實現多領域的交叉研究有著重要的意義。
參考文獻:
[1] VICZIAN A,KLOSE C,ADAM E,et al. New insights of red light-induced development[J].Plant,cell & environment,2017, 40(11):2457-2468.
[2] INOUE K,NISHIHAMA R,KOHCHI T. Evolutionary origin of phytochrome responses and signaling in land plants[J].Plant, cell & environment,2017,40(11):2502-2508.
[3] XU X,PAIK I,ZHU L,et al. Illuminating progress in phytochrome-mediated light signaling pathways[J].Trends Plant Sci,2015,20(10):641-650.
[4] PHAM V N,KATHARE P K,HUQ E. Phytochromes and phytochrome interacting factors[J].Plant physiology,2018,176(2):1025-1038.
[5] KAMI C,LORRAIN S,HORNITSCHEK P,et al. Light-regulated plant growth and development[J].Curr Top Dev Biol,2010,91:29-66.
[6] KLOSE C,VICZIAN A,KIRCHER S,et al. Molecular mechanisms for mediating light-dependent nucleo/cytoplasmic partitioning of phytochrome photoreceptors[J].New Phytol,2015,206(3): 965-971.
[7] KRAHMER J,GANPUDI A,ABBAS A,et al. Phytochrome,carbon sensing,metabolism,and plant growth plasticity[J].Plant physiology,2018,176(2):1039-1048.
[8] WOITOWICH N C,HALAVATY A S,WALTZ P,et al. Structural basis for light control of cell development revealed by crystal structures of a myxobacterial phytochrome[J].IUCrJ,2018,5:619-634.
[9] NAGATANI A. Phytochrome:Structural basis for its functions[J].Curr Opin Plant Biol,2010,13(5):565-570.
[10] BURGIE E S,BUSSELL A N,WALKER J M,et al. Crystal structure of the photosensing module from a red/far-red light-absorbing plant phytochrome[J].Proc Natl Acad Sci USA,2014,111(28):10179-10184.
[11] FULLER F D,GUL S,CHATTERJEE R, et al. Drop-on-demand sample delivery for studying biocatalysts in action at X-ray free-electron lasers[J].Nat Methods,2017,14(4):443-449.
[12] BURGIE E S,ZHANG J,VIERSTRA R D. Crystal tructure of deinococcus phytochrome in the photoactivated state reveals a cascade of structural rearrangements during photoconversion[J].Structure,2016,24(3):448-457.
[13] CHEN M,CHORY J. Phytochrome signaling mechanisms and the control of plant development[J].Trends Cell Biol,2011,21(11):664-671.
[14] JANG I C,CHUNG P J,HEMMES H,et al. Rapid and reversible light-mediated chromatin modifications of Arabidopsis phytochrome A locus[J].Plant cell,2011,23(2):459-470.
[15] ZHOU Y Y,YANG L,DUAN J,et al. Hinge region of Arabidopsis phyA plays an important role in regulating phyA function[J].Proc Natl Acad Sci USA,2018,115(50):11864-11873.
[16] PODOLEC R,ULM R. Photoreceptor-mediated regulation of the COP1/SPA E3 ubiquitin ligase[J].Curr Opin Plant Biol,2018,45(Pt A):18-25.
[17] USHIJIMA T,HANADA K,GOTOH E,et al. Light controls protein localization through phytochrome-mediated alternative promoter selection[J].Cell,2017,171(6):1316-1325.
[18] LU X D,ZHOU C M,XU P B,et al. Red-light-dependent interaction of phyB with SPA1 promotes COP1-SPA1 dissociation and photomorphogenic development in Arabidopsis[J].Mol Plant,2015,8(3):467-478.
[19] PARK E,KIM Y,CHOI G. Phytochrome B requires PIF degradation and sequestration to induce light responses across a wide range of light conditions[J].Plant cell,2018,30(6):1277-1292.
[20] BULATOV E,CIULLI A. Targeting Cullin-RING E3 ubiquitin ligases for drug discovery:Structure,assembly and small-molecule modulation[J].Biochem J,2015,467(3):365-386.
[21] CAVADINI S,FISCHER E S,BUNKER R D,et al. Cullin-RING ubiquitin E3 ligase regulation by the COP9 signalosome[J].Nature,2016,531(7596):598-603.
[22] HUANG X,OUYANG X,DENG X W. Beyond repression of photomorphogenesis:Role switching of COP/DET/FUS in light signaling[J].Curr Opin Plant Biol,2014,21:96-103.
[23] HOLTKOTTE X,PONNU J,AHMAD M,et al. The blue light-induced interaction of cryptochrome 1 with COP1 requires SPA proteins during Arabidopsis light signaling[J].PLoS Genet,2017, 13(10):e1007044.
[24] SHEERIN D J,HILTBRUNNER A. Molecular mechanisms and ecological function of far-red light signalling[J].Plant cell environment,2017,40(11):2509-2529.
[25] DUBREUIL C,JI Y,STRAND A,et al. A quantitative model of the phytochrome-PIF light signalling initiating chloroplast development[J].Sci Rep,2017,7(1):13884.
[26] LEE H J,JUNG J H,CORTES LLORCA L,et al. FCA mediates thermal adaptation of stem growth by attenuating auxin action in Arabidopsis[J].Nat Commun,2014,5:5473.
[27] ZHANG Y,LIU Z,CHEN Y,et al. PHYTOCHROME-INTERACTING FACTOR 5 (PIF5) positively regulates dark-induced senescence and chlorophyll degradation in Arabidopsis[J].Plant Sci,2015,237:57-68.
[28] LUO Q,LIAN H L,HE S B,et al. COP1 and phyB physically interact with PIL1 to regulate its stability and photomorphogenic development in Arabidopsis[J].Plant cell,2014,26(6):2441-2456.
[29] LEE N,CHOI G. Phytochrome-interacting factor from Arabidopsis to liverwort[J].Curr Opin Plant Biol,2017,35:54-60.
[30] BURGIE E S,VIERSTRA R D. Phytochromes:An atomic perspective on photoactivation and signaling[J].Plant cell,2014, 26(12):4568-4583.
[31] PENFIELD S,JOSSE E M,HALLIDAY K J. A role for an alternative splice variant of PIF6 in the control of Arabidopsis primary seed dormancy[J].Plant Mol Biol,2010,73(1-2):89-95.
[32] SHOR E,PAIK I,KANGISSER S,et al. PHYTOCHROME INTERACTING FACTORS mediate metabolic control of the circadian system in Arabidopsis[J].New Phytol,2017,215(1):217-228.
[33] QUINT M,DELKER C,FRANKLIN KA,et al. Molecular and genetic control of plant thermomorphogenesis[J].Nat Plants,2016,2:15190.
[34] PAIK I,KATHARE P K,KIM J I,et al. Expanding roles of PIFs in signal integration from multiple processes[J].Mol Plant,2017,10(8):1035-1046.
[35] LIU X,LI Y,ZHONG S W. Interplay between light and plant hormones in the control of arabidopsis seedling chlorophyll biosynthesis[J].Front Plant Sci,2017,8:1433.
[36] ASADA K. Production and scavenging of reactive oxygen species in chloroplasts and their functions[J].Plant physiology,2006,141(2):391-396.
[37] KRESLAVSKI V D,LOS D A,SCHMITT F J,et al. The impact of the phytochromes on photosynthetic processes[J].Biochim Biophys Acta Bioenerg,2018,1859(5):400-408.
[38] SAKURABA Y,YANAGISAWA S. Light signalling-induced regulation of nutrient acquisition and utilisation in plants[J].Semin Cell Dev Biol,2018,83:123-132.
[39] BROUWER B,GARDESTROM P,KEECH O. In response to partial plant shading, the lack of phytochrome A does not directly induce leaf senescence but alters the fine-tuning of chlorophyll biosynthesis[J].J Exp Bot,2014,65(14):4037-4049.
[40] KRESLAVSKI V D,LYUBIMOV V Y,SHIRSHIKOVA G N, et al. Preillumination of lettuce seedlings with red light enhances the resistance of photosynthetic apparatus to UV-A[J].J Photochem Photobiol B,2013,122:1-6.
[41] PARKS B M,QUAIL P H. Phytochrome-deficient hy1 and hy2 long hypocotyl mutants of Arabidopsis are defective in phytochrome chromophore biosynthesis[J].Plant cell,1991,3(11):1177-1186.
[42] SOMERS D E,SHARROCK R A,TEPPERMAN J M,et al. The hy3 long hypocotyl mutant of Arabidopsis is deficient in phytochrome B [J].Plant cell,1991,3(12):1263-1274.
[43] KRESLAVSKI V D,SHIRSHIKOVA G N,LYUBIMOV V Y, et al. Effect of preillumination with red light on photosynthetic parameters and oxidant-/antioxidant balance in Arabidopsis thaliana in response to UV-A[J].J photochem photobiol B, 2013,127:229-236.
[44] KHUDYAKOVA A Y,KRESLAVSKI V D,SHIRSHIKOVA G N,et al. Resistance of Arabidopsis thaliana L. photosynthetic apparatus to UV-B is reduced by deficit of phytochromes B and A[J].Journal of photochemistry and photobiology B:Biology,2017,169:41-46.
[45] REED J W,NAGPAL P,POOLE D S,et al. Mutations in the gene for the red/far-red light receptor phytochrome B alter cell elongation and physiological responses throughout Arabidopsis development[J].Plant cell,1993,5(2):147-157.
[46] WILTBANK L B,KEHOE D M. Diverse light responses of cyanobacteria mediated by phytochrome superfamily photoreceptors[J].Nat Rev Microbiol,2019,17(1):37-50.

