白酒釀造中雜醇油調控技術的研究進展
張敏倩,劉功良*,費永濤,白衛東,艾連中,俞劍燊
(1.仲愷農業工程學院輕工食品學院,廣東廣州 510225;2.上海理工大學醫療器械與食品學院,上海 200093;3.上海金楓酒業股份有限公司,上海 200120)
白酒的香氣特征和口感是由酒體中的醇類、酯類和酸類等物質所決定。其中醇類中的雜醇油在適量的情況下會使酒體更為和諧,但雜醇油含量過高不僅會破壞酒體風格,還會引起飲后“上頭”等不適現象。雜醇油的含量對白酒風味的影響至關重要。
目前,雜醇油的形成機制可歸結為降解代謝機制和合成代謝機制,但雜醇油在白酒中的代謝機制仍未得到系統闡述,調控雜醇油代謝的方法可分為兩大類:釀造工藝改進;菌種選育及代謝調控。
因此,本文結合雜醇油的形成機理,對歷年來研究學者從白酒生產中的各階段對雜醇油的調控進行歸類和總結,為白酒中雜醇油的有效控制提供新思路。
1 雜醇油的形成機制
雜醇油又稱高級醇,是指3個碳原子以上的一元醇類。正丙醇、正丁醇、異丁醇、異戊醇、活性戊醇、β-苯乙醇、辛醇、色醇和酪醇是白酒中的主要雜醇油[1-3]。研究表明,酵母雜醇油的代謝機制主要有降解代謝機制和合成代謝機制。
1.1 降解代謝機制(Ehrlich代謝機制)
Ehrlich代謝機制如下:

圖1 Ehrlich代謝機制Fig.1 Metabolic mechanism of Ehrlich
在酵母酒精發酵過程中,氨基酸在線粒體中受胞質支鏈氨基酸轉移酶(branched-chain amino acid transferases,BCAATases)的作用將氨基轉移到相應的α-酮酸上;α-酮酸經特定的酮酸脫羧酶催化后,脫羧形成相應的醛[4];醛再經醇脫氫酶作用進一步還原為相應的高級醇[5]。研究表明,異丁醇、異戊醇、活性戊醇的降解產物分別是纈氨酸、亮氨酸、異亮氨酸,因此它們也被稱為支鏈醇[6]。氨基酸與相應雜醇油的關系見表1。

表1 降解代謝機制中氨基酸的代謝產物Table 1 Metabolites of amino acids in metabolic mechanism of degradation
1.2 合成代謝機制(Harris代謝機制)
Harris代謝機制如下:
葡萄糖經糖酵解途徑(embden-meyerhof-parnaspathway,EMP)形成丙酮酸,在乙酰羥酸合酶的作用下進入氨基酸的生物合成途徑形成α-酮酸中間體,進一步在相應的脫羧酶和脫氫酶的催化下發生還原反應生成相應的高級醇。其中,α-酮酸脫羧酶普遍存在于酵母、真菌但在細菌中并不常見[7]。
在傳統的白酒釀造過程中,雜醇油主要由釀酒酵母產生[8]。Ehrlich代謝機制和Harris代謝機制在酵母中參與雜醇油的合成存在一定比例,雜醇油中大部分低碳鏈醇是由酵母合成代謝機制生成的。據以往研究表明[9]高級醇中的低鏈醇如異戊醇、異丁醇和活性戊醇,75%由合成代謝途徑生成,25%來自降解代謝機制,這可能是由于Harris代謝機制中的中間體丙酮酸較易轉變為低分子的α-酮酸。若酒醪中的蛋白質分解不足,導致氨基酸含量偏低,則會加速糖類合成高級醇。
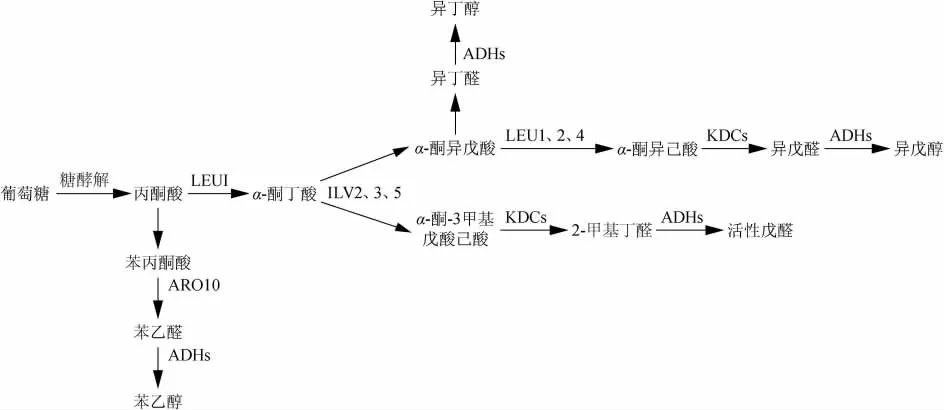
圖2 Harris代謝機制Fig.2 Metabolic mechanism of Harris
2 白酒釀造過程中雜醇油的調控技術
2.1 通過優化發酵工藝降低雜醇油
2.1.1 酒曲比例的優化
酒曲被譽為“酒之骨”、“酒之魂”,其按制曲原料可分為麥曲和米曲。酒曲中的微生物一般包括霉菌、細菌和酵母菌;微生物在發酵時產生的各類酶與微生物共存于酒曲原料中,形成了集糖化力、蛋白質分解力和產酯力于一身的粗酶制劑[10]。因此不同酒曲間的差異不僅在微生物的菌落結構,所含酶的種類與數量及其活力也不盡相同。雜醇油是各類酶作用下的產物。
羅惠波等[11]在濃香型白酒釀造過程中的拌曲階段分別梯度添加一定量的酵母、糖化酶、蛋白酶和α-淀粉酶,通過氣質聯用檢測酒醅中雜醇油的含量。結果表明,添加糖化酶和干酵母的樣品雜醇油產量較低;添加蛋白酶的樣品,其雜醇油的產量增加,而α-淀粉酶的添加對雜醇油產量沒有顯著影響。孫金旭等[12-13]研究了醬香型白酒發酵過程中酶對雜醇油含量的影響,結果表明,添加糖化酶的實驗組雜醇油總量降低了48.28%,糖化酶的添加對控制醬香型白酒發酵產生雜醇油具有顯著效果。唐取來等[14-15]通過加入酶制劑或純種培養酵母協同酒曲發酵得到的米香型白酒經工藝優化,其總酯、酒精度均有提高,而加入酵母的白酒其雜醇油含量也有所下降。
因此,無論何種香型的白酒,添加至酒曲中酶的類型和含量對雜醇油有一定的影響,其中糖化酶用量的增加能有效降低雜醇油的生成量,這可能是由于糖化酶用量的增加,淀粉更快地轉化為還原糖,當酵母量充足的情況下,會迅速消耗糖分,而對氨基酸的作用不充分,從而降低雜醇油的生成。
2.1.2 發酵條件的優化
在白酒發酵過程中,雜醇油含量的高低與白酒的發酵條件息息相關。
在適當濃度的同化氮源下,酵母會優先利用氮源并生成氨基酸;在氨基酸含量充足的情況下,酵母通過降解代謝機制利用氨基酸合成雜醇油,與此同時,酵母通過合成代謝機制生成雜醇油的代謝通量會降低,綜合作用使得雜醇油的合成量降低。楊生智等[16]在小曲白酒拌曲階段添加不同氮源,對比五種同化氮源對雜醇油生成量的影響。實驗結果表明,添加0.4%的碳酸氫銨能有效降低雜醇油的生成量。宋瑞濱等[17]以濃香型白酒作為研究對象,研究人工窖泥制作、用曲量、投料量、窖泥pH、不同發酵輪次、不同發酵周期等對正丁醇生成的影響,實驗表明,窖泥配方不合理是造成正丁醇含量偏高的主要原因,同時加強窖池保養、適當提高用曲量和降低投料量,能有效降低糟醅正丁醇的含量。黃婷等[18]考察酵母接種量、糖化時間、發酵液料比以及發酵溫度對米香型白酒的雜醇油含量和出酒率的影響,結果表明,合適的工藝條件能保證高出酒率的情況下同時降低米香型白酒中雜醇油的含量。HAN Q A等[19]在白酒發酵期間加入從蘋果皮中提取的粗酶液,結果表明,從富士蘋果中提取的粗酶液能降解醇類物質(正己醇、正丙醇、異丁醇和異戊醇)效果最佳,對于降低白酒中的雜醇油有較好的效果。不同香型的白酒因其原料,酒曲以及發酵工藝的不同,導致整個微生物系統在發酵過程中也截然不同。因此,雜醇油的控制應是考慮針對單一香型的白酒建立并優化一套實用合理的發酵工藝。
2.1.3 蒸餾條件的優化
蒸餾操作對于降低白酒中的雜醇油亦具有一定的效果。“掐頭去尾”指掐去高酒精度的酒頭,去掉低酒精度的酒尾,這主要是由于雜醇油屬于一元醇類,其化學結構中含有的氫鍵導致雜醇油相比乙醇而言,其與水分子氫鍵締合強度更弱而在蒸酒過程中更易揮發,因此,掐去酒頭可以降低酒中雜醇油含量[20]。孫慧[21]認為僅通過“掐頭去尾”的方式是無法一勞永逸地降低白酒中雜醇油的含量,截頭雖然可以降低雜醇油的含量,但酒頭中的總酯含量也高,尤其是呈香好,香味濃的乙酸乙酯,故“掐頭”這一蒸餾操作取決于蒸餾酒中雜醇油含量是否超標。郭梅君等[22]利用慢速蒸餾結合精餾酒頭降低米酒雜醇油含量,研究數據表明,當截取的酒頭比例為10%~30%,雜醇油的去除率達到23.5%~60.0%,同時保留了白酒原有風格,使酒的香氣和口感大大提升。
有效的蒸餾裝備與優化的蒸餾條件固然可降低雜醇油的含量,但各酒廠的實際情況不同,其中可能存在蒸餾裝置昂貴引起的投資成本大和風險高等問題,因此,可尋找合適的工藝方法,降低酒中雜醇油的含量。
2.2 通過篩選或改造微生物降低雜醇油
雜醇油是酵母發酵的副產物,其產量的多少最終取決于酵母代謝途徑。因此,可圍繞酵母菌種的選育開展研究,通過自然選育、菌種誘變或通過基因工程等方法獲取低產雜醇油的酵母菌株。
2.2.1 選育低產雜醇油的菌株
自然選育用于篩選低產雜醇油的酵母菌是最為傳統的育種方法。陳良強等[23]從醬香型白酒大曲和酒醅中獲得一株低產高級醇且高產乙醇的粟酒裂殖酵母,其異丁醇和異戊醇的產量僅為其他粟酒裂殖酵母的51.0%和53.4%。梁璋成等[24]從福建紅曲中通過設計溫度梯度實驗篩選低產雜醇油的酵母菌株JH301,在加入糖化酶和淀粉酶的無菌糯米培養基中進行培養,其雜醇油產量僅為117.12 mg/L。衛云路等[28]從酒曲中分離純化一株同時具備低產雜醇油和高產酒精能力的釀酒酵母,并將其添加至米曲中,結合發酵新工藝,雜醇油含量明顯下降。
利用微生物誘變育種選育低產雜醇油的菌株也是有效方法之一。朱莉娜等[25]通過微波誘變選育出低產雜醇油的啤酒酵母。王國正等[26]對低產雜醇油的酵母菌株CF4采用常溫常壓等離子體誘變方法,篩選一株雜醇油生成量降低了20%的酵母ARTP5。
張翠英等[27]將低產雜醇油釀酒酵母工程菌株加入到小曲酒的釀造中,以研究低產雜醇油的酵母菌對白酒發酵的影響,研究結果顯示,酵母AYΔBAT2的添加對于采用半固態發酵的小曲酒而言,正丙醇、異丁醇和異戊醇分別降低了20.6%、32.3%和50.8%,同時對小曲酒的酒精度、殘糖、總酸和總酯基本無影響。
使用低產雜醇油酵母,可減少白酒發酵過程中雜醇油的生成,但白酒是多種微生物混合發酵、共同作用下的產物。雜醇油的降低可能是一兩種醇類如異丁醇或異戊醇含量的降低,但其他雜醇油物質的含量可能不變甚至增高。此外,部分細菌和真菌也能產生雜醇油,其代謝產物對改良的酵母菌株的影響機制尚不清楚,對于純種發酵的啤酒而言,選育低產雜醇油的菌株是高效的途徑;但對于混菌發酵的白酒而言,這未必是最有效的途徑。因此,研究白酒發酵過程中微生物菌群與雜醇油產量的關系更加意義重大。
2.2.2 基因工程誘變育種
由基因Bat1p和Bat2p催化的Ehrlich途徑的轉氨酶反應是反應中主要的限速步驟,編碼基因的缺失會影響雜醇油的形成[29-32]。ZHANG C Y等[33]以工業酵母菌株作為工程株,刪除其編碼BCAATases的基因BAT2,以減少黃酒發酵過程中產生的雜醇油,成功構建了BAT2單基因缺失二倍體突變株,產生的雜醇油含量顯著減少,同時改造過的酵母菌株其生長和發酵性性能正常。
YOSHIMOTO H等[34]為了鑒定α-酮異辛酸酯脫羧生成異戊醇所涉及的酶和基因,對酶進行了部分純化,并進行了質譜分析,遺傳分析表明,在PDC1缺失突變體中,α-酮異辛酸酯脫羧酶活性和異戊醇產量部分下降,而在攜帶PDC1基因的多拷貝質粒的轉移子中,α-酮異辛酸酯脫羧酶活性和異戊醇產量增加。這表明了釀酒酵母中的PDC1基因編碼的丙酮酸脫羧酶部分地參與了α-酮異辛酸酯脫羧酶的脫羧作用,若刪除該基因能降低酵母發酵中產生的異戊醇,但刪除該基因對其生長與發酵性能的影響尚未有學者研究。李維等[35-36]以釀酒酵母AY-15作為實驗菌通過分子育種技術對其單倍體α-5進行ATF1的過表達并使其缺失BAT2,單倍體重組后的雜交體經同樣的培養條件,異戊醇和異丁醇的產量大幅下降。
DICKENSON J R等[37-39]報導的YDL080C基因編碼的類丙酮酸脫羧酶是α-酮基異己酸生成異戊醇的代謝途徑中的關鍵酶,敲除YDL080C基因可使異戊醇的生成量顯著降低。李童等[40]構建YDL080C基因缺失工程菌產生的異戊醇含量與親本并無明顯差異,該實驗結果與郝欣等[41]在釀酒酵母中的研究結果相同,說明類丙酮酸脫羧酶并非異戊醇的代謝途徑中的關鍵酶。
低產雜醇油基因工程菌的構建及相關研究,采用的培養基不完全相同但風味物質的形成與培養基的成分密切相關[42-43],因此,篩選低產雜醇油酵母的應用存在一定局限性。
2.3 降低雜醇油的其他技術
新釀酒的合理貯存可降低酒體中雜醇油含量,一般包括吸附法,生物膜透析法,機械過濾,重新翻烤或勾兌等方法[44]。HSIEH C W等[45]采用納濾法和超濾法研究了白酒中雜醇油的去除效果,結果表明,納濾膜去除酒中雜醇油的效率高于超濾膜,可去除酒中44%的雜醇油。
2.4 白酒釀造微生物與雜醇油的關系
白酒的釀造體系是霉菌、酵母和細菌相互作用下所形成的穩定的微生態系統,其中霉菌在白酒釀造過程中主要起糖化作用,部分霉菌如根霉其細胞含有的酒化酶可同時進行糖化和發酵,使得發酵速率提高導致小曲酒的出酒率上升,這對酒的風味和品質都具有重要的作用[46]。孫樂平等[47]經關聯分析發現,異戊醇的產生與嗜熱真菌屬(Thermomyces)呈負相關,嗜熱真菌屬可能參與異戊醇的分解代謝,可能對高級醇的控制具有積極的效果。
在白酒釀造過程存在多種酵母的共同作用,其中釀酒酵母是優勢酵母,具有較高的酒精發酵能力;非釀酒酵母,主要為產酯酵母,其產酒能力相對較弱,但在白酒釀造中可以將霉菌糖化產生的還原糖或其他微生物分解所得的氨基酸等前體物質轉化為白酒的重要風味物質,如醛、酯、高級醇等[48]。DICKINSON J R[37]的研究結果表明釀酒酵母能將纈氨酸合成異丁醇。
細菌是白酒釀造中的重要微生物之一,是白酒香氣來源的主力軍。在濃香型白酒的發酵過程中,如梭狀芽孢桿菌中的己酸菌和丁酸菌,會利用酒醅浸潤到窖泥中的營養物質產生己酸和丁酸,在相關酶的作用下生成己酸乙酯和丁酸乙酯,形成濃香型白酒的特征香氣成分[49];梭狀芽胞桿菌也是丁醇的天然生產者,它能在合適的發酵條件下產生大量丁醇[50]。在此外,乳酸菌在白酒釀造過程中不僅起產酸作用,同時也有利于酒醅中的成分發生美拉德反應,從而促進香氣物質的形成[51]。白酒的釀造過程中,參與的微生物種類成百上千,若沒有這些功能菌,也無法釀造各類白酒。
酵母與真菌之間相互作用,主要表現在酵母作為生物防治劑,對真菌有拮抗作用,絲狀真菌則提供相應的水解酶類分解復雜的底物,為酵母的生長和發酵提供底物,而酵母將底物轉化為乙醇和風味物質[51]。
目前國內關于白酒中微生物相互影響的研究鮮有報道,但白酒是多菌種混合發酵,發酵過程中微生物之間的協同、拮抗和抑制等相互作用是應予以重視。單菌種發酵對雜醇油形成的影響是必然的,而多菌種發酵對雜醇油的形成機制的具體作用機理,也是潛在的研究熱點。
3 小結
白酒有多種香型之分,其釀造曲種與發酵工藝也不盡相同。從曲種的制備到原酒的貯存,每一步均有相應措施用以控制白酒中的雜醇油含量,但因香型多樣,曲種不同,目前尚未能建立有效控制白酒中雜醇油含量的體系:工藝優化僅適用于個例,且成本高;選育低產雜醇油的菌株,實際應用的可行性不大且對其他微生物的生長代謝影響不明;改善蒸酒方式不能普遍應用于所有酒廠,酒廠需打造適合的蒸餾裝置導致投資成本較高。因此,采用高通量測序技術、組學分析技術等生物技術以系統了解白酒中微生物的多樣性、解析微生物菌群與雜醇油的關系、挖掘功能微生物可為控制白酒中的雜醇油含量提供新思路。

