宏基因組測序技術在傳統釀造食品微生物群落分析中應用研究進展
高 航,張 欣,趙 燕*,王文平,續丹丹,王 鵬
(1.北京食品科學研究院,北京 100068;2.北京市食品釀造所,北京 100050)
我國傳統釀造食品歷史悠久,種類豐富,以其獨特的魅力廣受歡迎。醬油、醬類、食醋、腐乳、白酒和泡菜等都是最常見的傳統釀造食品,它們是以谷類、豆類或蔬菜等為原料,將自然界的微生物引入發酵過程中共同作用而形成風味獨特、營養價值較高的食品[1]。
傳統釀造技術多采用固態或半固態發酵工藝,在開放或半開放式的環境下,通過微生物群落的盛衰交替和協同作用釀制食品的過程[2-4]。經過漫長的馴化與篩選,不同地區的釀造食品形成了較為穩定的工藝與微生物群落,賦予了釀造食品獨特的風味、滋味和豐富的營養。研究表明,醋酸菌產生以醋酸為主的有機酸,對高脂飲食誘導的肥胖小鼠具有良好的抗肥胖和抗炎活性[5];黃酒釀造過程中以霉菌和酵母菌為主代謝產生的功能性多糖,可以抑制小鼠的淋巴細胞增殖而增強免疫抑制小鼠的免疫活性[6];在研究傳統釀造醬油的生理活性時發現,以1.8 mL/kg的劑量灌胃高尿酸大鼠30 d,其血清尿酸水平及黃嘌呤氧化酶得到了良好的抑制,緩解了高尿酸癥狀[7]。在系統地剖析釀造過程中微生物群落的基礎上,深入挖掘功能基因和微生物間的相互作用關系,能更充分地改善與提升釀造食品的品質和營養[8-9]。近年來,應用不同生物技術研究釀造食品中的微生物群落成為了熱點[10-11],其結果為開發出“色、香、味、營養”俱全的釀造食品奠定理論基礎。
在微生物學研究領域中,99%以上的微生物都是目前未(難)被純培養的,這對于具有高度物種多樣性的傳統釀造食品而言,進一步了解其微生物群落結構和功能具有更大的挑戰[12]。隨著分子生物學技術的快速發展,傳統釀造食品微生物群落結構的研究已不僅僅局限于傳統的可分離培養微生物研究[13]。高通量測序技術的更新、測序成本的降低以及測序通量的擴展等優勢不斷加強,為直接分析群落中全部微生物的種群組成、分布及其動態演替提供了有利的技術支撐[14-15]。宏基因組測序技術不僅提供了更為豐富的微生物物種的基因信息,而且還有效提高了檢測效率和結果準確性,為研究者更全面地解析微生物群落結構、變化規律并挖掘潛在的功能基因提供契機,從而得以進一步開展對傳統釀造食品的深入探索[16]。本文將對宏基因組測序技術在傳統釀造食品微生物群落研究中的應用進展進行綜述,并分析討論其面臨的主要問題和發展趨勢,為釀造食品的科學研究和工業生產提供相關理論基礎。
1 宏基因組測序技術
1.1 宏基因組測序技術概述
1991年,DELONG E F等[17]首次提出環境基因組學(environmental genomics)的概念,在對太平洋浮游生物進行系統分類時,通過直接提取脫氧核糖核酸(deoxyribonucleic acid,DNA)并構建基因文庫,發現了15種全新的細菌序列,這是第一次不依賴于純培養的基因組分析而發現新物種的報道。1998年,HANDELSMAN J等[18]研究土壤微生物群落時首次將“特定環境中全部微小生物遺傳物質的總和”定義為宏基因組(metagenome)。目前,宏基因組的定義又被更正為特定環境中細菌和真菌遺傳物質的總和。宏基因組測序技術正是以高通量測序為依托,通過樣品和基因(組)的富集、提取特定環境中的基因組DNA、構建宏基因組文庫和篩選目的基因等流程來研究微生物的方法,從而達到研究宏基因組的目的[19](見圖1)。
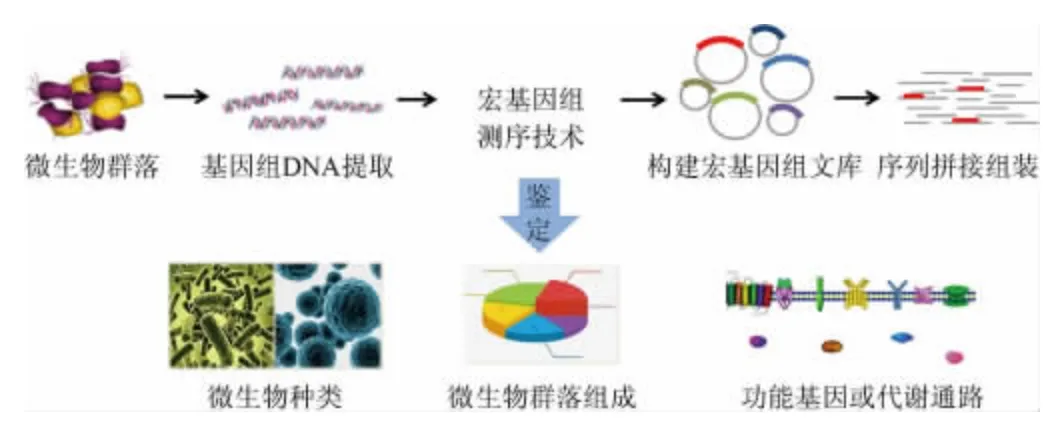
圖1 宏基因組測序技術流程Fig.1 Sequencing process of metagenomics
宏基因組測序技術的結果除了包含群落中各種微生物的分類信息以外,更包含了所有微生物的基因信息。隨著高通量測序成本的逐漸降低,宏基因組測序技術也因而應用在更多領域的微生物研究中,包括對大量不可培養的微生物,以及新的微生物或功能基因的認知,極大地增加了人類對不可培養微生物群落的組成、演替、功能及其互相作用的認識,開辟了微生物與環境或微生物與微生物之間的相互作用關系研究的新方法。
1.2 高通量測序技術在宏基因組測序中的應用
高通量測序技術是現今應用最廣泛的測序技術,其特點是成本低、通量高、速度快,可以快速產生大量的數據[20]。1977年Sanger測序技術誕生并在“人類基因組計劃”中被廣泛使用,被稱為“第一代測序技術”[21]。第一代測序技術具有讀長較長、準確率較高的特點,但其通量較低,分析時間較長等無法滿足大批量的數據分析。第二代測序技術依托的高通量測序平臺,包括Illumina公司的Solexa Genoma Analyzer測序平臺、羅氏公司的454GS FIX測序平臺和ABI公司的SOLiD測序平臺,它們的測序深度可以在一定程度上彌補讀長較短所帶來的問題,深入并且快速的測序過程也使它們得以成為現今應用最廣泛的測序技術[22]。而第三代測序技術是一種集高通量、快速度、讀長更長及低成本等多種優點于一身的新型測序技術,它的出現為宏基因組學的研究注入了新活力[23]。
1.2.1 基于宏基因組測序技術的微生物群落分析
在原核微生物中,與23SrRNA和5SrRNA相比,16SrRNA包含適量且足夠的信息量和序列長度,因此作為研究物種進化關系的“黃金標準”[24]。16S rRNA的微生物群落分析可產生深度的16S rRNA測序數據,并通過比對或聚類的分析方法,將16S rRNA序列聚類成分類操作單元(operational taxonomic unit,OTU),利用OTU的數目、各個OTU的序列數來分析估計物種多樣性和豐度,從而實現對數據來源的微生物物種和微生物群落的物種構成進行分析[25]。在真核微生物中,真菌DNA的堿基組成遺傳穩定,不易受環境影響,而且在其生長的任何階段均可獲得。內部轉錄間隔區(internal transcribed spacer,ITS)在不同菌株間存在豐富的變異,對ITS區進行序列分析豐富了真核生物核糖體基因ITS的序列信息。ITS1和ITS2是中度保守區域,其保守性基本上表現為種內相對一致,種間差異比較明顯,通過對ITS序列進行DNA測序,進而將測序得到的ITS序列與已知真菌ITS序列比較,為真菌分類鑒定等研究提供了十分重要的資料和依據[26]。但是,在鑒定物種方面,16S rRNA和ITS的分類精度是有限的,一般僅能夠精確分類到屬水平,其序列很多注釋不到種水平。其原因是16S rRNA和ITS測序技術能夠區分非常相近的高變區的特異性序列片段有可能不在擴增區域內,即非全長的可變區序列覆蓋范圍不夠導致無法鑒定到種[27]。然而,同一種的不同個體在基因組信息上也會有差異,只分類到屬是遠遠不夠的。
宏基因組測序技術是先將微生物基因組DNA隨機打斷成若干條500 bp的小片段,并在片段兩端加上通用引物進行PCR擴增測序,然后再進行組裝拼接得到基因序列,眾多基因即可構成完整的基因組[28]。因此,在物種鑒定過程中,宏基因組測序技術并不受高突變區的影響,具有明顯的優勢。此外,宏基因組測序得到的微生物群落基因信息,還可進一步開展特定環境中微生物群體基因組成及功能分析、微生物群體的多樣性與豐度演替變化等研究,為深入分析微生物與環境、微生物與宿主之間的關系以及挖掘具有特定功能的基因提供有力的支撐[29]。
宏基因組測序無需分離純培養微生物,直接對樣品中微生物群落的總基因進行測序和分析,可同時鑒定出細菌和真菌,不僅保證了低豐度的微生物可以被檢測出來,而且檢測效率高,結果準確,較大地擴展了微生物資源的利用,為復雜的微生物群落體系研究提供了有效工具[30]。宏基因組深度測序可以揭示或估計環境中真實的物種多樣性和遺傳多樣性,挖掘具有應用價值的基因資源,應用于開發新的微生物活性物質。目前,宏基因組測序技術已經應用在食品微生物[31]、腸道微生物[32]等多領域的微生物群落研究中。
1.2.2 基于宏基因組測序技術的功能基因分析
基于16S rRNA和ITS測序技術只能依賴于基因庫中已知基因序列進行分析,而缺乏具體的功能基因信息。相比之下,宏基因組測序技術在一定程度上彌補了這些缺陷,使得人們可以更系統地研究微生物群落結構及其功能基因,全面分析其組成、變化規律、親緣進化并挖掘出潛力豐富的功能基因,從而得以進一步揭開釀造食品微生物群落的奧秘[33]。
功能基因的篩選無需依賴于已知的基因信息,因此可能得到新的基因和產物;但其受制于外源基因在宿主細胞中的表達,并因檢測手段的局限性和有效性只能在大量分析的基礎上篩選出極少的具有活性的基因。鑒于此,發展高通量、高靈敏度、快速簡便的篩選方法或體系十分必要[34]。高通量測序數據首先映射到微生物基因組和基因的已知數據庫(如美國國家生物技術信息中心(National Center of Biotechnology Information,NCBI)數據庫或京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)數據庫),并獲得每個宏基因組樣本的基因目錄,顯然此種方法需要有足夠的數據庫支撐[35]。針對宏基因組測序技術的數據分析,一般分為基于比對的方法和不基于比對的方法,二者均通過對基因豐度水平的估計實現對基因進行預測或者功能性分析。基于比對的序列比較方法通常先被映射到已知的基因或者生化路徑代謝數據庫中,再對基因或基因家族的豐度水平進行估計,最后結合一些功能基因、代謝通路、信號通路等數據庫,對研究者感興趣的部分進行分析或進行基因預測[36]。不基于比對方法克服了基于比對的方法對有限的參考數據庫的依賴,其通過統計長度為k的元組出現的頻度而計算,在未知物種為主的宏基因組分析中,以長度k分析的優勢非常明顯,是宏基因組的一個重要的研究方向[37]。
2 宏基因組測序技術在傳統釀造食品中的應用
2.1 傳統釀造食品中微生物群落結構的解析
2.1.1 微生物群落組成分析
傳統的釀造食品多在開放式環境中經混菌發酵形成,其中富含復雜多樣的微生物群落結構體系[38]。目前,只有少部分優勢菌種通過純培養技術鑒定出來,而基于16S rRNA克隆建庫[39]、限制性片段長度多態性(restriction fragment length polymorphism,RFLP)[40]、聚合酶鏈式反應-變性梯度凝膠電泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)[41]等無需純培養的分析技術,也只能鑒定出豐度較高或參考數據庫中可供參考的基因信息。更全面地了解不同發酵階段的微生物群落組成,是提高釀造食品品質和發酵效率的必要條件。因此,基于宏基因組測序技術能鑒定出更低豐度的微生物群落及精準鑒定到種級別的優勢上,廣泛地應用在更全面和更微小的微生物群落體系研究中。
在印度米酒酒曲(Xaj-pitha)的研究中,BORA S S等[42]首次應用宏基因組測序技術揭示了更為全面的微生物群落特征,其中鑒定出的微生物包括以乳酸菌為主的細菌、根霉、毛霉和曲霉等產淀粉酶菌株;以季也蒙畢赤酵母(Meyerozyma guilliermondii),威克漢姆西弗酵母(Wickerhamomyces ciferrii)和釀酒酵母(Saccharomyces cerevisiae)為主的產乙醇菌株等。但對于所獲得的宏基因組數據,作者僅報道了分類學結果,并沒有進一步分析功能基因組和代謝途徑。NIE Z等[43]應用宏基因組測序技術在傳統食醋中首次發現了相對豐度不到0.1%的念珠藻屬(Nostoc),類諾卡氏菌屬(Nocardioides),丙酸菌屬(Propionibacterium),克雷伯氏菌屬(Klebsiella)和片球菌屬(Pediococcus)。在工業生產中,念珠藻屬可產生200多種次生代謝物,被用于蛋白質、維生素和多不飽和脂肪酸的生物來源[44];而丙酸菌屬的發酵也可大量生產維生素B12[45]。此類菌種雖然豐度較低,但是功能卻不可忽視,尤其通過其在工業生產中的作用可推測在食醋的生產發酵中可能具有類似作用。對比前人通過培養方式,僅能分離鑒定出食醋在發酵過程中的醋酸菌(主要包括醋桿菌屬、葡萄糖桿菌屬和葡萄糖醋酸桿菌屬)、乳酸菌(主要包括乳桿菌屬和乳球菌屬)和芽孢桿菌屬[46],而宏基因組測序技術大大提高了微生物菌種的覆蓋率。類似地,孫煒寧等[47]利用宏基因組測序技術對東北酸菜進行了深入研究,應用宏基因組測序技術首次在東北酸菜中鑒定出屬于腸桿菌的果膠桿菌(Pectobacterium)和拉恩氏菌(Rahnella)。在食品安全方面,腸桿菌可能導致食品污染,甚至可能引發的食源性疾病。酸菜中腸桿菌的存在主要與酸菜直接使用未清洗的白菜作為腌制材料以及低鹽濃度(0.5%~1.0%)的發酵液有密切的關系。因此,在酸菜發酵中檢測和控制發酵體系中腸桿菌科細菌的豐度和動態變化情況有助于積極控制和消除發酵蔬菜中亞硝酸鹽和生物胺帶來的危害。唐婧等[48]分別提取2011-2013年的茅臺酒酒曲微生物總基因組DNA,基于宏基因組測序技術對茅臺酒酒曲細菌群落多樣性進行了研究。結果表明,茅臺酒酒曲微生物群落構成穩定,主要分布于γ-變形菌綱(50%以上)和芽孢桿菌綱(30%以上),分屬于魏斯氏菌、片球菌、明串球菌、糖多孢菌、歐文氏菌、真絲菌、短狀桿菌、鞘氨醇桿菌、醋酸桿菌、糖單孢菌、鹽單胞菌和德庫菌。因此,宏基因組測序技術的應用在保證茅臺酒的微生物群落穩定方面提供了一定的技術支撐。
2.1.2 微生物菌群動態演替分析
宏基因組測序技術不僅可以快速準確地解析微生物群落的結構,并且可以同步確定各種微生物的相對豐度變化水平[49]。釀造食品通過微生物菌群的代謝生成各類物質,賦予釀造食品不同的風味和營養功能[50]。在釀造過程中,菌群結構的動態演替直接影響代謝產物的形成,微生態調控被視為改善傳統釀造食品風味和營養物質的關鍵與核心技術[51]。聶志強等[52]應用宏基因組測序技術對天津獨流老醋醋酸發酵過程中的群落變化研究中發現,在醋酸發酵過程中,醋醅中一些相對豐度較低的細菌(相對豐度均在0.01%以上)也發生著較大的變化。其中,類諾卡氏菌屬(Nocardioides)的相對豐度呈上升的趨勢,在末期相對豐度達到0.06%,說明其具有較強的醋酸耐受性。假單胞菌屬(Pseudomonas)隨著醋酸發酵的進行相對豐度從0.14%下降到0.04%后逐漸消失,說明醋酸對假單胞菌屬菌的影響較大。另外,埃希氏桿菌屬在發酵前期到中期呈增加的趨勢,而克雷伯氏菌屬卻僅出現在發酵末期,說明克雷伯氏菌有一定醋酸耐受性。在整個發酵周期中,相對豐度>0.01%的細菌達到10種,說明食醋固態釀造過程中來源于樣品和環境中的多種微生物能夠自發地繁殖、富集,這也導致了傳統食醋豐富的風味。
在研究傳統釀造醬油的微生物群落過程中,WEI C L等[53]采用PCR-DGGE法研究發現,在醬油的整個發酵過程中,以四種葡萄球菌屬(Staphylococcus)和四種桿菌屬(Bacillus)為優勢菌,庫特氏菌(Kurthia)和克雷伯氏(Klebsiella)在制曲階段出現,在糖化階段逐漸消失。WANG H等[54]基于宏基因組學技術,比較了醬油發酵中制曲和糖化階段的細菌群落變化。制曲階段共鑒定出29屬細菌,后期7個屬消失;糖化階段鑒定出34屬細菌,后期又出現了12個新的細菌屬。制曲和糖化階段的優勢菌種分別為庫特氏菌(Kurthia)、魏斯氏菌屬(Weissella)、葡萄球菌(Staphylococcus)和葡萄球菌(Staphylococcus)、庫特氏菌(Kurthia)、腸球菌(Enterococcus)、明串珠菌(Leuconostoc)。在制曲和糖化階段,含量僅有0.21%的四體球菌屬(Tetragenococcus)也同樣被鑒定出來。通過比較,DGGE法與宏基因組測序法得到的結果在微生物豐度方面相似。顯然,宏基因組測序法比其他研究方法獲得了更高的物種覆蓋率,從而全面闡明釀造過程中微生物群落的動態變化。
宏基因組測序技術的另一大優勢即為可同時鑒定出真菌和細菌的群落變化,這一特點大大提高了檢測效率,同時也減少了因方法選擇的局限性帶來某部分微生物物種信息的缺失。因此,宏基因組學技術的應用受到越來越多研究者的青睞。XU D D等[55]在研究腐乳發酵過程中真菌和細菌群落的動態變化時發現,腐乳發酵前期以毛孢菌屬、放線菌屬和隱球菌屬為主,發酵后期以紅曲霉屬和曲霉屬為主。此外,在加入混合料后首次檢測到芽孢桿菌,但在發酵結束時,芽孢桿菌數量急劇下降至極低水平(0.07%)。因此,發酵過程中各個階段微生物動態變化的研究結果可進一步實現對腐乳安全性和質量的評價。
2.2 傳統釀造食品中功能微生物或功能基因的鑒定
中國傳統釀造食品中微生物物種的高度多樣性使得進一步分析微生物群落的代謝功能成為一個更大的挑戰。功能微生物和功能基因的鑒定有助于更清晰地在眾多微生物菌群中錨定對產品品質或功能起到重要作用的微生物群落或基因,以便能更準確地進行分析研究[56]。WU L等[57]采用宏基因組測序技術對香醋的微生物群落結構和功能微生物進行了研究,進而了解與食醋風味相關的微生物菌群。結果顯示,食醋中細菌、真核生物和古細菌的相對豐度分別為91.75%、0.19%和8.06%。此外,共有來自951屬細菌的蛋白編碼基因被鑒定出來,其中42.3%與代謝通路相關,28.3%與遺傳信息相關,還有10.1%與環境信息相關。食醋的風味研究結果表明,乙偶姻是在醋酸發酵過程中提高香醋風味的重要物質,其合成受到多種代謝途徑的調控[58]。然而,在以往的研究中,探索產生乙偶姻的具體微生物并未被清晰的識別出來,而宏基因組測序技術的應用可在已知的乙偶姻代謝途徑中瞄定功能微生物進行深入研究。LU Z M等[59]通過宏基因組測序技術,在物種水平上揭示了乙偶姻代謝途徑中微生物的分布差異。乙偶姻代謝途徑主要是在乙酰乳酸合酶和乙酰乳酸脫羧酶共同調控下完成。結果顯示,乙酰乳酸合酶主要由布氏乳桿菌(L.buchneri)(21.0%)和巴氏桿菌(A.pasteurianus)(29.3%)產生;而布氏乳桿菌(L.buchneri)(26.5%)、羅伊氏乳桿菌(Lactobacillus reuteri)(11.6%)、巴氏桿菌(A.pasteurianus)(5.6%)、發酵乳桿菌(L.fermentum)(3.2%)和短乳桿菌(L.brevis)(2.8%)參與了乙酰乳酸脫羧酶的合成代謝。雙乙酰是合成乙偶姻主要的前體物質,巴氏醋桿菌(Acetobacter pasteurianus)和四種乳酸菌,包括布氏乳桿菌(Lactobacillus buchneri)、羅伊氏乳桿菌(Lactobacillus reuteri)、發酵乳桿菌(Lactobacillus fermentum)和短乳桿菌(Lactobacillus brevis)是醋酸發酵過程中促使雙乙酰向乙偶姻轉化的功能微生物菌種。GUO M等[60]在研究中國傳統釀造白酒時發現,真核生物占整個微生物群落的比例很小[(6.0±1.4)%]。但它們對白酒發酵過程中代謝產生乙醇有重要作用,半乳酵母菌能產生高活性的纖維素酶,以有效地進行酶的糖化。乳桿菌(Lactobacillus)、互養單胞菌(Syntrophomonas)、甲烷囊菌(Methanoculleus)、甲烷桿菌屬(Methanobacterium)、芽孢桿菌(Bacillus)、梭狀桿菌(Clostridium)、耐堿酵母屬(Galactomyces)、念珠菌(Candida)、畢赤酵母(Pichia)、青霉菌(Penicillium)和曲霉菌(Aspergillus)是白酒中的活性微生物群落,這些微生物也與白酒中主要的風味成分形成(己酸乙酯、乳酸乙酯、乙酸乙酯等)所一致。此類微生物與乳酸、乙醇、丁酸、乳酸乙酯、短鏈脂肪酸、乙酯的生成有直接關系。從某種意義上說,白酒的風味化合物微生物群落結構密切相關。PARK J M等[61]研究泡菜29 d發酵過程的宏基因組,揭示了一系列碳水化合物異養乳酸發酵的相關基因,這與檢測到發酵產物甘露醇、乳酸、乙酸乙酯、乙醇等相吻合。將宏基因組序列與不同菌屬微生物基因組序列比較發現,大部分的宏基因組測序序列與腸膜明串珠菌(Leuconostoc mesenteroides)和沙克乳酸桿菌(Lactobacillus sakei)的基因序列具有高度相似性,表明泡菜發酵過程中這兩種菌很可能發揮了重要作用。
2.3 傳統釀造食品中微生物與環境的相互作用關系
中國傳統發酵食品開放程度高、微生物構成復雜,發酵過程并非單個微生物的疊加,還存在復雜的交互作用機制,包括細胞與細胞之間的物理接觸、代謝物交換、水平基因轉移等方式,這些多種多樣的作用方式最終形成了微生物之間的共生、競爭、偏利共生及偏害共生等交互作用關系,進而影響了群落整體的組成結構以及功能[62]。除微生物群落內部的互作以外,微生物與環境之間也有復雜的交互作用關系。隨著發酵過程的推進,釀造微生態環境也不斷改變,進而又作用于微生物群落,影響著群落的結構和功能,并最終影響產品品質[63]。因此,系統理解傳統釀造食品的發酵進程,需要明晰微生物與環境之間的相互作用關系,才能有效建立調控群落功能的策略。
在中國傳統的白酒釀造過程中,來自于原材料、大曲及窖泥等環境中的各種微生物已逐漸形成了穩定的微生物群落結構,從而對白酒品質和風味產生重要的影響。GUO M等[60]應用宏基因組測序技術研究了來自瀘州、綿陽和成都三地的白酒品質與環境的相互作用規律。結果顯示,在釀造過程中,酒的品質特征與產地微生物群落高度相關。不同的地理環境促使窖泥累積了不同微生物群落,進一步影響了白酒品質和風味。瀘州、綿陽和成都三地的窖泥中含有共同菌種133屬,而瀘州地區的窖泥還檢測出了188個特異屬,綿陽和成都地區僅有29和13屬特異菌,這些菌屬發酵產生不同強度的己酸乙酯、乳酸乙酯、乙酸乙酯等,賦予了終產品不同的特征風味。在對三種白酒的揮發性成分分析時表明,不同產地的白酒表現出明顯的感官特征區別,瀘州地區的豐富微生物群落促使了優質白酒的生產。因此,深入研究不同產地的產品中微生物群落差異,有助于明確地域因素對釀造食品品質的影響。
3 展望
近年來,宏基因組測序技術在分析傳統釀造食品的微生物群落組成、微生物群落的動態演替、功能基因或功能微生物以及微生物與環境的相互作用關系中取得了一些進展,為釀造食品的深入研究或工業生產都起到了一定的積極作用。然而,宏基因組測序技術的應用依舊存在著一些不可避免的局限性,如宏基因組測序數據量較大,分析有一定的難度;測序分析費用較高,大大增加了樣品重復性試驗的成本。隨著測序技術的不斷發展,三代測序技術如PacBio RS很好地彌補了第一、二代測序技術的不足,為宏基因組測序技術更準確、更便捷的應用提供了更有力的技術支撐。
宏基因組測序技術在研究微生物多樣性或明確功能基因方面都有無可代替的作用,但是在微生物的巨大體系中,信使核糖核酸(messenger ribonucleic acid,mRNA)、核糖體核糖核酸(ribosome ribonucleic acid,rRNA)、轉運核糖核酸(transfer ribonucleic acid,tRNA)、非編碼核糖核酸(noncoding ribonucleic acid,ncRNA)以及蛋白質均是行使細胞功能的重要承擔者。因此,在獲取微生物基因信息的基礎上,進一步明確微生物的mRNA和蛋白質表達,才能準確描述微生物的功能和狀態。宏基因組學與宏轉錄組學、代謝組學與蛋白質組學等多組學技術的聯用將有助于更清晰地了解傳統釀造食品中微生物的群落結構演替、相互作用、功能菌株對食品品質和風味的貢獻,并挖掘出新的功能基因。未來,生物信息學、分子生物學等多學科理論知識的豐富以及更新一代測序技術、更加完善的基因數據庫、先進的數據分析工具的應用以及多種組學方法的結合將給釀造食品微生物的研究帶來新的曙光。

