基于蔗糖利用能力對豆乳發酵菌株的篩選及其應用
趙羽,陸林,劉小鳴,崔樹茂,唐鑫,陳衛,趙建新
(江南大學 食品學院,江蘇 無錫,214122)
大豆豆乳是一種營養豐富的植物蛋白飲品,含有豐富的大豆蛋白和游離氨基酸[1],但是由于具有豆腥味,并且豆乳中的大豆低聚糖可被腸道菌群利用產氣進而引起腹脹[2-3],所以豆乳飲品的接受度仍有待提高。
已有研究探討了如何利用乳酸菌對大豆豆乳中的非結構性碳水化合物(包括蔗糖、棉子糖和水蘇糖)進行發酵,改善豆乳的不良風味[4-5]。乳酸菌發酵大豆豆乳可生成乳酸、乙酸[6]等有機酸類物質,以及醛酮類[7]揮發性風味物質,促使發酵豆乳產品形成細膩的凝乳質地[8],并賦予其特殊奶香味、果香味等發酵香味[9-10],也可降低豆腥味的主要呈味物質己醛的含量[11-12]。目前已有從保加利亞乳桿菌、嗜熱鏈球菌、干酪乳桿菌、植物乳桿菌及發酵乳桿菌等常見酸奶發酵菌株中[13-15]篩選大豆豆乳發酵菌株的報道,SINGH等[16]測定了植物乳桿菌、鼠李糖乳桿菌及瑞士乳桿菌在大豆豆乳發酵過程中蔗糖、棉子糖及水蘇糖的消耗情況,發現實驗菌株在豆乳發酵過程中優先利用蔗糖。
本課題組對實驗室保藏的5株嗜熱鏈球菌和7株乳酸乳球菌的蔗糖利用差異性進行探究,并測定菌株在豆乳發酵過程中的生長、產酸及蔗糖的消耗情況,結合發酵終點豆乳樣品的揮發性風味物質檢測,為更有效地篩選豆乳發酵菌株并進行良好應用提供參考。
1 材料與方法
1.1 材料與試劑
1.1.1 實驗試劑
胰蛋白胨、牛肉膏、葡萄糖、乙酸鈉、酵母浸粉、MgSO4·7H2O、MnSO4·H2O、檸檬酸氫二銨、K2HPO4·3H2O、吐溫-80、瓊脂粉、NaCl、亞鐵氰化鉀、乙酸鋅、溴甲酚紫、果糖、蔗糖、棉子糖、半乳糖,均為分析純,國藥集團化學試劑有限公司。大豆,產地東北,市售。
1.1.2 實驗菌株
實驗所使用的5株嗜熱鏈球菌和7株乳酸乳球菌均由本實驗室提供。菌株信息如表1所示。
1.2 儀器與設備
UV-1800紫外可見分光光度計,島津儀器(蘇州)有限公司;ST3100型pH計,奧豪斯儀器(常州)有限公司;Thermo Trace 1310型氣相色譜-質譜聯用儀,Thermo Fisher SCIENTIFIC;HWS-150型恒溫恒濕培養箱,上海森信實驗儀器有限公司;SW-CJ-1FD型超凈工作臺,蘇州安泰空氣技術有限公司;AW500SG型厭氧工作站,英國依萊泰科公司;5424 R型冷凍離心機,艾本德儀器有限公司;Waters1525液相色譜儀,美國Waters公司;MF-09多功能料理機,QG集團(英國)有限公司。

表1 實驗菌株信息Table 1 Information of strains used in this study
1.3 實驗方法
1.3.1 培養基配制
MRS培養基配方參照WU等[17]的配方,蔗糖-MRS等改良培養基(sucrose-MRS broth)在MRS培養基配方的基礎上,用蔗糖、棉子糖、果糖和半乳糖等量代替MRS培養基中的葡萄糖。無糖-MRS培養基的配方在MRS培養基基礎上不添加葡萄糖。所有培養基在配制后需進行115 ℃高壓滅菌20 min后待用。
1.3.2 菌株糖利用能力測定
取1.0 mL活化后的菌液于1.5 mL離心管中6 000 r/min離心3 min,棄去上清液,再加入1.0 mL PBS緩沖液洗滌2次,制成菌懸液。吸取200 μL添加溴甲酚紫指示劑的蔗糖-MRS、棉子糖-MRS、果糖-MRS及半乳糖-MRS液體培養基加入96孔板中,吸取2 μL菌懸液加入培養基中,30或37 ℃培養24 h,觀察孔板中培養基顏色變化情況(其中乳酸乳球菌在30 ℃下培養,嗜熱鏈球菌在37 ℃下培養,下文中皆分別采用此溫度進行培養)。
1.3.3 菌株在蔗糖-MRS培養基中生長特性的測定
將活化3代后的菌液按照5×106CFU/mL添加量接種到蔗糖-MRS培養基中,分別置于培養箱中恒溫培養,每隔3 h取樣,培養至15 h,測定樣品的活菌數、OD600值及產酸情況。其中,根據前期實驗確定菌株在MRS培養基中OD600值及活菌數的對應關系,取活化3代后的菌液測定OD600值,根據目的接種濃度計算得出菌液所需添加量。
1.3.4 大豆豆乳的制備
稱取干大豆,每份100 g,分別加入1 L去離子水過夜浸泡。取浸泡后的大豆在沸水中熱燙2 min,加入600 mL去離子水,60 ℃研磨6 min后煮沸5 min,稍冷卻后用120目紗布過濾,并分裝至藍蓋瓶中,105 ℃滅菌10 min,冷卻至室溫后放入4 ℃冰箱保存待用。
1.3.5 菌株在大豆豆乳中生長特性的測定
將活化3代后的菌液按照5×106CFU/g添加量接種至大豆豆乳中,并置于30或37 ℃恒溫發酵培養,每隔3 h取樣,測定活菌數及產酸情況,直至豆乳凝乳(pH低于4.7)或發酵至15 h。每個取樣點留取適量樣品放置于-20 ℃冰箱保存。
1.3.6 豆乳中蔗糖含量的測定
參考HATI等[18]的方法并進行部分改良。稱取2 g豆乳樣品,加入1.5 mL超純水稀釋后于60 ℃孵育10 min,依次加入0.25 mL 0.5 mol/L亞鐵氰化鉀溶液,0.25 mL 0.5 mol/L乙酸鋅溶液以及1.0 mL乙腈溶液,緩慢混合后在室溫下靜置4 h,以9 000 r/min轉速離心8 min,取上清液經0.22 μm有機濾膜過濾,將過濾好的上清液在40 W功率下超聲5 min,排除溶解的氣泡,每個樣品設2個平行。利用HPLC對糖消耗情況進行分析,色譜柱為Waters NH2,4.6 mm×250 mm,流動相為V(乙腈)∶V(水)=70∶30,柱溫30 ℃,進樣體積20 μL,流速為1 mL/min。
1.3.7 發酵豆乳揮發性風味物質測定
參考LI等[19]的方法并通過預實驗改良。稱取5 g發酵豆乳樣品至20 mL萃取瓶中,依次加入1.0 g NaCl和2 μL 0.1 mg/mL的2-甲基-3-庚酮(內標)。采用固相微萃取方法提取發酵豆乳中的風味成分,萃取探頭是涂抹厚度為85 μm的 CAR/PDMS,在50 ℃條件下萃取30 min,解吸5 min,進行GC-MS分析。色譜條件:色譜柱WAX;升溫程序35 ℃保持3min,以6 ℃/min升至210 ℃,保持10 min;載氣流速(He)1.5 mL/min,進樣口溫度240 ℃,分流比為10∶1。質譜條件:電子轟擊離子源,電子能量70 eV;離子源溫度240 ℃,質譜范圍m/z33~350 amu。
1.3.8 統計分析及數據處理
本文中所有圖形均采用Origin Pro8軟件繪制;采用Xcalibur及TraceFinder軟件對豆乳中揮發性風味物質進行鑒定及定量(鑒定依據:在Fiehn.HP,MAINLIB,NISTDEMO及REPLIB質譜庫中匹配因子>800,文庫命中數>3,確認峰>3);采用 SPSS 22.0 統計分析軟件進行數據處理和統計分析,數據間的比較采用Duncan模型進行顯著性分析,顯著性水平P<0.05。
2 結果與討論
2.1 菌株對大豆豆乳碳水化合物利用能力的評價
實驗菌株對大豆豆乳中2種主要碳水化合物(蔗糖和棉子糖)及2種代謝產生的碳水化合物(果糖和半乳糖)利用實驗結果如表2所示。結果顯示,嗜熱鏈球菌與乳酸乳球菌均不利用棉子糖,對其余3種碳水化合物利用能力具有顯著差異性。5株嗜熱鏈球菌均不利用果糖,而7株乳酸乳球菌果糖利用能力較好,反應8 h內溴甲酚紫完全變色。5株嗜熱鏈球菌中僅有15G-5、DYNDL7-5及DYNDL13-4三株菌株具有微弱半乳糖利用能力,24 h后溴甲酚紫微弱變色,7株乳酸乳球菌均可利用半乳糖,其中DYNDL21-2、DYNDL1-2、HeNa-28-3-GMM和DYNDL66M43四株菌株可快速利用半乳糖產酸,于8 h內使溴甲酚紫完全變色。

表2 實驗菌株對大豆豆乳中碳水化合物的利用情況Table 2 The utilization of carbohydrate in soymilk byexperimental strains
注:“++”,生長8 h即變色,“+”,生長24 h變色,“+-”,生長24 h微變色,“-”,生長24 h不變色;溴甲酚紫變色范圍為5.2(黃色)~6.8(紫色)
實驗菌株在蔗糖的利用能力間具有顯著差異,除嗜熱鏈球菌DQHXN7M2外,其余4株嗜熱鏈球菌均可利用蔗糖,其中菌株A6蔗糖利用能力相對較差,于生長24 h后使溴甲酚紫變色。7株乳酸乳球菌實驗菌株均具有蔗糖利用能力,其中菌株DQHXN-NM38-14和DQHXNQ05M30蔗糖代謝較慢,其余5株實驗菌株均可在8 h內使溴甲酚紫變色。
綜上所述,由于蔗糖為大豆豆乳中含量最高的非結構性碳水化合物,且2種實驗菌株均具有良好蔗糖利用能力,因此根據上述實驗結果,選擇3株嗜熱鏈球菌(15G-5、DYNDL7-5和DQHXN7M2)及4株乳酸乳球菌(ZN8、DYNDL21-2、HeNa-28-3-GMM和DQHXNQ05M30)在蔗糖-MRS培養基中進行以蔗糖為單一碳源的生長、產酸測定。
2.2 菌株在蔗糖-MRS中的生長特性評價
實驗菌株在蔗糖-MRS中生長、產酸實驗結果分別如圖1和圖2所示,菌株在蔗糖-MRS中的生長、產酸能力具有顯著差異性,其中乳酸乳球菌蔗糖利用能力顯著優于嗜熱鏈球菌。
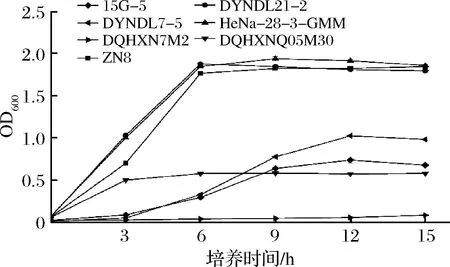
圖1 菌株在蔗糖-MRS培養基中的生長情況Fig.1 Growth of different strains in sucrose-MRS broth
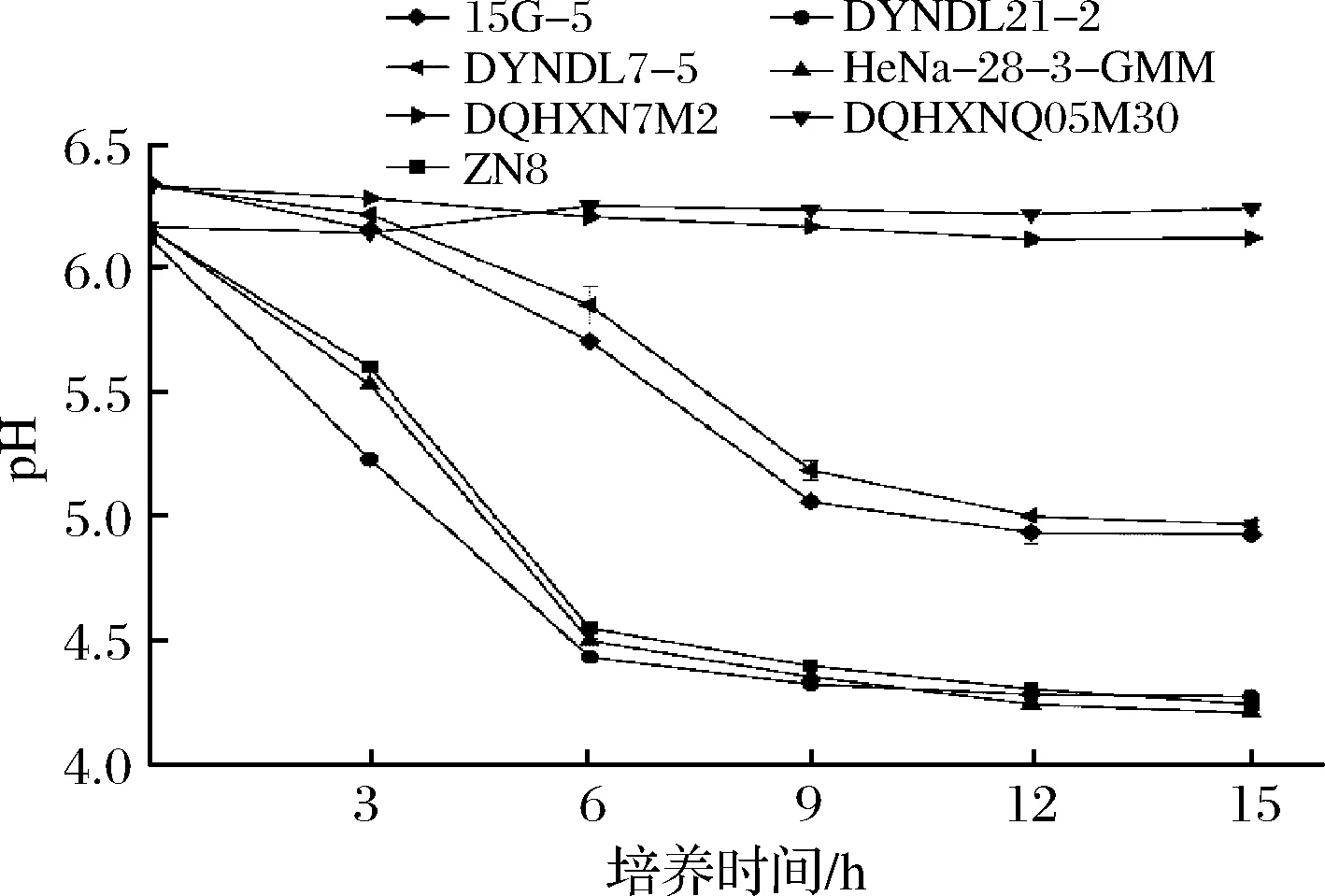
圖2 菌株在蔗糖-MRS培養基中的pH變化情況Fig.2 Changes pH of different strains in sucrose-MRS broth
4株乳酸乳球菌中,ZN8、DYNDL21-2和HeNa-28-3-GMM三株菌株在蔗糖-MRS培養基中生長良好(見圖1),無明顯延滯期,3 h內已進入對數生長期,6 h后進入穩定期,同時OD600值可達到1.8左右;菌株DQHXNQ05M30蔗糖利用能力較差,僅在3h內有微弱生長,OD600值僅達到0.579,且后期再無增長。菌株在蔗糖-MRS培養基中的產酸情況(圖2)與生長結果相對應,ZN8、DYNDL21-2和HeNa-28-3-GMM三菌株的pH值在接種3 h內就已經開始快速下降,并于6 h后趨于穩定,最終穩定期pH達到4.3以下。蔗糖利用能力較差菌株DQHXNQ05M30在生長期內pH無明顯下降。
3株嗜熱鏈球菌中,15G-5和DYNDL7-5在蔗糖-MRS培養基的生長相較乳酸乳球菌較為緩慢,于生長3 h后進入對數生長期,12 h后進入穩定期,OD600值分別為0.676與0.982。菌株在蔗糖-MRS培養基中的產酸情況也與生長趨勢基本符合,3~9 h內pH快速下降,于12 h后進入穩定期pH值到達5.0以下。而菌株DQHXN7M2的蔗糖利用能力較差,生長與產酸數值隨時間均無顯著變化。
相較于嗜熱鏈球菌實驗菌株,乳酸乳球菌實驗菌株在以蔗糖為唯一碳源下生長延滯期更短,對數生長期內的生長及產酸速率較快且終點pH較低,具有更強的蔗糖利用能力。根據菌株在蔗糖-MRS中的生長情況,分別選取3株乳酸乳球菌(DYNDL21-2、HeNa-28-3-GMM和DQHXNQ05M30)與2株嗜熱鏈球菌(15G-5和DQHXN7M2)進行大豆豆乳發酵實驗,進一步探究實驗菌株發酵大豆豆乳的能力。
2.3 菌株在大豆豆乳中的發酵情況評價
實驗菌株發酵豆乳凝乳情況如表3所示。乳酸乳球菌DYNDL21-2發酵6 h后凝乳,嗜熱鏈球菌15G-5及乳酸乳球菌HeNa-28-3-GMM發酵6 h后微凝,發酵9 h后凝乳。蔗糖利用能力較差菌株DQHXNQ05M30和DQHXN7M2發酵12 h后仍未凝乳。

表3 菌株在大豆豆乳中的凝乳情況Table 3 Curding time of different strains in soymilk
注:“-”表示未凝乳
菌株發酵大豆豆乳過程中的生長情況如圖3所示,不同菌株在大豆豆乳體系中生長情況差異顯著,具有較好蔗糖利用能力的菌株15G-5、DYNDL21-2及HeNa-28-3-GMM在大豆豆乳中表現出較強的生長能力,發酵終點活菌數較初始接種量均增長2個數量級左右。而2株蔗糖利用能力較差菌株DQHXNQ05M30和DQHXN7M2則較初始接種量僅分別增長1.38與0.62個數量級,顯著低于其他3株蔗糖利用能力良好的實驗菌株,推測是由于菌株不良的蔗糖利用能力限制其在大豆豆乳中的生長。
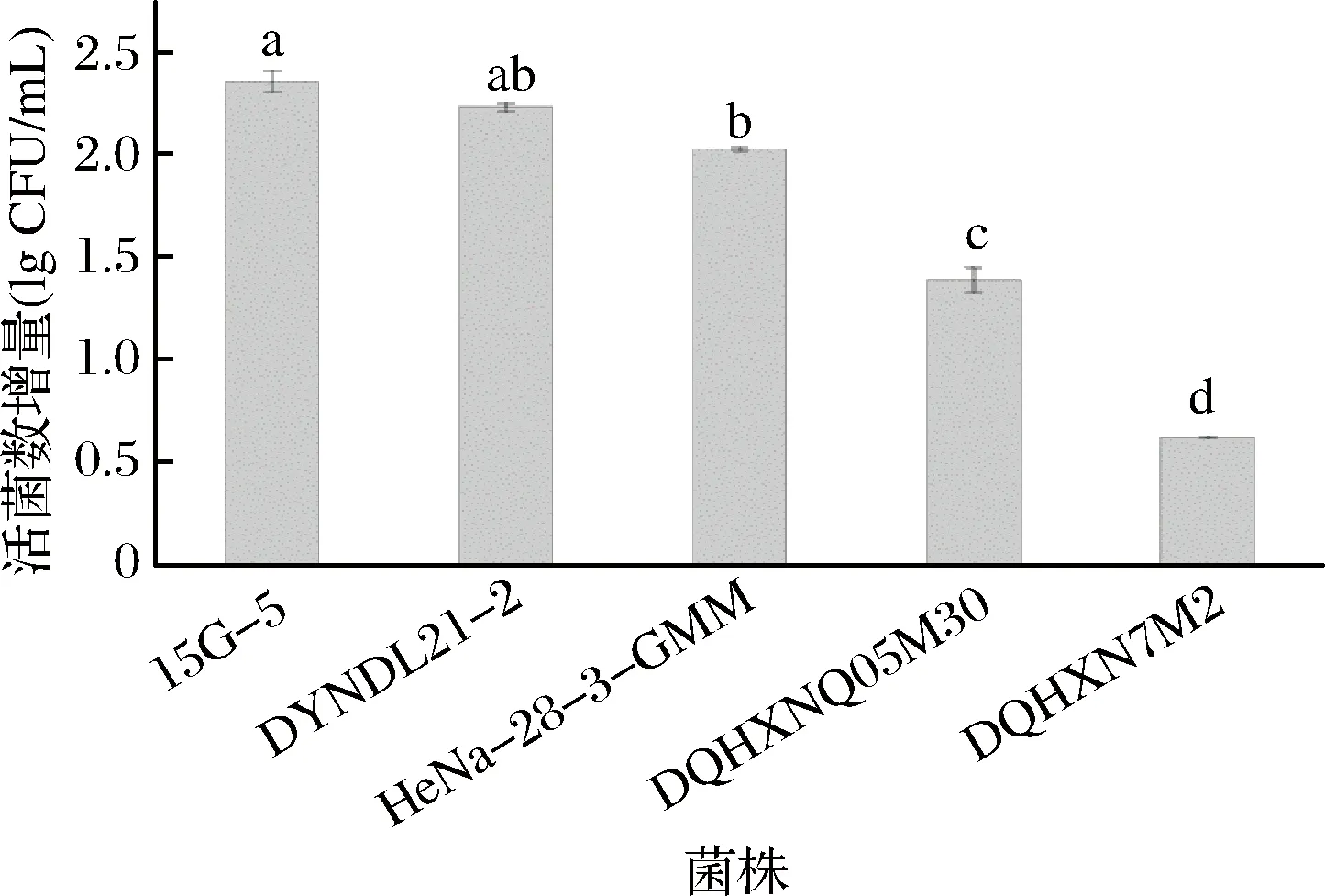
圖3 菌株在大豆豆乳中的生長變化情況Fig.3 Growth of different strains in soymilk注:不同字母標注菌株在大豆豆乳中的生長變化情況存在顯著性差異(P<0.05)
豆乳發酵過程中菌株產酸情況如圖4所示。實驗菌株在大豆豆乳中pH的變化趨勢與在蔗糖-MRS培養基中相似,相較于蔗糖-MRS培養基中的產酸變化情況,嗜熱鏈球菌15G-5在大豆豆乳中發酵3 h內的產酸速率較快,延滯期縮短,這可能是由于大豆豆乳中游離氨基酸含量較高,為嗜熱鏈球菌前期生長提供了更為適宜的營養環境,生長及產酸更為迅速。乳酸乳球菌DYNDL21-2在大豆豆乳中的產酸速率最快,于發酵6 h后到達發酵終點(pH<4.7)完成凝乳。其余1株乳酸乳球菌HeNa-28-3-GMM和1株嗜熱鏈球菌15G-5均在發酵9 h后達到發酵終點并完成凝乳,終點pH分別為4.55和4.59。2株蔗糖利用能力較差菌株在發酵12 h后仍未到達發酵終點,pH均在6.0以上。

圖4 菌株在大豆豆乳中的pH變化情況Fig.4 Changes pH of different strains in soymilk
根據不同實驗菌株在發酵大豆豆乳過程中體系內蔗糖的消耗量(圖5)可以看出,乳酸乳球菌DYNDL21-2在發酵終點時(發酵6 h)消耗掉豆乳體系內1.766 g/L蔗糖,占豆乳中蔗糖含量的65.38%(未發酵大豆豆乳中蔗糖含量為2.701 g/L),顯著高于其余2株實驗菌株。在發酵9 h后,菌株HeNa-28-3-GMM和15G-5達到發酵終點,其蔗糖的消耗量分別達到1.650和1.740 g/L,均消耗掉體系內60%以上的蔗糖。而2株蔗糖利用能力較差菌株則僅消耗掉大豆豆乳體系內35%以下的蔗糖,顯著低于實驗菌株,與產酸情況一致,說明菌株的蔗糖利用能力對其在大豆豆乳中生長及產酸具有顯著影響。
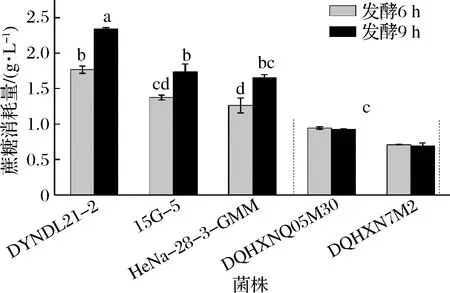
圖5 菌株發酵大豆豆乳過程中蔗糖的消耗量Fig.5 Sucrose consumption in fermented soymilk by different strains注:不同字母表示不同菌株的蔗糖消耗量存在顯著性差異(P<0.05)
實驗中3株實驗菌株均可快速在大豆豆乳中產酸并實現凝乳,與前文中具有良好蔗糖代謝能力的菌株可快速發酵大豆豆乳凝乳的推測相一致,因此判斷蔗糖利用能力可作為評價大豆豆乳發酵菌株的重要指標。
2.4 發酵豆乳揮發性風味物質測定
利用GC-MS對3株實驗菌株發酵終點豆乳樣品的揮發性風味物質進行分析,其結果如圖6所示。根據相關研究可知[8],大豆豆乳中不良風味豆腥味的主要貢獻物質為己醛,乳酸菌發酵可降低豆乳中豆腥味呈味物質的含量。由圖6可以看出,未發酵豆乳中的己醛含量顯著高于發酵后的大豆豆乳,3株實驗菌株發酵終點豆乳樣品中的己醛含量均顯著下降,其中嗜熱鏈球菌15G-5的發酵終點豆乳樣品中己醛含量未檢出。除去降低大豆豆乳中原本存在的不良氣味貢獻物質外,2,3-丁二酮、2,3-戊二酮以及乙偶姻等奶香味的主要貢獻物質[20]經發酵后均有不同程度的產生,其中HeNa-28-3-GMM菌株發酵大豆豆乳終點樣品中的2,3-丁二酮及乙偶姻的含量顯著高于其他菌株,分別達到了198.49和109.93 μg/L,使得發酵后的大豆豆乳具有令人愉悅的奶香味。
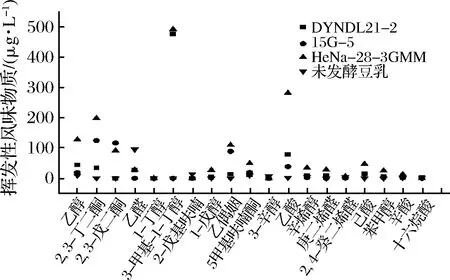
圖6 不同菌株發酵豆乳終點揮發性風味物質含量Fig.6 Volatile flavor content at the end of fermented soymilk by different strains
此外,乳酸乳球菌DYNDL21-2和HeNa-28-3-GMM在發酵后還產生了較多的3-甲基丁醇,分別高達476.05和492.19 μg/L。醇類物質是一種重要的揮發性風味物質,在番茄、蘋果和甜瓜果實等天然食品中,是其主要的風味物質[21]。乳酸菌發酵過程中的亮氨酸代謝與3-甲基丁醇的生成相關,且該物質在發酵乳中的含量與果香味呈正相關[22]。因此,3-甲基丁醇的生成對改善豆乳不良風味具有重要作用。
綜合上述分析可知,實驗菌株發酵后的大豆豆乳在風味方面得到了較大的改善與提高,主要通過菌株發酵降低大豆豆乳中不良風味物質的含量及生成優良風味物質2種途徑。嗜熱鏈球菌15G-5通過發酵顯著降低大豆豆乳中豆腥味的呈味物質己醛及2-戊基呋喃的含量,發酵終點樣品中該物質未檢出,顯著低于未發酵豆乳。乳酸乳球菌HeNa-28-3-GMM通過發酵顯著提高大豆豆乳中2,3-丁二酮及乙偶姻的含量,發酵終點樣品具有奶香味特征。同時,2株乳酸乳球菌實驗菌株經發酵均產生較多3-甲基丁醇,為發酵終點樣品賦予果香味特征。
3 結論
通過對5株嗜熱鏈球菌和7株乳酸乳球菌在大豆豆乳發酵過程中4種主要碳水化合物的利用能力進行測定,確定2種菌株均具有蔗糖代謝能力,具有發酵大豆豆乳的潛力。對初篩得到的7株菌株在蔗糖-MRS中進行生長測定,發現不同菌株之間蔗糖代謝能力存在顯著差異,其中乳酸乳球菌在蔗糖-MRS培養基中生長基本無延滯期,6 h后進入穩定期,而嗜熱鏈球菌蔗糖代謝能力則相對滯后。選擇對蔗糖利用能力優良的菌株進行大豆豆乳發酵,發現蔗糖利用能力強的菌株可在大豆豆乳中快速生長并于6~9 h內產酸凝乳,結合大豆豆乳發酵終點樣品的揮發性風味物質檢測結果,菌株發酵后豆乳中己醛含量顯著下降,并產生以2,3-丁二酮為代表的奶香味物質和以3-甲基丁醇為代表的果香味物質,為發酵后豆乳增加特殊發酵香味,可進一步改良大豆豆乳自身的不良風味。
本文基于乳酸菌蔗糖利用能力對豆乳發酵菌株進行篩選,可高效獲得具有較好發酵特性的豆乳發酵菌株,并賦予發酵豆乳良好風味,對發酵豆乳的生產與應用具有一定價值。但如何進一步代謝大豆豆乳中低聚糖,緩解豆乳飲用后脹氣反應,仍需進一步研究。

