轉移性腎細胞癌組織中β-catenin表達與臨床病理特征及預后的關系
馬靜,王凱靖,柴佳,趙丹琿,范林妮,楊重飛,劉一雄
1中國人民解放軍空軍軍醫大學,西安710032;2中國人民解放軍空軍軍醫大學西京醫院
腎細胞癌是泌尿系統常見的惡性腫瘤。近年來,腎細胞癌的發病率有上升趨勢,其起病隱匿,診斷困難,多數患者就診時已延誤最佳治療時機,而且腎細胞癌對放化療均不敏感,并容易發生轉移,因此預后較差。研究轉移性腎細胞癌(mRCC)惡性進展及預后的相關分子,對早發現、早治療,從而延長患者生存期具有重要價值。研究顯示,連環蛋白表達缺失或減少可能與不同上皮腫瘤的組織學分級及腫瘤發生轉移的風險增加有關[1]。β-連環蛋白(β-catenin)與細胞膜中的E-鈣黏蛋白(E-cadherin)結合,在細胞黏附中起重要作用。新合成的β-catenin通過E-cadherin固定在黏附連接處,并且可以通過在EMT期間下調E-cadherin而釋放到細胞質中。此外,Wnt途徑的激活導致β-catenin磷酸化水平的降低,也有助于β-catenin的胞質內積累。β-catenin作為Wnt通路中的關鍵分子,參與細胞黏附和細胞極性的控制[2],從而介導腫瘤細胞的侵襲轉移。本研究通過檢測β-catenin在mRCC中的表達,分析其與臨床病理特征及預后的關系。
1 資料與方法
1.1 臨床資料 選擇2011年2月~2017年3月在我院行手術切除治療的腎細胞癌患者58例,男49例、女9例,年齡<60歲27例、≥60歲31例。均經術后病理檢查證實為腎細胞癌,其中原發性腎細胞癌(pRCC)23例,未發現腎臟及腎外復發轉移灶;mRCC 35例,包括骨轉移15例、肺轉移12例、腦轉移3例、軟組織轉移4例、膽囊轉移1例;Fuhrman分級1~2級35例、3~4級15例。
1.2 β-catenin蛋白檢測方法 采用免疫組化EnVision兩步法。收集手術切除的腎細胞癌組織,石蠟包埋,4 μm厚連續切片。常規脫蠟至水,加入Tris-EDTA進行抗原修復。加入1% H2O2-甲醇作用20 min以消除內源性過氧化物酶,加入5% BSA孵育20 min以封閉非特異性結合位點。加入1∶150稀釋的β-catenin一抗(兔抗人單克隆抗體,Proteintech,美國),4 ℃孵育過夜;PBS漂洗3次,加入EnVision二抗室溫孵育40 min,PBS清洗3次。DAB顯色,蘇木精復染,脫水封固。以同種非免疫動物血清及PBS代替一抗分別作為陰性對照以及空白對照。陽性染色為表達于細胞質及細胞間隙的棕黃色顆粒。根據文獻[3]對染色結果進行半定量分析。陽性細胞百分比計分:無陽性細胞為0分,陽性細胞占比≤10%為1分,11%~50%為2分,51%~75%為3分,>76%為4分;著色強度計分:無著色為0分,淡棕黃色為1分,棕黃色為2分,棕褐色為3分。兩項分數相乘,<2為陰性,≥2為陽性。
1.3 統計學方法 采用SPSS13.0統計軟件。計數資料以百分數表示,組間比較采用χ2檢驗。采用Kaplan-Meier法繪制生存時間曲線,以Log-Rank檢驗進行比較。采用COX單因素回歸分析β-catenin與患者生存期的關系。P<0.05為差異有統計學意義。
2 結果
2.1 mRCC與pRCC組織中β-catenin表達比較 mRCC組織中β-catenin表達陽性23例,陽性率為65.7%;pRCC組織中β-catenin表達陽性9例,陽性率為39.1%。mRCC組織中β-catenin表達高于pRCC(χ2=3.966,P=0.046)。
2.2 β-catenin蛋白表達與mRCC患者臨床病理特征的關系 不同性別、年齡mRCC患者β-catenin陽性率比較差異無統計學意義(P均>0.05),Fuhrman 1~2級患者β-catenin陽性率高于Fuhrman 3~4級患者(P=0.019),不同轉移部位mRCC患者癌組織中β-catenin表達差異有統計學意義(P=0.034)。見表1。
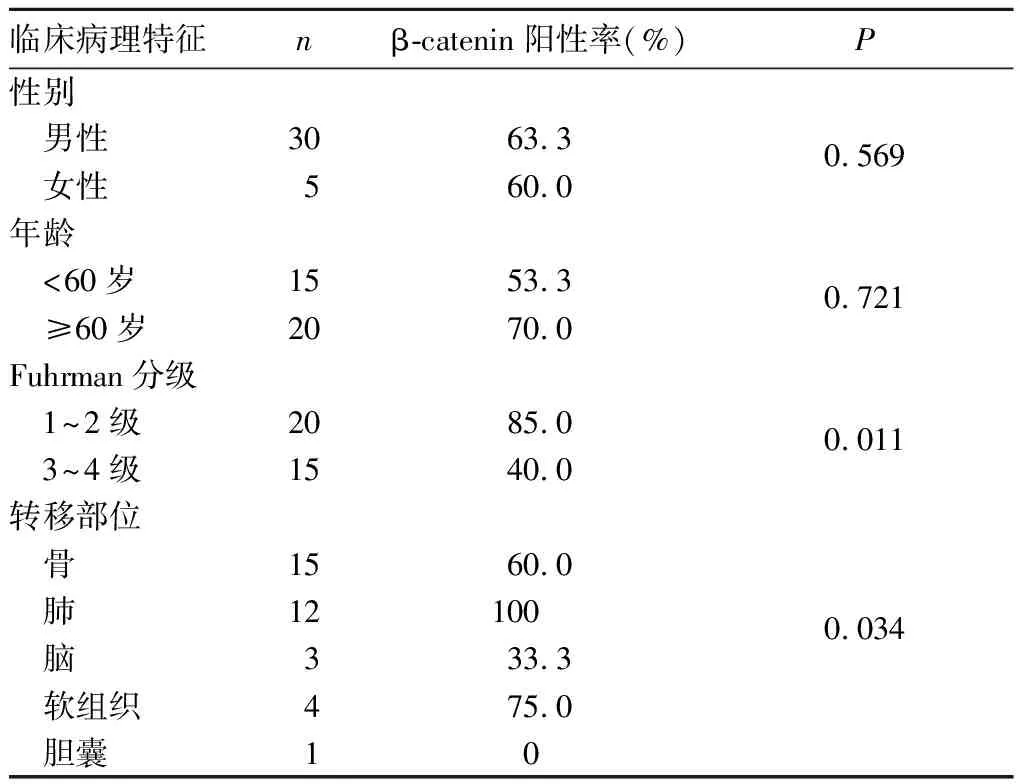
表1 不同臨床病理特征mRCC患者癌組織β-catenin陽性率比較
2.3 β-catenin陽性表達與mRCC患者預后的關系 β-catenin陽性表達患者的5年總生存率為39.1%(9/23),5年無進展生存率為21.7%(5/23),低于β-catenin陰性表達患者的58.3%(7/12)、33.3%(4/12)(P均<0.05)。對獲得隨訪的33例mRCC患者的生存期進行單因素回歸分析,結果顯示,患者生存期與β-catenin表達有關(P=0.042),與年齡、性別、Fuhrman分級和轉移部位無關(P均>0.05)。見表2。

表2 mRCC患者生存期的單因素回歸分析結果
3 討論
腎細胞癌在臨床上診斷困難,對放化療不敏感,患者就診時往往已是終末期階段,需要接受手術切除或者腎移植治療。因此,尋找與腎細胞癌早期診斷、復發轉移相關的指標對腎細胞癌的分子診斷和靶向治療具有重要意義。
Wnt/β-catenin通路在細胞增殖、分化和誘導凋亡中均有一定的作用。文獻報道,在宮頸癌、結直腸癌、肝癌、肺癌、腎細胞癌等多種癌癥中,Wnt信號通路均顯著活化[4~8]。作為其重要的下游效應因子,β-catenin是經典Wnt信號傳導途徑中的關鍵介體,在多種生命活動過程中都發揮關鍵作用。最初發現β-catenin是以一種細胞膜連接復合物的形式,隨后發現,在經典的Wnt信號通路中,β-catenin可以作為關鍵的入核分子,進而調節下一步的轉錄[9]。后來研究發現,在細胞中β-catenin主要以三種形式存在:在細胞膜上作為黏附蛋白的一部分,以及在細胞質和細胞核中表達[10]。同時,β-catenin的結構和信號傳導的改變通常與癌癥及其轉移相關。當與靶細胞相互作用時,在糖原合成酶激酶-3β(GSK-3β)的作用下,β-catenin被磷酸化和泛素化。當Wnt信號傳導處于靜息狀態時,β-catenin形成由軸蛋白、腺瘤性結腸息肉(APC)、酪蛋白激酶和GSK-3β組成的復合物,磷酸化β-catenin。這種磷酸化的β-catenin被β-TrCP泛素化,隨后被蛋白酶體降解[11]。在Wnt配體存在的情況下,包括GSK-3、酪蛋白激酶Iα(CKIα)、Axin和APC蛋白的復合體募集到Wnt受體復合物并失活,從而導致泛素化被抑制,新合成的β-catenin得以積累并入核,與淋巴增強子結合因子和T細胞因子家族成員相互作用[12],促進控制細胞增殖的關鍵Wnt靶基因如c-myc和細胞周期蛋白cyclin D1的轉錄。在很多腫瘤中,激活KRAS和BRAF的基因突變可以激活Wnt通路并增加細胞核中β-catenin的表達。另有研究證明,β-catenin的過度活化和Wnt通路內源性拮抗劑的功能喪失與腎癌的形成和發展有關,其中Wnt信號通路不僅可以通過激活β-catenin誘導轉錄,也可以通過激活mTOR通路誘導細胞的生長[13]。對Wnt/β-catenin信號通路的抑制則可以增加腎癌患者的生存期,為腎細胞癌的靶向治療提供了新的選擇[14]。
研究表明,β-catenin過表達明顯能增加腎細胞癌細胞系的侵襲遷移能力,促進腎細胞癌轉移,當沉默Wnt/β-catenin通路時,腎細胞癌的遷移則被明顯抑制[15]。也有研究表明,β-catenin過表達與腎細胞癌更高的分期與淋巴結轉移密切相關[16],這些都充分說明β-catenin在腎細胞癌的侵襲轉移中具有重要作用。本研究結果顯示,mRCC組織中β-catenin表達高于pRCC,提示β-catenin可能在腎細胞癌轉移中具有一定的作用。不同性別、年齡mRCC患者β-catenin陽性率比較差異無統計學意義,但在Fuhrman 1~2級患者與3~4級患者之間的表達具有統計學意義,且腎細胞癌更傾向于骨轉移。COX單因素回歸分析顯示,mRCC患者的生存期與β-catenin表達有關。提示β-catenin高表達與腎細胞癌的進展、轉移及預后不良有關。
綜上所述,mRCC組織中β-catenin表達水平升高,且與Furhman分級和轉移部位相關,說明β-catenin可能通過促進腎細胞癌轉移導致不良預后,在腫瘤的發生發展、侵襲轉移中起重要作用。

