硅藻硅酸鹽轉運子(silicate transporter, SIT)研究進展
商曉梅 , 孫 軍 , 信業宏 , 張 珊
(1. 天津科技大學 天津市海洋資源與化學重點實驗室, 天津 300457; 2. 天津科技大學 印度洋生態系統研究中心, 天津 300457)
硅藻是一類廣泛分布于海洋、淡水以及濕潤的土壤中的微型藻類, 目前已知種類超過 20 000種,貢獻了約20%的全球初級生產力[1-4]。而硅藻的獨特是可以吸收水中的硅酸鹽形成形態多樣且精致的硅質壁[5-6]。這一特性使其在成為海洋生物硅最大貢獻者的同時形成了巨大的硅質礦藏, 從而造成了主要的海洋碳匯[3-6]。
研究發現硅藻出現在上億年前, 當時海洋中硅酸鹽濃度相較于現在高出一個數量級, 當硅酸鹽濃度大于 30 μM 時, 會以自由擴散方式進入胞內, 低于30 μM時, 需要硅酸鹽轉運子(silicate transporter,SIT)的協助進入細胞[4,6-7]。目前海洋表層海水硅酸鹽濃度普遍低于30 μM, 其中河口、近岸地區較高大洋較低[4], 硅藻需借助硅酸鹽轉運蛋白(silicate transporter, SIT)從周圍的環境中吸收轉運硅酸鹽[6]。硅質壁的形成分為轉運、轉移和沉積三個階段, 首先硅藻通過硅酸鹽轉運蛋白將硅酸鹽吸收轉運到細胞, 在硅藻細胞內硅酸鹽被儲存在非聚合態可溶性硅轉運小泡(silicon transport vesicles, STVS)中, 之后會被運送到硅沉積囊泡(silica deposition vesicle, SDV), 在SDV中合成生物硅參與硅質壁的形成[8-14]。因此, 硅酸鹽轉運機制的闡明是理解硅質壁形成的關鍵, 有助于建立硅藻代謝途徑模型和進一步闡明硅藻在海洋生態系統及生物地球化學循環中作用, 為解決當前的全球氣候變化問題提供研究基礎。
1 硅酸鹽轉運子分子特征
硅元素(Si)存在于所有主要的真核生物類群中,在真核生物中最顯著的作用是形成生物礦化的細胞結構[15-19]。首個轉運硅酸鹽功能的蛋白是在硅藻中被發現的[20]。Hildebrand等(1997)根據細胞對硅吸收的變化從隸屬于硅藻門羽紋綱的海洋硅藻紡錘筒柱藻(Cylindrotheca fusiformis)中分離鑒定硅酸鹽轉運子基因 1(SIT1), 它編碼的蛋白是一種分布于細胞膜上的跨膜功能蛋白, 可以直接與硅酸鹽作用并將其從細胞外轉運到細胞內[20]。后續通過SIT1特異性探針從該藻中分離獲得 4種同源蛋白基因, 分別命名為SIT2、3、4和5, 從而證實硅藻 SITs屬于多拷貝基因家族[21]。
近年來與SITs相關的研究越來越多。目前已在硅藻36屬中發現了超過400條SITs基因序列[20-30]。在目前已完成全基因組測序的9種硅藻中, 有8種硅藻 SITs的cDNA全長基因序列已被發現, 這些硅藻包括紡錘筒柱藻[20-21]、假微型海鏈藻(Thalassiosira pseudonana)[23]、三角褐指藻(Phaeodactylum tricornutum)[24]、中肋骨條藻(Skeletonema costatum)[25]、圓柱擬脆桿藻(Fragilariopsis cylindrus)[7]、多列擬菱形藻(Pseudo-nitzschia multiseries)[7]、谷皮菱形藻(Nitzschi apalea)[25]和丹麥針桿藻(Synedra danica)[30]。其中在紡錘筒柱藻和多列擬菱形藻中發現了5種SITs類型(SIT1、SIT2、SIT3、SIT4和 SIT5), 在圓柱擬脆桿藻中發現了 7種 SITs, 類型(SIT1、SIT2、SIT3、SIT4、SIT5、SIT6和SIT7), 在假微型海鏈藻、三角褐指藻和丹麥針桿藻中發現了3種SITs類型(SIT1、SIT2和SIT3), 在中肋骨條藻(SIT2)和谷皮菱形藻(SIT1)中發現了1種SITs類型。根據硅藻中SITs的cDNA全長序列預測 SIT蛋白結構域, 通過同源性分析顯示,SIT蛋白功能域同源性相對較高, 都存在 10個跨膜片段(transmembrane domains, TMDs)組成的SIT跨膜結構域, 其中存在重復結構EGXQ-GRQ分布在第2與 3跨膜結構之間和第 7與 8跨膜結構之間, 有些C-末端存在卷曲螺旋結構(coiled-coil structure, COILS)和絲氨酸富集區(Serine-enriched regions, SER)(如圖1, 2)[7,31]。通過對紡錘筒柱藻5種SIT蛋白全長比對結果顯示, 它們都包含一個SIT跨膜結構域, 其中跨膜結構域同源性高達90%, 而C-末端存在COILS同源性 50%左右; 通過系統進化樹分析表明 SIT2與SIT4聚為一枝, 與SIT5聚為一大枝, SIT2和SIT4跨膜結構域同源性高達 99%, 而 C-末端結構域同源性為 67%[21]。但不同種硅藻 SITs同源性較低, 例如假微型海鏈藻SITs與中肋骨條藻SITs羧基末端不存在卷曲螺旋結構, 與紡錘筒柱藻 SITs同源性也只有44%左右[25]。

圖1 預測5種硅藻硅酸轉運子2(SIT2)蛋白全長序列比對結果Fig. 1 Prediction of the full-length sequence alignment of five diatom silicate transporter 2 (SIT2) proteins
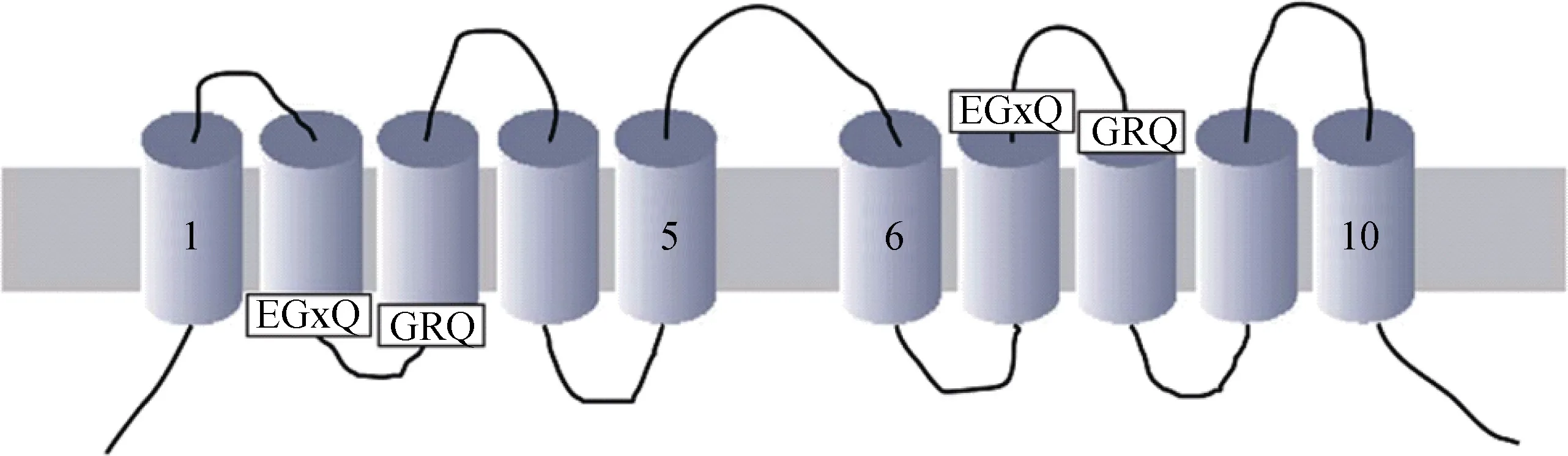
圖2 硅酸鹽轉運子(silicate transporter, SIT)結構示意圖[32]Fig. 2 Schematic of silicate transporter (SIT) structure [32]
早期硅藻 SITs研究較少, 但是通過物種的系統發育分析發現SITs和SIT蛋白的同源性不高。Durkin等根據四個硅藻基因組(假微型海鏈藻、三角褐指藻、圓柱擬脆桿藻、多列擬菱形藻)中SIT 的911個氨基酸(amino acid, AA)(包括間隙AA)同源性分為五個主要分枝, 分別命名為 A、B、C、D和 E, 其他 SITs分類是根據其最保守的114個AA系統進化關系遠近鑒定[33]。通過分析發現 A和 D分枝 SITs具有一個SIT跨膜結構域, C-末端存在COILS結構, 但不存在絲氨酸富集區, 例如紡錘筒柱藻5種SITs屬于A分枝, 圓柱擬脆桿藻SIT7屬于D分枝; C和E分枝只包括一個 SIT跨膜結構域, 例如假微型海鏈藻三種SITs屬于E分枝, 三角褐指藻SIT1和SIT2屬于C分枝; B分枝功能結構域具有較多的變化特征, 只存在一個SIT跨膜結構域或多個SIT跨膜結構域, 有的在N-端和跨膜結構之間含有富含絲氨酸區域[7,33], 大部分硅藻SITs都屬于B分枝[7]。B分枝被認為是較早進化而來且在海洋硅酸鹽濃度很高時就已經出現,而且在如今較低的硅酸鹽濃度環境下依然發揮著重要的作用[34]。
2 硅酸鹽轉運子分子功能機制
通過比對研究紡錘筒柱藻(A分枝)、三角褐脂藻(C分枝)、牟氏角刺藻(B分枝)和淡水藻尖桿針藻(B分枝)4種硅藻中的8個SIT蛋白序列, 發現保守結構域鋅結合位點 CMLD(Cys-Met-Leu-Asp), 該位點位于兩個不含Lys和Arg的跨膜結構域之間[35-36], 提出基于鋅參與硅酸鹽轉運的模型[36-37]。分析45種海鏈藻屬(包括26種海水屬和19種淡水屬)的 97條SIT蛋白序列發現 CMLD功能結構域雖然很保守, 但半胱氨酸保守性不高, 且不是所有硅藻都含有 CMLD蛋白功能結構域, 與 CMLD功能結構域相比,GXQ(Gly-X-Gln, X代表不同的氨基酸)功能結構域卻相對更保守[6-7,24], 2006年Thamatrakoln等根據保守蛋白功能域提出: 硅酸鹽轉運子的轉運機制是以交替存取轉運的功能模式為基礎, 根據細胞外或內的環境蛋白質構象交替變化暴露出底物結合位點——GXQ序列模型[25]。通過對包括淡水藻、海水藻以及其他硅化生物大約400條SIT蛋白序列進行系統進化分析表明所有的SIT蛋白序列都包括2個重復結構域EGXQ-GRQ[7], 體外重組實驗研究 SIT結構和功能, 也進一步證實保守的GXQ功能結構域與硅酸鹽結合和轉運密切相關[25,38-39]。通過對來自17種硅藻的48條SIT蛋白全長序列比較分析, 還發現了兩個保守功能結構域YQXDXVYL和DXDID, 推測富含天冬氨酸的DXDID保守序列可能作為SIT裂解過程中的蛋白水解位點, 該保守序列沒有脯氨酸殘基的側鏈, 脯氨酸殘基可能會使蛋白質二級結構發生彎曲, 從而阻止半胱氨酸的結合, 是其可能作為蛋白水解位點的又一佐證[40]。
3 硅酸鹽轉運子功能多樣性
硅酸鹽轉運活性受細胞周期的調控, 且與細胞壁結構形成時細胞對硅的吸收密切相關[20,41-42]。而硅饑餓會使細胞周期完全停滯, 細胞周期一般停滯在兩個階段: G1期(G1末期)和G2+M期(即DNA復制完成至子細胞分裂之間)[41,42]。硅藻細胞同步化能夠用于研究細胞特定時期表達的蛋白和基因。
根據硅藻對硅酸鹽的吸收特性從紡錘筒柱藻中發現了第一個硅酸鹽轉運子基因, 將該基因導入非洲爪蟾卵母細胞并使其成功表達, 研究發現該整合細胞對硅元素示蹤劑68Ge(OH)4的吸收比正常細胞提高84倍, 從而證明其具有硅酸鹽轉運功能[20]。進一步研究發現該藻種中 SITs在硅質壁合成之前或合成過程中易于誘導表達, 且在硅質壁合成過程中表達量變化顯著。其中SIT1基因與其他四種表達模式不同, 推測每一種 SITs在硅酸鹽轉運過程中發揮特定的作用, 細胞通過控制每一種 SITs表達部位和表達量來調節硅酸鹽的吸收或轉運[21]。
采用SIT特異性抗體和實時定量PCR技術相結合從蛋白和基因水平檢測了假微型海鏈藻在細胞周期同步化過程中 SIT表達量變化。研究發現蛋白與mRNA表達水平不一致, 蛋白表達量的變化與硅質壁形成過程更相關, 且 mRNA表達最大值發生在 S期,分析推測 mRNA之所以有積累但沒有相應地被翻譯成蛋白質的原因可能是當需要蛋白時,mRNA的積累能夠使細胞產生快速的反應[43]。Curnow等將假微型海鏈藻 SIT1、SIT2和 SIT3與綠色熒光蛋白(Green fluorecent protein, GFP)基因重組并在釀酒酵母成功表達, 在體外建立了成熟的硅酸鹽轉運體系,研究發現SIT對硅酸鹽的吸收依賴于Na+梯度, 但在硅藻細胞中SIT3與SIT1和SIT2不同, 不僅其表達量較低且對硅限制沒有反應[27]。2015年Shrestha和Hildebrand檢測了不同硅酸鹽體系下這三種 SITs的mRNA和蛋白豐度的變化, 并通過基因敲除技術建立了 SITs基因缺陷型假微型海鏈藻細胞系, 研究了在硅饑餓狀態下該藻系對硅酸鹽轉運、二氧化硅結合和脂質積累方面的影響[44-46]。研究發現與正常藻細胞相比, 假微型海鏈藻 SITs基因缺陷型細胞系對硅酸鹽的轉運和二氧化硅的合成影響不同, 且對脂質積累要早于正常藻細胞, 這說明細胞是主動感受硅酸鹽的限制。大量研究數據表明, 在硅酸鹽充足的條件下, SIT轉運作用相對較小, 它們主要作用是檢測硅酸鹽水平, 以評估細胞是否能繼續其子細胞壁的形成和分裂過程。
4 硅酸鹽轉運子進化關系
目前硅藻硅酸鹽轉運子進化起源仍不清楚。硅藻屬于SAR超類群(包含不等鞭毛生物Heterokonts、囊泡蟲 Alveolates和有孔蟲 Rhizaria三大類群)中的不等鞭毛類生物[31,47]。目前在有砂殼的領鞭毛藻雙肋立領藻(Stephanoeca diplocostata)和格藍迪球領藻(Diaphanoeca grandis)中發現了 SIT-type基因序列,其蛋白預測結構與硅藻SIT相似, 都包含一個SIT跨膜結構域(10個 TMDs)和 2個重復結構域 EGXQGRQ[31,37]。對其功能進一步研究發現領鞭毛蟲的SITs基因可以分為 SITα和 SITβ兩種功能型, 其中SITα表達量較高且受硅酸鹽濃度影響顯著, SITβ表達量普遍較低且不受硅酸鹽濃度影響[31]。
根據數據庫比對檢索發現在聚球藻屬(Synechococcus)、不透明紅球菌(Rhodococcus opacus)和海蠕蟲(Capitella teleta)也存在SIT-like(SIT-L)基因序列, SIT-L基因序列只編碼了5個TMDs和一個EGXQ- GRQ結構域, EGXQ位于C-端第2個TMD跨膜片段, GRQ位于 N-端第 3個 TM 跨膜片段[31]。Durak等在顆石藻(Prymnesium neolepis)中也發現了SIT-type的同源序列,包含一個 SIT跨膜結構域(10個 TMDs)和 2個重復EGXQ-GRQ片段的基本結構, 與硅藻SIT同源性達到39.8% ~ 47.0%, 隨后在鈣化相對比較強的三種顆石藻阿氏籃石藻(Scyphosphaera apsteinii)、帕氏顆石藻(Coccolithus braarudii)和細孔鈣盤藻(Calcidiscus leptoporus)也被發現有SIT-L基因序列的存在[32]。
真核生物中存在的SITs同源序列可分為Group 1 SITs、 Group 1 SIT-Ls和Group 2(包含不屬于硅藻的不等鞭毛類、囊泡蟲和放射蟲族系等的SITs和SIT-Ls)三大類群[31]。研究發現陸生植物例如水稻(Oryza sativa)等不存在 SIT-L, 而是存在與 NIP III(nodulin-26-like intrinsic protein III)蛋白功能相似的基因Lsi1和 Lsi6[18,48], 與硅酸鹽流出活性相關轉運蛋白基因Lsi2[49]。Lsi2與細菌砷酸鹽轉運體 ArsB有關, 介導植物細胞內硅酸鹽流出[49]。Lsi2在硅藻和金藻新鱗普林藻(Prymnesium neolepis)中也存在, 其轉錄調控與假微型海鏈藻中的 SIT2高度相似, 但其在細胞中功能作用尚未被鑒定[50]。研究表明硅質較強的海綿種居蟹皮海綿(Suberites domuncula)并未發現SIT同源序列的存在, 分析原因可能是由于海綿中 Na+/共轉運體在硅酸鹽的轉運中發揮主要作用[51]。Lsi2不僅在非硅質化生物中存在, 在硅質化生物也存在 Lsi2-like (Lsi2-L), 表明其在真核生物硅化過程的作用較為保守。研究推測這些不同種類的與硅酸鹽轉運相關的基因最初是作為海洋中高硅濃度的一種解毒機制進化而來, 是為了應對前寒武紀海洋中高硅毒性而出現的[31]。真核生物硅酸鹽轉運蛋白系統發育分析推測生物硅化在不同譜系生物中是獨立進化的, 從而導致硅酸鹽轉運基因的多樣性。真核生物硅酸鹽轉運子廣泛分布和古老起源表明硅酸鹽的利用可能不僅局限于硅質生物, 硅酸鹽在其他真核生物的進化和生物學中也發揮廣泛且基礎的作用。
5 總結與展望
有關硅藻 SIT相關的研究很多, 但都偏向于基因序列的發現(即硅藻物種中SITs存在與否), 或是簡單的表達量的變化, 并沒有過多的深入性的功能探究。這導致 SITs進化源不清晰、SIT的轉運機制不清楚, 這些阻礙了硅藻SIT研究進展。SITs在更多硅藻物種中研究的同時著重硅藻模式物種的研究和開發, 使其功能得到全面的研究和闡明, 能夠為硅藻SIT的研究提供更明確的研究方向和目標。SIT轉運機制的闡明是硅質壁形成的關鍵。硅藻硅質壁的形成不僅是海洋生物礦化中非常重要的部分, 在通過壓載有機物質從真光層下沉, 向深海輸出碳方面同樣發揮著重要作用。提高對硅質壁形成細胞機制的認識將使我們了解過去氣候事件對硅藻影響、更好地預測它們對未來環境變化的反應、進一步完善硅藻的在海洋生物地球化學過程演變中的作用, 為解決當下的全球氣候變化問題提供科學基礎和依據。

