釀酒糧食發酵蒸餾乙醇碳穩定同位素的變化
張 倩,謝正敏,安明哲,葉華夏,魏金萍,黃 箭
(1.五糧液股份有限公司,四川宜賓 644000;2.中國輕工業濃香型白酒固態發酵重點實驗室,四川宜賓 644000)
白酒在我國擁有悠久歷史,是我國文化不可分割的一部分。近年來,屢禁不止的“假酒”事件嚴重損害了消費者的消費信心及正規企業的品牌信譽。從本質上說,“假酒”與白酒的不同就是產品中有機成分(乙醇、風味物質等)來源的不同,涉及到白酒的原料真實性問題。碳穩定同位素技術揭示了產品特征有機物的信息,而該信息受產品原料種類、生長環境、代謝方式等[1]因素影響,不可人為改變,使該技術在白酒、蜂蜜、葡萄酒、奶制品等[2-7]食品及其原料真實性研究領域得到了廣泛應用。白酒的主要成分為乙醇,而白酒中的乙醇最終來源于釀酒糧食,故釀酒糧食碳穩定同位素(δ13C)在理論上決定了白酒乙醇碳穩定同位素(δ13C)。本文以國內最具典型性的白酒原料——高粱、小麥混合釀酒糧食為例,研究混合原料總δ13C→總糖δ13C→發酵乙醇δ13C→蒸餾乙醇δ13C 的變化規律,為白酒鑒別事業添磚加瓦。
1 材料與方法
1.1 材料、試劑及儀器
材料:本地高粱、小麥、多原料基酒、成品酒。
試劑:耐高溫淀粉酶、糖化酶、碘液、白炭黑、IAEA-CH-6(蔗糖,國際原子能機構IAEA,基于V-PDB 計算δ13C=-10.449 ‰)、IAEA-600(咖啡因,國際原子能機構IAEA,基于V-PDB計算δ13C=-27.771 ‰)、HPLC 級乙醇A、B(已標定δ13C值)。
儀器設備:AI 1310 自動進樣器、Trace GC Ultra氣相色譜儀、GC Isolink 燃燒轉化裝置、Delta V Advantage 穩定同位素比值質譜儀、Flash 2000-HT 元素分析儀,均為Thermo Fisher 公司產品;LG10-2.4A 離心機、FOSS CT410 旋風磨。
1.2 前處理方法
粉碎:用旋風磨將高粱、小麥各自粉碎,所得粉末可過100 目篩;按照不同比例將高粱、小麥粉末充分混合后待用;取適量混合糧食粉末包裹入錫盒待測。
液化糖化:往100 mL 蒸餾水中加入混合糧食粉末20 g,在攪拌狀態下加熱至糊狀后加入0.3 mL耐高溫淀粉酶,移入95 ℃水浴中進行液化,直至液化液不再使碘液變藍為止;迅速冷卻液化液至60 ℃,加入0.2 mL 糖化酶糖化3 h,取5 mL 糖化液冷凍保存,其余糖化液進行發酵。
糖樣品:將保存的5 mL 糖化液以4000 r/min 離心5 min 去除固體雜質,用白炭黑吸附干燥后取適量包裹入錫盒待測。
發酵與乙醇樣品:將剩余糖化液高溫滅菌后,迅速冷卻至室溫,加入0.3 g釀酒干酵母,在30 ℃恒溫培養箱中無氧發酵至恒重;用色譜純丙酮將發酵液稀釋,乙醇含量約為4 mL/L,將稀釋液過0.2 μm過濾頭后放入進樣瓶待測。
1.3 測定方法
1.3.1 EA-IRMS測定糧食總δ13C和總糖δ13C
以IAEA-CH-6 為標準品、IAEA-600 為質控樣,采用元素分析-穩定同位素比質譜聯用技術(EA-IRMS)檢測固體樣品;所述元素分析條件為:進樣器He 吹掃流量(Reference)為200 mL/min,氧化爐溫度為960 ℃,柱溫(Oven)為60 ℃,載氣He(Carrier)流量為110 mL/min;穩定同位素比質譜條件如下:離子源真空為1.3×10-6mBar,電壓為3.06 kV。
1.3.2 GC-C-IRMS測定乙醇δ13C
以標定δ13C 后的乙醇A 為標準品、乙醇B 為質控樣,TR-WAXMS 毛細管柱(60 m×0.25 mm×0.25 μm);載氣為高純氦氣,恒流模式,流速為1.0 mL/min;進 樣體 積 為1 μL,進 樣口 溫 度為220 ℃;分流比為20∶1;升溫程序為:起始溫度40 ℃,保持2 min,以1 ℃/min 升溫至50 ℃后保持1 min,再以20 ℃/min升溫至200 ℃并保持4 min。
2 結果與討論
2.1 混合原料總δ13C→總糖δ13C→發酵乙醇δ13C
為研究混合原料總δ13C→總糖δ13C→發酵乙醇δ13C的變化,選擇δ13C差異較大的、國內最具釀酒典型性的高粱、小麥為原料,分別粉碎后按照不同重量比將之充分混合,并按照1.2 處理出不同樣品;按照1.3檢測不同樣品的δ13C,結果見圖1。
小麥屬于C-3 植物、高粱屬于C-4 植物,由于在光和作用中C-3、C-4 植物固碳途徑不同導致兩種植物δ13C 差異顯著,為碳穩定同位素技術辨別釀酒原料提供了理論基礎。圖1a 顯示,隨著高粱、小麥比例的變化,混合糧食總δ13C 發生了相關性非常高的線性變化,符合理論。圖1b 顯示,不同比例糧食總糖δ13C 與混合糧食總δ13C 之間存在差異,前者微弱偏正,但兩者擁有比較高的線性相關性,即兩者相似相關不相同,這是因為植物生長過程中存在同位素自然分餾效應,使得同植物不同物質δ13C 之間也會存在差異。發酵乙醇的主要來源是發酵原材料中的糖,因此發酵乙醇δ13C 必同源于發酵原材料的總糖δ13C,圖1c 顯示了這種同源性:相較于總糖δ13C,發酵乙醇δ13C 更偏負,二者不完全相同,但線性正相關。這是因為在發酵過程中,糖的6 個碳原子有2 個生成了二氧化碳、余4 個生成了乙醇[8],導致碳同位素發生了代謝分餾,使發酵乙醇δ13C與總糖δ13C 相關相似不相同。總之,隨著釀酒原料種類、配比的變化,混合糧食總δ13C、總糖δ13C 發生了相應變化,使得發酵乙醇δ13C 也隨之發生了相關性非常高的變化,印證了釀酒原料δ13C 決定發酵乙醇δ13C 的理論;C-4、C-3 植物的δ13C 多處于-7‰~-15‰、-20‰~-35‰之間[9],當釀酒原料為混合糧食時,按照一定比例混合不同C-4、C-3釀酒原料,可以生產出一切δ13C 處于兩者之間(-10‰~-30‰)的乙醇,換句話說,只檢測乙醇δ13C無法準確判斷釀酒原料的種類。即釀酒原料δ13C決定發酵乙醇δ13C,發酵乙醇δ13C 反映但不可準確辨別釀酒原料。
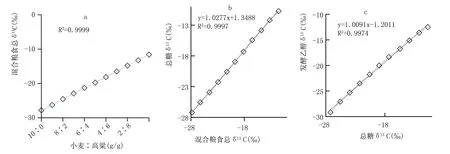
圖1 混合原料總δ13C→總糖δ13C→發酵乙醇δ13C的變化
2.2 蒸餾過程乙醇δ13C的變化
為研究蒸餾過程中發酵乙醇碳穩定同位素變化情況,在蒸酒過程中按體積取樣(每10 mL 取1 個樣)的方法,測定酒精水溶液、小麥發酵液、高粱發酵液、高粱小麥混合發酵液的蒸餾液中乙醇δ13C,結果見圖2。第0 次是發酵原液中的乙醇δ13C 值,第10次是蒸餾后剩余液體中的乙醇δ13C值。
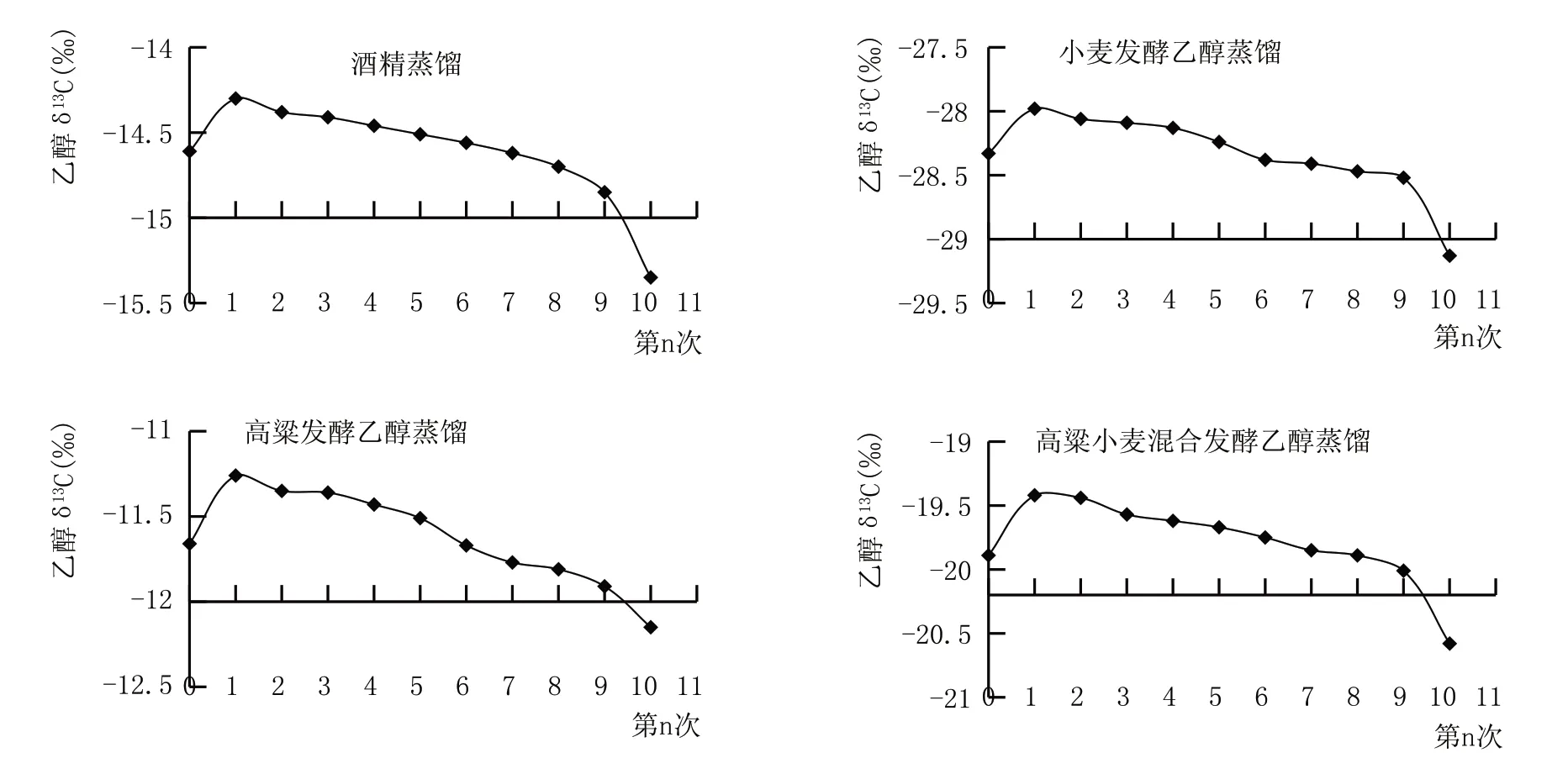
圖2 蒸餾過程乙醇δ13C的變化
由圖2 可以看出,無論是發酵原液還是酒精水溶液,蒸餾過程中乙醇δ13C 均表現出隨蒸餾過程變負的趨勢,這是由于蒸酒過程中乙醇碳穩定同位素出現了反蒸汽壓同位素分餾效應,導致重碳同位素更易累積在先蒸出的乙醇中,使得初蒸乙醇δ13C 相對于發酵原液偏正、末段乙醇δ13C 相對于發酵原液偏負,但總的來說都在一定范圍內(發酵原液乙醇δ13C±1 ‰),不會過于偏離發酵原液乙醇δ13C。以上結果說明蒸餾過程對發酵乙醇δ13C 有微弱影響,但相對于發酵原料的決定性影響來說,可忽略不計,即蒸餾過程對發酵乙醇δ13C 無顯著影響,只是在生產摘酒時,不同酒段的乙醇δ13C 會產生細微差異。
2.3 不同酒段基酒乙醇δ13C的變化
收集了不同濃香型釀酒車間混合釀酒糧食不同糟層不同酒段的基酒若干,用色譜純丙酮將其稀釋到含乙醇約4 mL/L,按照1.3.2 節檢測各基酒乙醇δ13C。蒸餾摘酒順序為酒頭→一級酒→二級酒,將各蒸酒過程中酒頭與一級酒、一級酒與二級酒的差值結果列于表1。
表1 顯示,無論是什么糟層蒸餾的基酒,兩個車間在摘酒時,得到的酒頭與一級酒、一級酒與二級酒的乙醇δ13C 差值均為正值,且都小于1.0‰,說明在摘酒中,隨著蒸餾過程的進行,乙醇δ13C 呈現逐漸微弱變負的趨勢,同2.2 節的結論一致,即蒸餾過程會使不同酒段基酒乙醇δ13C 產生細微差異,但相對于發酵原料的決定性差異來說,蒸餾差異不顯著。
2.4 成品酒乙醇δ13C
收集了同一濃香型酒廠2018 年多批次多糧(配比一致)釀造成品酒樣若干(包括高檔酒29 個、中檔酒18 個),用色譜純丙酮將其稀釋到含乙醇約4 mL/L,按照1.3.2 節檢測各成品酒乙醇δ13C,將結果列于圖3。
圖3 顯示,該濃香型酒廠2018 年生產的多批次高檔酒、中檔酒乙醇δ13C 均值無顯著差異,且標準偏差(STD)均小于1 ‰,比較穩定;而高檔酒多用一級酒生產,中檔酒多用二級酒生產,說明在大生產時,蒸餾過程對不同酒段基酒乙醇δ13C 產生的細微差異無法在不同品級成品白酒乙醇δ13C 上得到體現,即蒸餾過程對同一酒廠釀酒糧食配比一致的不同品級的成品白酒乙醇δ13C無顯著影響。
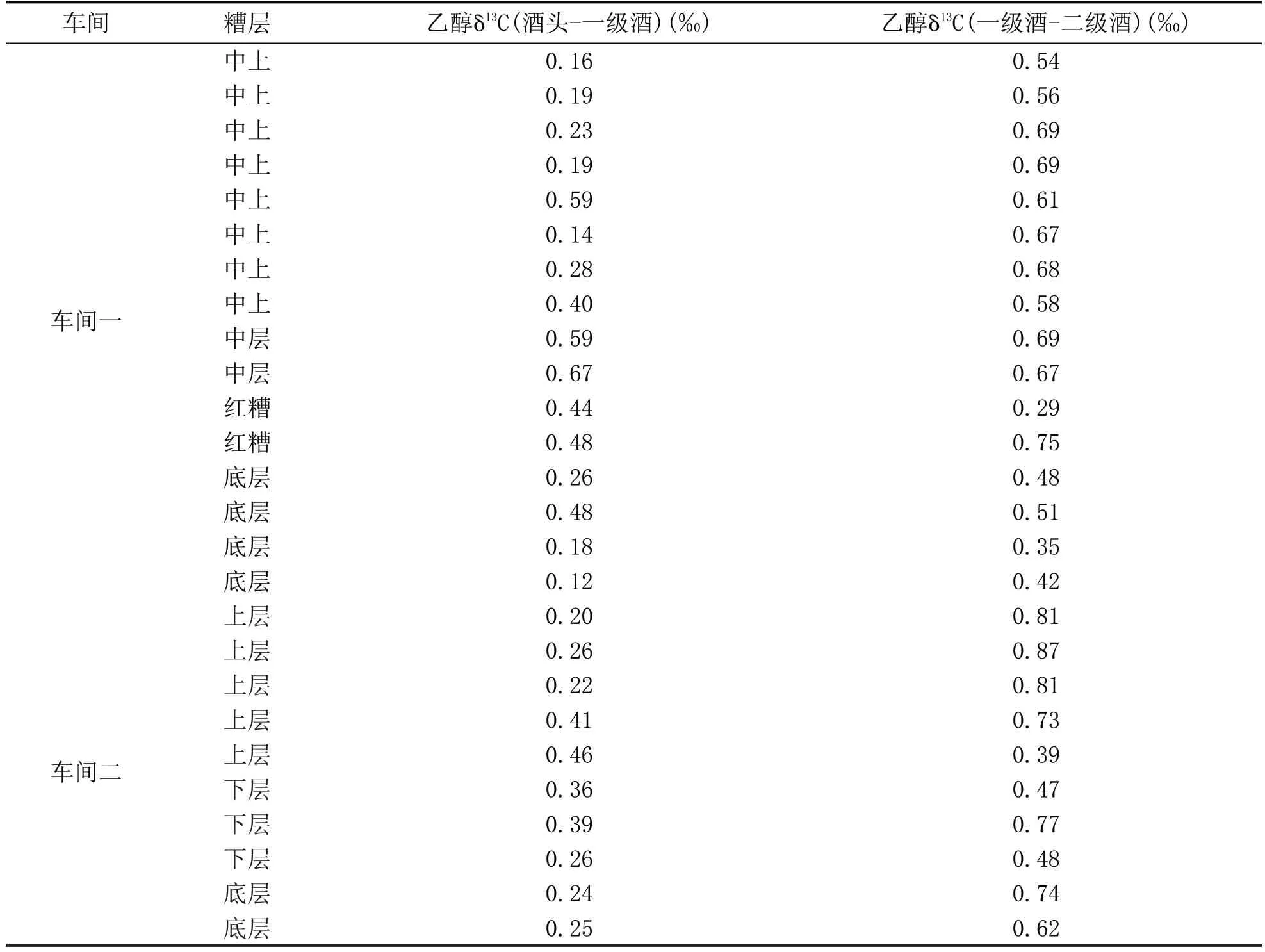
表1 各車間不同酒段基酒乙醇δ13C的差異
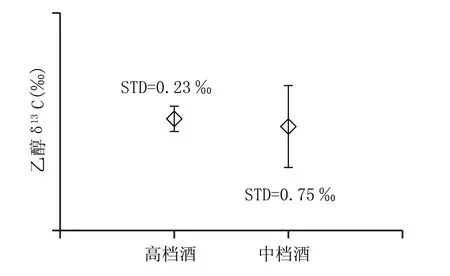
圖3 同一濃香型酒廠2018年成品酒乙醇δ13C均值
3 結論
本研究發現,釀酒原料δ13C 決定發酵乙醇δ13C,發酵乙醇δ13C 反映釀酒原料δ13C,通過乙醇δ13C 辨別釀酒原料在理論上可行,但在實際生產中存在局限性;蒸餾過程不會使發酵乙醇δ13C 產生發酵原料級的變化,但會使生產摘酒時,不同酒段基酒乙醇δ13C產生細微差異,但最終在大生產上對不同品級成品酒乙醇δ13C 無顯著影響。本文為白酒及其原料真實性的鑒別事業添磚加瓦。

