人臍帶間充質干細胞來源的外泌體促進小鼠成骨前體細胞增殖與分化
王 麗,段翠密,原芳芳,王 燕,郭希民,郭紅延
骨折或者骨缺損愈合需要較漫長的鈣化和改建過程,給患者帶來巨大痛苦,降低患者生活質量,加速骨折愈合成為中外學者關注的焦點問題。間充質干細胞(mesenchymal stem cells,MSC)來源的外泌體是一種納米級囊泡樣小體,直徑為40~100 nm,并含有大量的細胞因子和生長因子,可通過轉運特異性蛋白、脂質、mRNA和miRNA等生物活性物質,參與細胞及內環境之間的物質運輸和信號傳遞[1]。近期有研究發現,骨髓來源的外泌體可以促進成骨細胞的增殖與分化[2],然而骨髓MSC的提取過程復雜,具有侵入性,感染概率高,不利于外泌體的大規模生產。因此,從產后廢棄組織中提取干細胞成為首選[3],hucMSCs來源豐富、免疫原性低、無倫理道德爭議、倍增時間短、擴增能力強,便于進行商品化生產。
在對hucMSC-exo的研究中發現其具備hucMSC的大部分優勢且無致瘤[4]。目前,還沒有關于hucMSC-Exos對成骨細胞生物學行為影響的報道。因此,本研究從細胞條件培養液中提取并鑒定hucMSC-exo,通過體外細胞實驗觀察hucMSC-exo對mOPCs增殖與分化的影響,以期為未來hucMSC-exo在骨修復領域的應用提供實驗依據。
1 材料與方法
1.1 試劑和儀器 胎牛血清、α-MEM(Gibco,美國);BCA蛋白定量檢測試劑盒(Thermo Fisher,美國);地塞米松、維生素C、β-磷酸甘油鈉、油紅干粉(Sigma,美國);成軟骨誘導培養液(Cyagen,中國);堿性磷酸酶染色試劑盒(上海邁基,中國);CCK-8(同仁,日本);Anti-CD9抗體(Millipore,美國);Anti-CD63抗體(Affinity Biosciences,美國);超速離心機(Beckman Optima TM L-100XP,美國);電泳儀(Bio-Rad,美國);倒置顯微鏡(Nikon,日本)。
1.2 實驗動物 健康新生24 h內C57BL/6乳鼠及3周齡C57BL/6小鼠(SPF級),購自北京維通利華實驗動物技術有限公司,飼養于解放軍軍事醫學科學院SPF動物實驗室。
1.3 方法
1.3.1 mOPCs的分離培養 按照貼壁法分離培養原代mOPCs[5]。將健康新生24 h內的C57BL/6乳鼠浸泡于75%乙醇中,進行皮膚消毒,5 min后取出,脫頸處死,無菌條件下取出小鼠顱骨,去除其周圍組織并盡可能地剪碎,加入0.25%的胰酶及0.1%的膠原酶消化20 min后,用等量的完全培養液終止消化,1000 r/min,離心5 min后,用含10%胎牛血清的α-MEM培養液吹散,將碎骨片鋪于直徑10 cm的培養皿中,于37℃、5%CO2條件下培養5~7 d,于第3天更換培養液,之后隔天更換培養液,全程避免骨片移位,待細胞融合達到70%~80%時傳代,并進行傳代穩定性觀察。
1.3.2 hucMSCs的體外分離培養與鑒定 人臍帶來源于解放軍總醫院婦產科,產婦及家屬知情同意。按照Koh等[6]方法提取hucMSC,即無菌留取健康產婦剖宮產臍帶,生理鹽水洗凈,用青霉素、鏈霉素雙抗浸泡,去包膜、臍動脈、臍靜脈,將華通氏膠剪碎,貼壁培養,待大部分細胞爬出,瓶底長滿細胞,進行換液、傳代,觀察細胞生長狀況。取第3代hucMSCs以1×105細胞/孔接種于含10%FBS的α-MEM培養液的6孔板中,待細胞融合至60%時,分別進行成骨、成脂及成軟骨誘導。(1)hucMSCs的體外成骨分化及鑒定:細胞融合至60%時,改用成骨誘導培養液(含有10%FBS,0.1 μM地塞米松,10 mMβ-甘油磷酸酯和50 μg/ml抗壞血酸的α-MEM培養液),間隔3 d換液一次。14 d后,將細胞固定,馮·科薩染色觀察。(2)hucMSCs的體外成脂分化及鑒定:細胞融合至60%時,改用成脂誘導培養液(含有1 μM地塞米松,0.5 mM 1-甲基-3-異丁基黃嘌呤,100 μM吲哚美辛和10 μM胰島素的α-MEM培養液),14 d后,進行油紅O染色評估。(3)hucMSCs的體外成軟骨分化及鑒定:取處于對數生長期的4到9代hucMSCs,傳代后取2×105個細胞在15 ml離心管內以800 r/min離心5 min,細胞會在離心管底部形成小球,輕柔地吸掉上清液,換用成軟骨誘導培養液(以α-MEM為基礎培養液,添加6.25 μg/ml胰島素、6.25 μg/ml轉鐵蛋白、10 ng/ml轉化生長因子β1、0.1 μmol/L地塞米松、50 μg/ml維生素C、5%胎牛血清)進行培養,間隔3 d換液1次,21 d后將細胞固定,石蠟包埋切片后進行HE染色以及免疫組化法測定軟骨組織特異性Ⅱ型膠原。
1.3.3 hucMSC-exo的分離與鑒定 按照Zhang等[7]所述方法提取外泌體,即取3~8代融合至80%的hucMSCs,以不含血清的α-MEM培養液饑餓處理,48 h后收集上清,1000 r/min離心10 min,去除細胞和細胞碎片,收集上清并通過0.22 μm的濾膜過濾以去除大于220 nm的囊泡顆粒。于4 ℃環境下,34 288 r/min離心80 min收集外泌體并儲存于-80℃,備用。使用BCA蛋白檢測試劑盒(Thermo Fisher Scientific)測定外泌體蛋白含量。通過透射電子顯微鏡(TEM,HITACHI,H-7650)觀察外泌體的形態。RIPA裂解液裂解hucMSC-exo通過Western blot鑒定外泌體特征性標志物CD9和CD63。
1.3.4 mOPCs增殖實驗 細胞分組 對照組為mOPCs培養于5%FBS的α-MEM培養液;5 μg/ml hucMSC-exo實驗組為mOPCs培養于含有5 μg/ml的外泌體、5%FBS的α-MEM培養液;10 μg/ml hucMSC-exo實驗組為mOPCs培養于含有10 μg/ml的外泌體、5%FBS的α-MEM培養液。將P2代mOPCs以2×103個細胞/孔的密度接種于96孔板中,每組4個復孔,加入各組相對應的培養液,常規培養,間隔2 d換液,分別于1、3、5、7 d經CCK-8試劑盒測定450 nm處吸光度值,并繪制生長曲線。
1.3.5 堿性磷酸酶活性測定 將mOPCs以1×104個細胞/孔接種于24孔板,分組同上,每組3個復孔,加入對應培養液,常規培養7 d,棄上清,PBS洗滌3次,按照堿性磷酸酶檢測試劑盒說明書進行染色,利用IMAGE J軟件對染色結果進行半定量分析。
1.3.6 茜素紅染色 將mOPCs以1×105個細胞/孔接種于12孔板,分組同上,每組3個復孔,加入各組相對應的培養液,常規培養21 d,各組細胞用4%多聚甲醛液固定10 min后,PBS洗滌3次,茜素紅染色30 min,蒸餾水清洗,觀察拍照。加入10%氯化十六烷基吡啶溶解1 h,吸取懸液,測562 nm處A值。
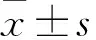
2 結 果
2.1 mOPCs的分離培養 原代培養mOPCs,骨片貼壁48 h后有大量細胞從骨片爬出,體積較小,胞體飽滿,突起較短,細胞增殖較快,細胞匯合后傳代培養(圖1A)。傳代后細胞以梭形為主,細胞呈半透明狀,輪廓清晰,旋渦狀生長(圖1B和圖1C)。

圖1 mOPCs的分離培養(100×)
2.2 hucMSCs體外分離培養和鑒定 原代hucMSCs體外培養7 d,可見細胞貼壁呈梭形,半透明狀,輪廓清晰,部分聚集成簇,呈旋渦狀生長(圖2A)。多向分化結果顯示,hucMSCs體外成骨誘導培養14 d時,馮·科薩染色顯示礦化結節形成(圖2B)。成脂誘導培養28 d后,油紅O染色見胞漿中出現圓形或橢圓形紅色串珠狀脂滴(圖2C)。成軟骨分化21 d后,HE染色可見組織團塊內細胞分布較均勻,細胞外基質較為豐富(圖2D),阿爾辛藍染色可見淡藍色的軟骨基質成分(圖2E),免疫組化染色顯示細胞外基質中可見彌漫分布的Ⅱ型膠原(圖2F)。

圖2 hucMSCs分離培養與鑒定
A. hucMSCs原代培養;B. 馮·科薩染色;C. 油紅O染色;D. HE染色;E. 阿爾辛藍染色;F. Ⅱ型膠原染色
2.3 hucMSC-exo的分離與鑒定結果 透射電鏡下可見外泌體呈橢圓形、圓形,膜結構完整,對3個樣品的多個視野進行粒徑分析顯示,粒徑大小為(80.0±32.5)nm(圖3A)。Western blot的分析結果顯示外泌體的特征性標志物CD9和CD63陽性表達(圖3B),符合文獻[8]報道的外泌體的生物學特性和鑒定標準,說明成功分離獲得了hucMSC-exo。
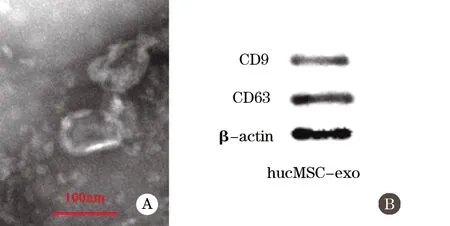
圖3 hucMSCs-exo的鑒定
2.4 hucMSC-exo促進mOPCs增殖 CCK8結果顯示實驗組和對照組相比,在3、5、7 d時,添加hucMSC-exo(5 μg/ml,10 μg/ml)的實驗組其mOPCs的增殖數量明顯增加,且隨著外泌體濃度的增高,增殖越明顯,呈現劑量依賴性(圖4)。
2.5 hucMSC-exo促進mOPCs的成骨分化 堿性磷酸酶活性染色結果顯示,mOPCs培養7 d后,鏡下觀察可見添加hucMSC-exo實驗組會有大量棕色硫化鈷顆粒沉積于胞質中(圖5),堿性磷酸酶活性顯著高于空白對照組,且酶的此種活性效應隨著外泌體濃度的增加而增大,表現出明顯的劑量依賴性。IMAGE J軟件半定量分析結果顯示,5 μg/ml和10 μg/ml hucMSC-exo實驗組與空白對照組比較,差異有統計學意義(P<0.001,表1)。

圖4 hucMSC-exo對mOPCs增殖的影響

圖5 hucMSC-exo刺激mOPCs后ALP染色(400×)


組別nALP半定量分析結果Control1224.61±1.925 μg/ml hucMSC-exo1252.35±3.97①10 μg/ml hucMSC-exo12108.32±3.69①②P0.05
注:與Control組相比,①P<0.05;與5 μg/ml hucMSC-exo組相比,②P<0.05
茜素紅染色結果顯示(圖6),mOPCs培養21 d后,鏡下觀察可見添加hucMSC-exo實驗組能夠分泌出更多的礦化基質,有大量的鈣化結節形成,空白對照組則形成較少,茜素紅染色定量結果顯示空白對照組A562為0.324,5 μg/ml和10 μg/ml的hucMSC-exo實驗組A562分別為1.352和1.87,均高于對照組,且此種鈣化結節的形成隨著外泌體濃度的增加而增大,亦表現出明顯的劑量依賴性。

圖6 hucMSC-exo刺激mOPCs后茜素紅染色結果(100×)
3 討 論
據報道,MSC療法可促進骨再生和骨折愈合[9, 10]。以往的研究證明,MSC療法在損傷修復過程中可以觸發細胞、細胞外基質以及信號分子之間的相互作用。但是,迄今為止尚未完全闡明這種作用的發生機制。在眾多潛在的分子機制中,MSC釋放的外泌體被認為是至關重要的,并引起了越來越多的關注[11, 12]。Narayanan等[13]發現人骨髓基質細胞來源的外泌體可觸發未分化的人骨髓基質細胞成骨分化,Qin等[14]經體內體外實驗研究證明BMSC衍生的外泌體可以通過增強成骨基因的表達來調控成骨細胞分化。與眾多的MSC相比,hucMSCs來源于產后廢棄組織,來源廣泛,無倫理道德爭議,分離方法簡單、產量高、增殖快,易于大規模生產,Todeschi等[15]研究發現hucMSCs的骨修復作用與干細胞通過旁分泌作用調節靶細胞功能有關,但他們無法證實外源性干細胞與內源性祖細胞之間是否發生了細胞間串擾。我們目前的研究提供了第一個有力的證據,表明外源性干細胞可以通過產生外泌體與mOPCs進行對話,并對其生物學行為產生影響。
本實驗通過低溫超速離心法獲得較純的外泌體,電鏡下呈杯托狀,大小多集中在90 nm處,并且能表達CD9和CD63標志性表面蛋白,符合外泌體的生物學特性和鑒定標準[16]。將hucMSC-exo與mOPCs復合培養,進行細胞增殖實驗,結果顯示hucMSC-exo可以明顯促進mOPCs的增殖,且此種增殖效應隨著時間和劑量的增加而增加,表現出顯著的時間依賴性和劑量依賴性。堿性磷酸酶活性水平是mOPCs早期成骨分化的重要評價指標[17],在hucMSC-exo刺激下培養7 d,mOPCs表現出更高的堿性磷酸酶活性。分化成熟的mOPCs會進一步產生礦化結節,是mOPCs成熟期成骨分化的重要指標之一,在hucMSC-exo刺激下mOPCs培養21 d,可見更多的鈣結節形成,且隨著劑量增大而增加,亦表現出明顯的劑量依賴性。
綜上所述,本實驗從體外驗證了hucMSC-exo可以促進mOPCs的增殖以及提高其成骨分化能力,提示在未來研究中可考慮直接使用hucMSC-exo進行骨損傷治療,以期取代間充質干細胞,實現“無細胞再生醫學”[18],但目前,對干細胞源外泌體的研究仍處于臨床前期,有諸多問題阻礙其臨床應用,有待深入闡明,例如,如何大量富集、純化、標記外泌體,如何根據外泌體半衰期制定合適的給藥途徑及給藥頻次,如何提高治療靶向性等[19, 20]。此外,hucMSC-exo中含有miRNA、mRNA、IncRNA及蛋白質等多種生物活性分子,其作用很可能與這些生物活性分子有關,但具體由哪一種或者由哪幾種活性物質,以何種方式起作用尚不清楚,在未來研究中還需進一步闡明。

