鞣花酸提升小鼠肌肉功能的研究及機制探討
蘆宇婷,李 軍,周仙杰,呂裕霞,魯飛翔,劉慶春
機體骨骼肌隨著疾病、衰老等因素發生結構和功能的衰退,使骨骼肌持續流失,通常表現為肌肉在運動乃至日常行為中無法保持正常的力量水平,引起機體生物調節紊亂,導致機體疲勞感增強等問題[1,2]。營養干預是預防肌肉衰退、提升抗疲勞性的重要手段之一,因此,發掘能夠增強肌肉功能、抗疲勞的營養物質尤為重要[3]。鞣花酸(ellagic acid,EA)是植物中存在的一種天然多酚化合物,經腸道微生物代謝產生尿石素,通過被動擴散的吸收機制發揮生物學效應[4-7]。作為一種植物性天然化合物,EA藥理活性豐富[8-12],有研究表明,健康志愿者通過補充富含EA的石榴汁使得力量恢復能力得以提升,減輕了運動引起的肌肉酸痛[13,14],因此,研究EA對肌肉功能的影響具有實際意義。但目前EA對機體肌功能及抗疲勞等方面的研究尚少,仍需進一步研究。
本研究旨在通過對小鼠肌肉量、肌力、疲勞掉落次數,肌纖維橫截面積大小及與蛋白質降解相關的基因肌肉特異性環指蛋白1(muscle RING finger 1,MuRF1)和肌肉萎縮基因Fbox-1(muscle atrophy f-box,MAFbx/Atrogin-1)相對表達量的檢測[15],探討EA對正常小鼠體成分、肌肉功能、運動耐力,以及抗疲勞性等方面的作用。
1 材料與方法
1.1 實驗動物及分組 16只6周齡雄性清潔級ICR小鼠,體重(30.7±2.9) g,購自北京維通利華實驗動物技術有限公司,許可證編號SCXK(京)2016-0006,飼養于災害救援基礎醫學中心。按照國家標準嚙齒類試驗動物飼養,在(23±2)℃恒定室溫、12 h明暗交替環境下,實驗動物自由飲水、攝食。動物實驗經動物福利委員會審批。
1.2 實驗動物EA干預 實驗動物適應性飼養一周后進行簡單隨機分組,實驗組和對照組,每組各8只。精準稱量體重后,利用Echo MRITM小動物體成分分析儀(中國匯佳生物股份有限公司)檢測體實驗動物成分。檢測結束當天,給予實驗組動物純度99.3%的EA(南京道斯夫生物科技有限公司),用0.5%的羥甲基纖維素鈉(北京索萊寶科技有限公司)溶液配制EA干預溶液,每毫升EA干預溶液中含10 mg EA,實驗組和對照組小鼠分別給予EA溶液和等體積的0.5%羥甲基纖維素鈉溶液進行灌胃干預。參考以往試驗劑量[16],EA灌胃劑量為10 mg/100 g體重,灌胃體積為1 ml/100 g體重,1次/d,干預溶液現用現配。
1.3 實驗動物體成分檢測 實驗動物稱重后,放置于相應規格的透明塑料動物倉中,將動物倉插入Echo MRITM分析儀內,設置精度3,即6次信號采集,通過掃描得到小鼠的肌肉含量。EA干預前和干預結束12 h后各進行一次檢測。
1.4 小鼠四肢肌力測定 用YLS-13A大小鼠抓力儀(北京眾實迪創科技發展有限責任公司)測定小鼠四肢肌力,測定抓力前讓小鼠在抓力儀上適應3 min,將抓力儀設置為測定狀態,確定小鼠四只腳掌都完全抓牢后,抓住小鼠尾巴末梢平穩向后拉動,記錄抓力儀讀數。每只小鼠測定3次抓力(g),取3次抓力平均值作為評估肌力的指標,EA干預前和干預結束12 h后各進行一次檢測。
1.5 小鼠肌肉功能測定 用YLS-4C輪轉式疲勞儀(北京眾實迪創科技發展有限責任公司)測定小鼠肌肉功能,預實驗摸索出YLS-4C輪轉式疲勞儀最佳輪轉速度和時間,儀器啟動前將小鼠置于滾輪上,啟動儀器,設置輪轉式疲勞儀轉速為35 r/min,待轉速穩定后,使小鼠適應1 min,開始計時,10 min計為一周期,每個周期結束后休息1 min,記錄小鼠在10 min內的掉落次數,重復3次[17]。EA干預前和干預結束12 h后各進行一次檢測。
1.6 HE染色測定腓腸肌橫截面積 干預結束后,分離小鼠后腿兩側腓腸肌。將腓腸肌浸入10%甲醛固定液(北京索萊寶科技有限公司)中固定用于制作石蠟切片。HE染色后,應用LEICA圖像采集系統隨機選取5個視野進行圖像采集。每個圖像選取10個肌纖維,利用Image J軟件計算各個肌纖維橫截面積。
1.7 qRT-PCR檢測實驗動物腓腸肌中MuRF1基因表達 小鼠單側腓腸肌放入RNase-Free管中加液氮充分研磨,根據組織總RNA提取試劑盒說明進行總RNA提取。利用瓊脂糖凝膠電泳、NanoDrop微量分光光度計評估RNA的完整性和純度。將總RNA反轉錄為cDNA,并在逆轉錄過程中將RNA濃度調整一致(100 ng/20 μl)。構建25 μl qRT-PCR反應體系,采用以下條件進行qRT-PCR實驗:94 ℃預變性2 min,94 ℃ 20 s、58 ℃ 20 s、72 ℃ 20 s條件下35個循環,72 ℃總延伸2 min。引物序列參照以往文獻[15],其中GAPDH為內參基因,每個樣品設置3個平行組。
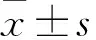
2 結 果
2.1 小鼠干預前后體重和體成分比較 EA干預前,兩組小鼠體重和體成分(肌肉含量、脂肪含量)差異無統計學意義。干預后兩組間小鼠體重和體成分也未觀察到統計學差異,與之前報道的結果相似[3, 18]。由此可見,EA對小鼠體重和體成分無明顯影響(表1)。


觀察指標例數實驗前實驗后P體重 對照組830.03±3.1333.58±4.020.425 實驗組831.29±2.9335.15±3.63脂肪含量 對照組82.53±0.943.38±0.990.393 實驗組82.24±0.442.91±1.11肌肉質量 對照組822.49±3.0724.31±3.450.534 實驗組823.99±2.1425.28±2.56
2.2 小鼠干預前后四肢抓力和肌肉功能比較 EA干預前,兩組小鼠抓力無統計學差異。干預結束后,與對照組相比,實驗組小鼠抓力增強,差異有統計學意義(P<0.001)。實驗開始前,兩組小鼠30 min輪轉疲勞儀掉落次數沒有差異。EA干預后,與對照組相比,實驗組掉落次數減少,差異有統計學意義(P<0.001,表2)。


時間對照組(n=8)實驗組(n=8)四肢抓力 實驗前229.63±30.76239.64±26.95 實驗后246.13±31.99336.00±38.33①掉落次數 實驗前3.00±0.763.13±0.64 實驗后3.25±0.711.75±0.46①
注:與對照組比較,①P<0.001
2.3 小鼠干預后腓腸肌肌纖維橫截面積比較 干預后,實驗組腓腸肌肌纖維排列較對照組更加緊密(圖1)。實驗組肌纖維橫截面積為(1248.96±103.57)μm2,對照組為(1167.43±82.53)μm2,與對照組相比,實驗組小鼠橫截面積增加,差異有統計學意義(P<0.05)。

A.對照組;B.實驗組
2.4 小鼠干預后腓腸肌中MuRF1和Atrogin-1基因的相對表達量比較 實時熒光定量PCR的結果顯示,實驗組MuRF1和Atrogin-1基因的相對表達量(0.99±0.15、0.96±0.16)(1.48±0.39、1.45±0.09)均低于對照組,差異有統計學意義(P<0.05)。
3 討 論
骨骼肌是人體非常重要的肌群,多種疾病的發生都伴隨著骨骼肌質量的流失和功能的退化[19]。肌肉量降低導致肌肉功能受損,對老年人而言會使其活動能力下降,并伴隨著多種慢性病的發生,嚴重者甚至導致平衡障礙、起坐困難、跌倒骨折等意外風險,嚴重影響了老年人生存質量。對于中等及以上體力勞動的成人而言,肌肉質量減少會引起疲憊乏力、免疫功能下降、記憶力衰退、睡眠質量不佳等多方面危害,影響了日常生活和工作效率[3]。有研究表明[20],萎縮或者廢用的肌肉可以在不同輔助治療后得以再生,輔助性營養治療可以減輕肌肉損傷、增強肌功能以及緩解疲勞[21]。
本實驗通過給予小鼠EA干預,研究其對小鼠肌肉功能的影響。結果顯示,EA干預后,小鼠的抓力增加和疲勞儀掉落次數減少,同時小鼠腓腸肌肌纖維橫截面積增加。其中實驗組小鼠腓腸肌肌纖維橫截面積增加,可能原因:一是腓腸肌以Ⅱ型肌纖維為主[22],本實驗條件下EA的干預可能導致Ⅱ型肌纖維變大,使肌纖維橫截面積增加。Ⅱ型肌纖維與肌肉力量相關,本實驗中EA干預后實驗組小鼠抓力增強,便驗證了這種可能性。二是腓腸肌雖然以Ⅱ型肌纖維為主,但也含有Ⅰ型肌纖維,且小鼠Ⅰ型肌纖維較Ⅱ型肌纖維粗。在特定條件下,Ⅰ型肌纖維會向Ⅱ型肌纖維轉化[23],當Ⅰ型肌纖維向Ⅱ型肌纖維轉化速度降低時,可能也會出現肌纖維橫截面積增加的情況,這與本研究EA干預后實驗組小鼠肌纖維橫截面積大于對照組的結果相一致。Ⅰ型肌纖維與肌肉的耐力和抗疲勞性呈正相關[22],與正常速度轉化的對照組比較,實驗組Ⅰ型肌纖維在肌肉中的比例相對較大,我們猜測EA干預后Ⅰ型肌纖維向Ⅱ型肌纖維轉化速度降低,本實驗中實驗組小鼠掉落次數降低,即實驗組小鼠抗疲勞性和耐力更好。
此外, MuRF1和Atrogin-1基因在mRNA水平表達明顯上調,常作為骨骼肌萎縮早期的分子標記物,本研究對腓腸肌中MuRF1和Atrogin-1基因的表達進行了檢測。實驗結果顯示,EA干預后,實驗組小鼠MuRF1和Atrogin-1基因的相對表達量降低。這表明本實驗條件下EA的干預對小鼠肌肉的代謝可能具有有益作用。
綜上所述,在行為學水平上,EA可以增加小鼠肌力,提升小鼠耐力及抗疲勞性;在組織病理學水平上,EA的干預可以增加肌纖維橫截面積;在基因水平上,EA干預可能通過泛素蛋白酶途徑,下調控制肌肉代謝的MuRF1和Atrogin-1的基因表達水平,緩解肌肉分解代謝,進而改善肌肉功能。未來我們將研究重心放在臨床,進一步探究EA對不同人群肌肉質量、肌力以及肌肉功能等方面的影響,為以EA為主要原料的功能性食品的研發以及肌肉代謝疾病的預防與治療提供基礎研究及臨床試驗依據。

