甲基紅褪色光度法測定大米中過氧化氫酶活性
董 娜 張愛菊 張小林
(甘肅醫學院,平涼 744000)
植物果實在逆境或衰老時,由于體內活性氧代謝加強而使過氧化氫(H2O2)發生累積,H2O2可進一步生成羥自由基,可直接氧化核酸蛋白質等大分子物質,破壞細胞膜,加速細胞的衰老和解體。過氧化氫酶(CAT)是最重要的酶促防御系統,可清除H2O2,保護細胞正常生活,其活性與植物抗逆性密切相關。
大米在儲藏過程中的新鮮度有很多評價指標[1],過氧化氫酶活性是其中之一[2],其常見的檢測方法為國家標準中的碘量法和高錳酸鉀滴定法[3-5],即通過滴定CAT催化H2O2反應后剩余的H2O2與碘化物作用生成碘量的變化或消耗高錳酸鉀的量計算CAT活性。滴定法優點是所用設備簡單,缺點是測定中憑肉眼觀測滴定終點,存在較大的人為判斷誤差,以及操作中滴定液流量的控制誤差等。除此之外,其他領域還有多種方法報道,包括紫外光度法[6-8]、熒光分析法[9]、化學動力學光度法[10-14]等。董娜等[14]以二苯胺磺酸鈉為底物完成CAT顯色動力光度法測定,但顯色靈敏度有限,H2O2表觀摩爾吸光系數ε<5.0×102L/(mol·cm)。
甲基紅是一種偶氮基有色染料,摩爾吸光系數ε=5.0×102L/(mol·cm),遇氧化劑氧化降解而褪色,褪色程度與氧化劑的量有確定的函數關系[15],在硫酸介質中能被過氧化氫氧化為無色,Fe3+可以加速氧化反應進程,通過CAT加入前后吸光度變化值實現酶活性測定。
目前過氧化氫酶活性單位表述不統一,多采用μmol/(min·mL)[16],酶活性定義為:1個單位的過氧化氫酶是指在pH為7.0、25 ℃下每分鐘能分解1 μmol的H2O2。國家標準規定酶活性的單位是mg/g[1],即以每克組織樣品中過氧化氫酶含量的多少來表示其活力的大小。該法具有相對的權威性,但沒有對酶液做出特別說明。實驗證實,酶催化反應速度完全取決于底物中酶量多少。本實驗采用μmol/L(U/L)表示酶液酶活性,采用μmol/g(U/g)表示固體組織樣品中酶活性。
1 材料與方法
1.1 材料與儀器
寧夏長粒香米、寧夏普通大米、東北長粒香米、東北普通大米:均為2017年、2018年產。
CAT標準品:配制濃度1 mg/mL(5 000 U/mL),高錳酸鉀標定后配成1 U/mL;0.1 g/L甲基紅(乙醇溶解,含0.6 g/L EDTA);0.01 mol/L Fe3+溶液:稱取5 g硫酸鐵銨于50 mL燒杯中,加入0.02 mol/L的H2SO4溶液20 mL,待溶解后移入100 mL容量瓶中,用水稀釋至100 mL,搖勻;5×10-4mol/L甲基紅乙醇溶液(含φ=95 %的乙醇);2 mmol/L H2O2基質液;2 mol/L H2SO4溶液;0.1 mol/L磷酸鹽緩沖溶液(pH=7.0);實驗用水為二次蒸餾水,試劑均為分析純。
7230G型可見分光光度計。
1.2 方法
1.2.1 過氧化氫酶活性的測定
1.2.1.1 甲基紅褪色光度法
向50 mL容量瓶中加入35 ℃預熱5 min后的CAT樣液(酶活小于1 000 U/mL)1.00 mL、H2O2基質液4.00 mL,混合反應20 min后立即加入2.5 mL硫酸終止反應。然后依次加入甲基紅5.00 mL,Fe3+溶液2.5 mL,搖勻,40 ℃水浴60 min后加水定容,用1 cm比色皿,以蒸餾水為參比,于510 nm處測定吸光度A。同時完成酶空白實驗吸光度A0測定,根據ΔA(ΔA=A0-A)確定過氧化氫酶活性E。
1.2.1.2 高錳酸鉀法和碘量法
對寧夏長粒香米用高錳酸鉀法和碘量法進行測定[3],實驗平行測定6次,計算原樣品酶含量(U/g),并與甲基紅褪色光度法作比較。
1.2.2 大米樣品測定
分別稱取3.00 g(已扣除水分)過篩后的8種大米粉,加入50.00 mL、pH=7.0生理鹽水,研磨振蕩混合后定容至1 000 mL,過濾,取濾液2.00 mL,測定過氧化氫酶活性,實驗平行6次,并測定回收率。
2 結果與分析
2.1 吸收光譜與最大吸收波長
不同體系吸收光譜見圖1所示。空白體系(不含H2O2和CAT)在510 nm處有最大吸收,峰形尖銳,峰值較高,甲基紅(MR)摩爾吸光系數ε=2.52×104L/(mol·cm);非酶體系(不含CAT)保持原有峰形,這說明H2O2與MR僅存在單純的褪色反應;加入CAT后,褪色程度受抑制(酶促體系),峰位未發生改變,這說明引起褪色反應的核心物質是過氧化氫,在過氧化氫取值一定時,褪色程度與過氧化氫酶活度有一定的函數關系。實驗選取510 nm作測定波長。

圖1 吸收光譜圖(E=0.1 U/mL)
2.2 褪色反應催化劑選擇
設定H2O2的濃度為0.16 mmol/L,針對非酶體系實驗考察不同金屬離子催化性能。結果表明:Fe3+、Fe2+和Mn2+對H2O2氧化甲基紅褪色反應均有催化作用,但性能有差異。Fe2+酸性環境下更易被H2O2氧化,阻抑和催化并存,Mn2+優于Fe2+;相對而言Fe3+作用更為顯著,Fe3+依托其特有的中強度氧化性,在H2O2和甲基紅之間構建一條電子通道。因此選擇Fe3+作催化劑。
2.3 甲基紅用量考察
甲基紅溶液的顏色和吸光度值取決于溶液酸度和甲基紅用量,控制pH≤2,測定甲基紅溶液吸光度A,在V=0.00~7.00 mL范圍內,A與V有很好的線性關系。為了減少測量誤差,將測量體系吸光度控制在0.200~0.700范圍內,實驗確定甲基紅用量為5.00 mL。
2.4 底物H2O2用量設置
僅針對酶空白體系,改變H2O2的量,使反應液中H2O2分別為0.00、0.04、0.08、0.12、0.16、0.20、0.24 mmol/L,按實驗方法完成褪色反應。由圖2可知:當H2O2的濃度在0.00~0.20 mmol/L時,H2O2的用量與吸光度呈線性關系,當H2O2的濃度達到0.24 mmol/L時,甲基紅完全被降解,吸光度趨于0,因此,選擇H2O2濃度為0.16 mmol/L,即2 mmol/L H2O2體積設定量為4.00 mL。
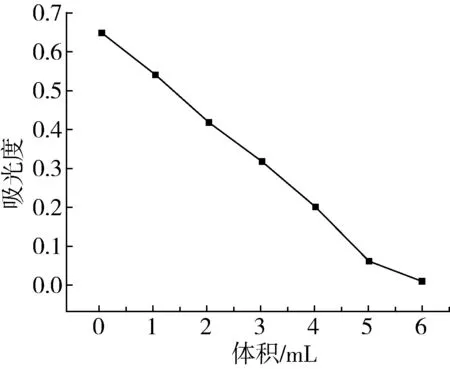
圖2 底物H2O2用量
2.5 褪色反應溫度及時間
分別在25、30、35、40、45、50、60 ℃條件下完成褪色反應。室溫下,褪色反應緩慢;40 ℃時反應60 min,線性關系最好。
2.6 硫酸用量
酶促反應的終結和氧化褪色反應均需要硫酸,硫酸介質又能有效克服Fe3+溶液水解,確保甲基紅溶液顏色恒定;避免酶液加入后出現二次渾濁。取酶標準液6.00 mL,其他條件不變,僅改變硫酸用量,測定吸光度和溶液pH。當V<2 mL時,pH=0.9,ΔA有最大值。實驗選用硫酸體積2 mL。
2.7 酶促反應時間影響
在底物濃度為0.16 mmol/L、30 ℃條件下,加入酶標準液3.00 mL和6.00 mL,分別反應1、2、3、4、5、6、7、8、9 min,作出酶促反應曲線。由圖3可知:兩條曲線變化趨勢完全一致,在反應0~3 min和5~20 min內,酶促反應速率與時間成正比,單位時間內ΔA變化一致,符合酶促催化一級反應特征。20 min后,A值趨于穩定。因此,確定酶促反應時間為20 min。

圖3 反應時間與反應速率的關系
2.8 工作曲線
取過氧化氫酶標準溶液0.00~1.00 mL作測試液,在最佳條件下完成ΔA測定,繪制工作曲線(圖4)。過氧化氫酶活力E在0~0.12 U/mL范圍內與ΔA呈良好的線性關系:ΔA=0.001+2.276E,r=0.998 9,按實驗方法平行測定空白10次,標準偏差s為0.005,3倍的信噪比求得檢測限為0.007 U/mL。
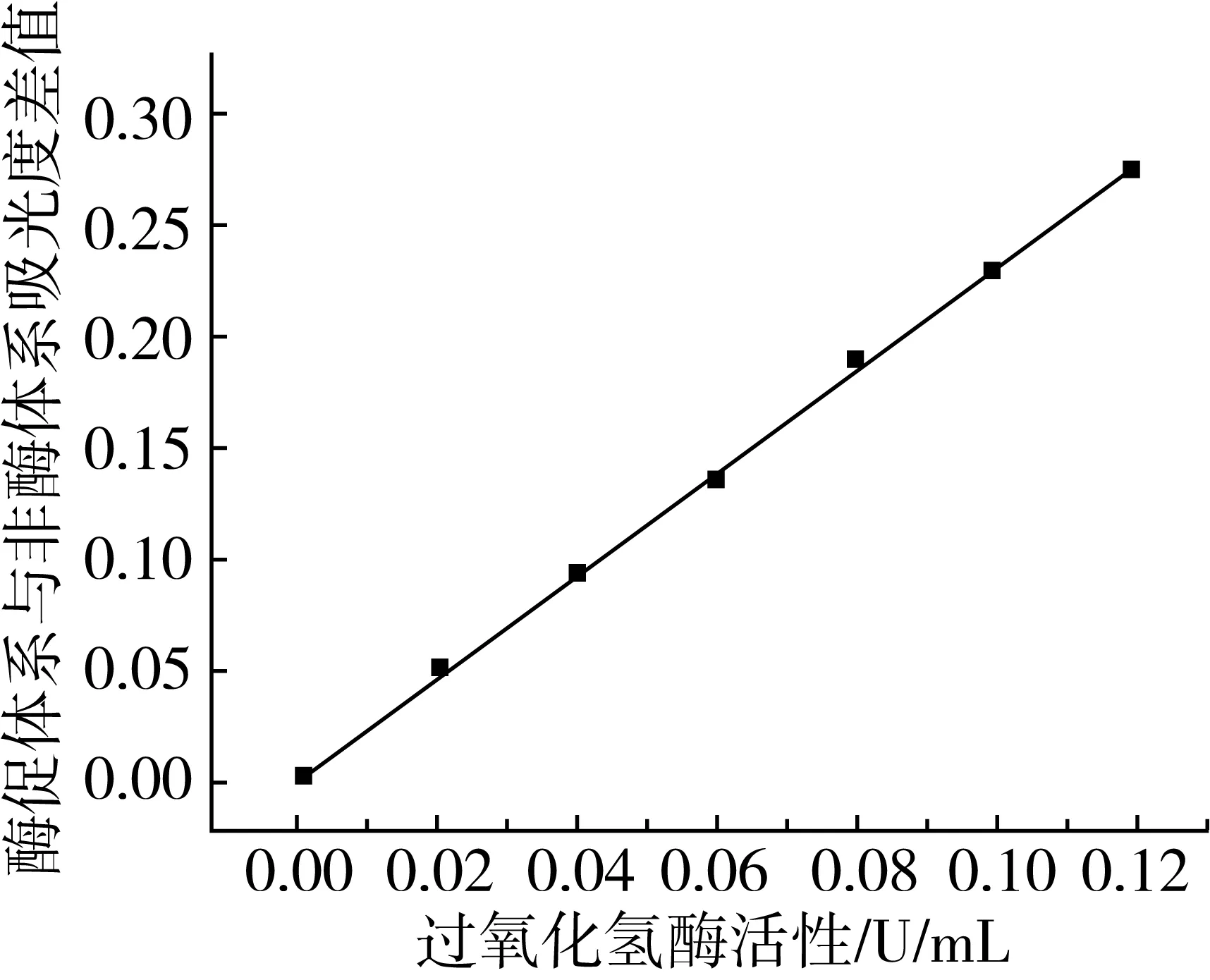
圖4 工作曲線
2.9 干擾實驗
取0.50 mL作測試液過氧化氫酶標準溶液作測試液,按照試驗方法考察生物組織共存還原性物質干擾情況。結果發現,濃度小于基底液1/2濃度的葡萄糖、果糖、維生素C、乳糖、半乳糖不影響ΔA測定,測量誤差小于1%。
2.10 大米樣品分析
大米樣品分析及回收率實驗結果見表1。
由表1可見2018年份的大米優于2017年份,其中,2018年份的成品寧夏長粒香米、寧夏普通大米、東北長粒香米、東北長粒大米酶含量依次為213.58、195.83、112.66、91.50 U/g。酶含量越多,保鮮度越高,因此,2018年份的長粒香米具有更高的性價比。該方法精密度檢驗RSD=2.09%~4.57%,加標回收率在96.01%~102.40%范圍內,說明粗酶液共存物質不影響酶活性測定。
用高錳酸鉀法和碘量法對寧夏長粒香米進行測定,并與甲基紅褪色光度法作比較,結果見表2。

表1 樣品分析及回收率實驗結果(n=6)
注:加標物來自購置品,經本法測得CAT活性后,作為已知活性的添加物。

表2 3種過氧化氫酶的測定方法比較 (n=6)
甲基紅褪色光度法、高錳酸鉀法和碘量法的標準偏差S分別為1.63、1.91和2.37,甲基紅褪色光度法與高錳酸鉀法合并標準偏差SR為1.78,t=1.49,查表得t0.05,10=2.228,即t 過氧化氫與甲基紅能夠發生褪色反應,褪色程度與酶活性有函數關系。在最佳條件下,最大吸收波長510 nm,甲基紅用量5 mL,過氧化氫用量4 mL,硫酸用量2 mL,褪色反應溫度及時間為40 ℃、60 min,CAT活性E與ΔA呈良好的線性關系:ΔA=0.001+2.276E(U/mL)。該方法可簡單、快速測定不同產地、不同年份大米的過氧化氫酶活性。3 結論

