非耐鹽乳酸菌與米曲霉共生釀造醬油的研究
孫莉,胡文康,黃瑤,付彩霞,李冬生,徐寧*
(1.湖北工業大學 生物工程與食品學院 湖北省食品發酵工程技術研究中心,武漢 430068; 2.湖北土老憨生態農業科技股份有限公司,湖北 宜昌 443000)
醬油最早起源于我國的周朝(公元前1046年-公元前256年)[1],又稱“清醬”或“醬汁”。目前傳統醬油以大豆、豆粕等為原料,以面粉、小麥等作為輔料,利用微生物的分解作用,主要是米曲霉、酵母菌和乳酸菌等產生豐富的酶系將原料水解成各種氨基酸、小分子肽、單糖、寡糖、有機酸,進而在一定的溫度、濕度條件下,發生一系列的生化反應,最終形成具有特殊色澤、滋味并帶有濃烈醬香味的醪液[2]。在兩大傳統發酵方式中,高鹽稀態發酵法改善了低鹽固態醬油所帶來的口感不佳的問題[3,4]。高鹽稀態發酵工藝結合了純菌種制曲和天然曬露發酵法的優點,所得成品醬油的醬香味濃郁,口感滋味佳。此類發酵產品深受消費者的青睞,是我國目前出口的醬油制品,在未來的醬油工藝發展過程中也將扮演不可或缺的角色[5,6]。
我國醬油釀造普遍采用單一菌種制曲,但由于發酵過程是半開放式,發酵體系實際上由多種微生物構成,參與的微生物種類繁多,發酵過程中微生物群落不斷地演替變化,最終完成大分子原料的降解、轉化、代謝等過程[7]。多菌種制曲是指在制曲階段選育多種微生物混合制曲,它可以彌補單一米曲霉制曲存在的原料利用率低、風味差等問題,對醬油產量和質量的提高具有重要意義。但各種微生物生長所需的原料、溫度、濕度、pH等條件存在差異,并且多種微生物之間的相互作用尚不明確,所以實際生產中尚未使用[8]。
因此,本研究通過在制曲過程中添加適量的非耐鹽的乳酸菌,模擬傳統醬油釀造的多微生物的群落制曲過程,研究制曲過程中乳酸菌與米曲霉共生生長對曲料酶系的影響以及后期醬油中各項生化指標的變化情況,以期為非耐鹽乳酸菌具體如何影響醬油的品質變化和現代化多菌種醬油的生產應用提供理論基礎。
1 材料和方法
1.1 菌種和材料
米曲霉3.042 HY-04、乳酸菌融合魏斯氏菌(Weissellaconfusa)HY-02:均保藏于湖北工業大學湖北省食品發酵工程技術研究中心;豆粕、炒小麥:由湖北土老憨生態農業科技股份有限公司提供。
1.2 醬油的制備
醬油曲制備的工藝路線,參照高鹽稀態醬油的發酵工藝流程[9]。具體的曲料配方為:豆粕加一定比例的水潤濕1.5~2 h左右,豆粕潤水后與炒小麥按照6∶4的比例混合均勻,于115 ℃高溫滅菌鍋滅菌20 min,放入無菌操作室冷卻至室溫。接種米曲霉種曲0.5%,乳酸菌1.0 mL/100 g(每1 mL菌液含有1.0×1010CFU個乳酸菌,對照組只接種米曲霉),隨后放入制曲室培養直至制曲結束,制曲溫度范圍為32~35 ℃。制曲時間為36~40 h,期間翻曲2次。將成熟曲料裝入發酵罐中,并注入其2倍質量的18%鹽水,置于35 ℃恒溫發酵箱中發酵4個月。
1.3 樣品的收集
收集16,20,24,28,32,36,40 h的成曲以及15,30,45,60,75,90,105,120 d醬醪發酵液樣品,密封,-20 ℃冰箱保存備用。
1.4 成曲中酶活力的測定
稱取2.0 g的成曲,用研磨研碎后裝入干凈的燒杯中,加入適量體積的緩沖液,于40 ℃水浴鍋浸提1~1.5 h,此過程中不時攪拌,之后用適宜pH的緩沖液稀釋定容,最后經濾紙過濾得粗酶液。
參照SB/T 10317-1999標準[10]中的方法測定曲料中的中性蛋白酶活力(pH 7.2的磷酸緩沖液)、酸性蛋白酶活力(pH 3.0的乳酸鈉緩沖液)。α-淀粉酶活力的測定參考Chutmanop J等的研究方法[11,12],取稀釋粗酶液與0.4%的淀粉溶液在40 ℃水浴鍋預熱 5 min,取酶液0.1 mL加入1 mL淀粉混合均勻于水浴40 ℃反應7.5 min(精確計時),加入1 mL碘(0.01 mol/L)混合均勻,加5 mL蒸餾水稀釋,測定其在660 nm處的吸光值。纖維素酶活力的測定參照Vatanparast等的研究方法[13,14],采用DNS法。果膠酶活力的測定參照Long L H等的研究方法[15,16],測定其在540 nm處的吸光度值。β-葡萄糖苷酶的測定參考Elghonemy D H等的研究方法[17,18],采用pNPG法。
1.5 制曲過程中乳酸菌的生長變化情況
乳酸菌的數量計算采用平板計數法,用滅菌生理鹽水稀釋至相應倍數,吸取適量菌液均勻涂布于倒有MRS培養基的平板中,于恒溫培養箱培養2~4 d,觀察并記錄乳酸菌菌落數。
1.6 醬油中pH的測定
取適量的醪液發酵液,用精密pH計測定。
1.7 醬油常規指標的測定
選用甲醛滴定法分析測定醬油中氨基酸態氮的含量。總氮含量的測定參考陳智慧等的研究中采用的凱氏定氮法并稍作修改[19]。參考國家標準GB/T 5009.39-2003[20],采用酸堿滴定法測定醬油中總酸的含量。還原糖含量的測定采用DNS比色法。
1.8 醬油中總黃酮和多酚類物質的測定
醬油中總黃酮含量的測定參照黃健蓉等的測定方法[21],采用比色法進行測定。總多酚含量的測定參照Hsiao W Y等的測定方法[22]。
1.9 醬油抗氧化能力的測定
DPPH自由基清除能力的測定參考Hsiao W Y等的試驗方法:稀釋醬油與DPPH乙醇溶液充分震蕩搖勻,室溫避光黑暗條件下靜置30 min,測定517 nm處的吸光值。亞鐵離子還原能力(FRAP)的測定參照Granato D等的研究方法[23]。預熱的稀釋樣品在37 ℃下與預熱的FRAP工作液反應4 min,測定593 nm處的吸光值。
1.10 有機酸的測定
從發酵罐中量取適量醬油樣品,濾紙過濾除去醬渣,用Amberlite IR120陽離子交換樹脂脫去鹽分,取適量脫鹽樣品,于冷凍高速離心機以10000 r/mim離心30 min,取上清液用微孔濾膜過濾。有機酸的測定參照Park Y C等的方法,采用液相色譜法[24]。
2 結果與討論
2.1 制曲過程中主要酶活力的變化
添加乳酸菌(魏斯氏菌)的實驗組與對照組在制曲過程中酶活動態變化情況見圖1。
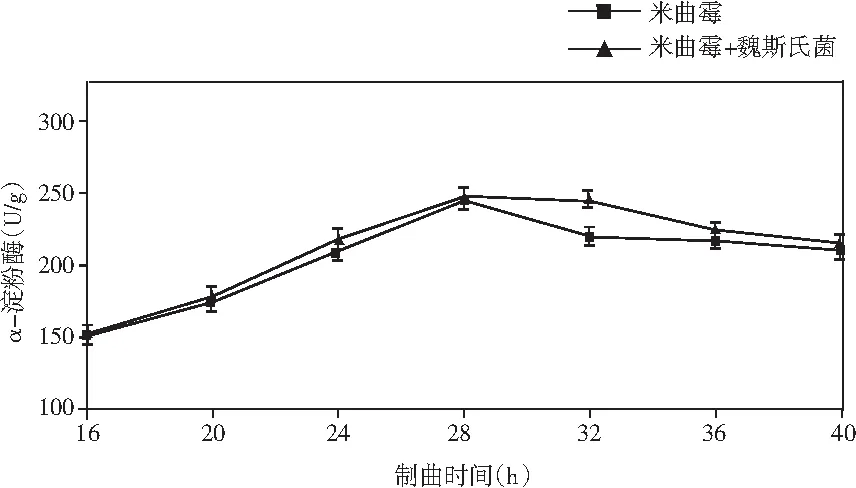
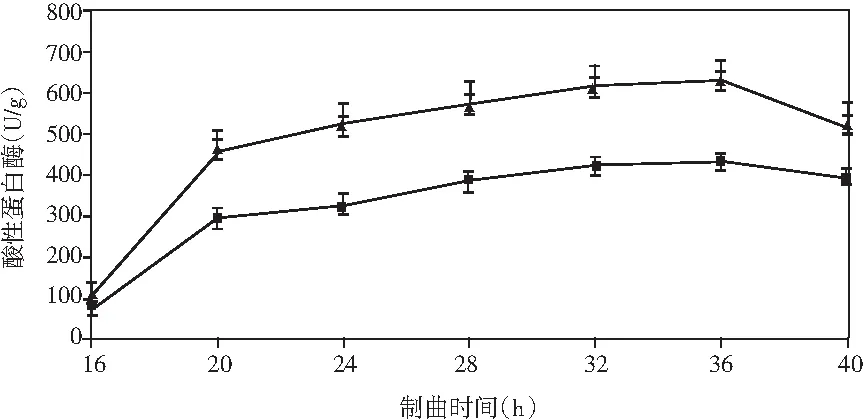
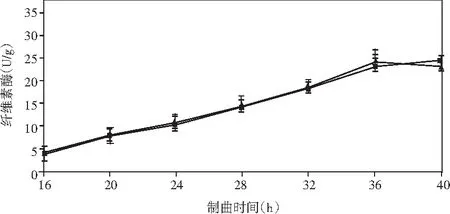
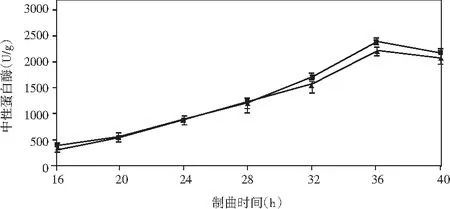
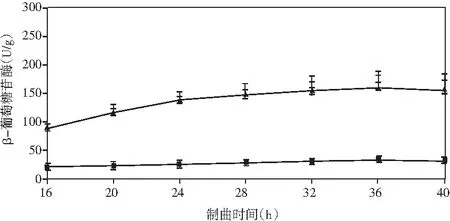

圖1 制曲過程中酶活變化情況Fig.1 The changes in enzyme activity during koji making
由圖1可知,在制曲36 h時,除α-淀粉酶外,其余各組酶酶活均達到最大值。實驗組與對照組相比,中性蛋白酶活力稍有下降,但不顯著;α-淀粉酶酶活力無明顯差異;酸性蛋白酶酶活力提高了47%;β-葡萄糖苷酶酶活力提高了460%(160.47 U/g);纖維素酶酶活力提高了18%(24.43 U/g);果膠酶酶活力提高了23%(38.53 U/g)。
結果表明,制曲過程中添加乳酸菌會增強成曲曲料整體蛋白酶酶系的活力。β-葡萄糖苷酶可以分解原料中糖苷型異黃酮成游離的苷元形式,其酶活的提高可以有效改善成品醬油中游離型異黃酮苷元的含量,從而提高醬油的抗氧化活性等保健功能。果膠酶可分解果膠為半乳糖醛酸,降低醬油的黏度,進而提高出油率[25]。
2.2 制曲過程中非耐鹽乳酸菌的生長情況
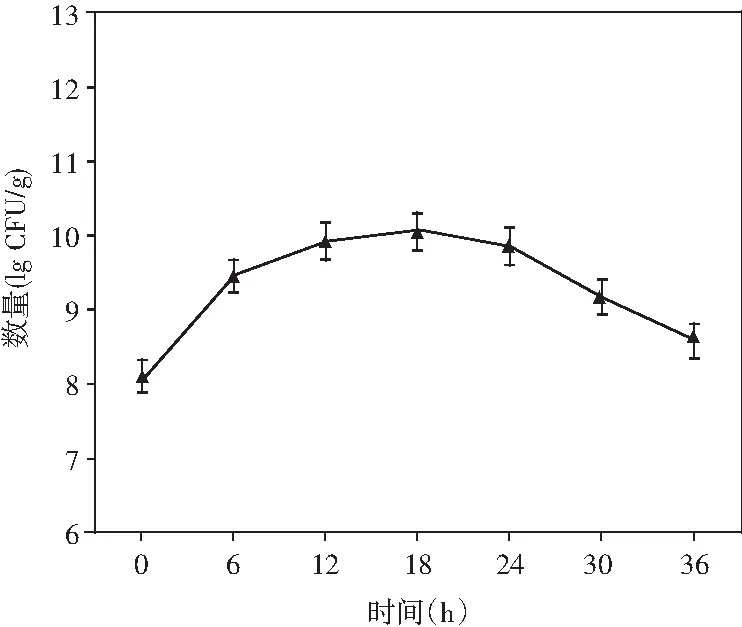
圖2 制曲過程中非耐鹽乳酸菌生長變化情況Fig.2 The changes in growth of non-salt-tolerant lactic acid bacteria during koji making
由圖2可知,非耐鹽乳酸菌在制曲過程中呈現出先增加后減少的趨勢,在制曲前12 h,乳酸菌呈現快速增長的趨勢,而后增長開始減緩,可能的原因是后期對于曲料的翻動,增加了整體的含氧量,稍微抑制了乳酸菌的生長。在最終制曲結束的36 h時,曲料存在乳酸菌數量為4.06×108CFU/g。
2.3 醬油發酵過程中pH的變化
醬油發酵過程中pH的變化見圖3。
添加乳酸菌制曲的醬油的pH在發酵過程中呈先下降并逐漸保持穩定的趨勢,在發酵的前20 d,pH下降速度較快,在60 d以后基本保持不變。在發酵的120 d時,米曲霉組的pH值維持在4.63左右;添加了乳酸菌的實驗組的pH值較米曲霉的pH值減少了4.7%(pH 4.41)。

圖3 醬油發酵過程中pH的變化Fig.3 Changes in pH values during soy sauce fermentation
2.4 醬油樣液發酵過程中理化指標的變化
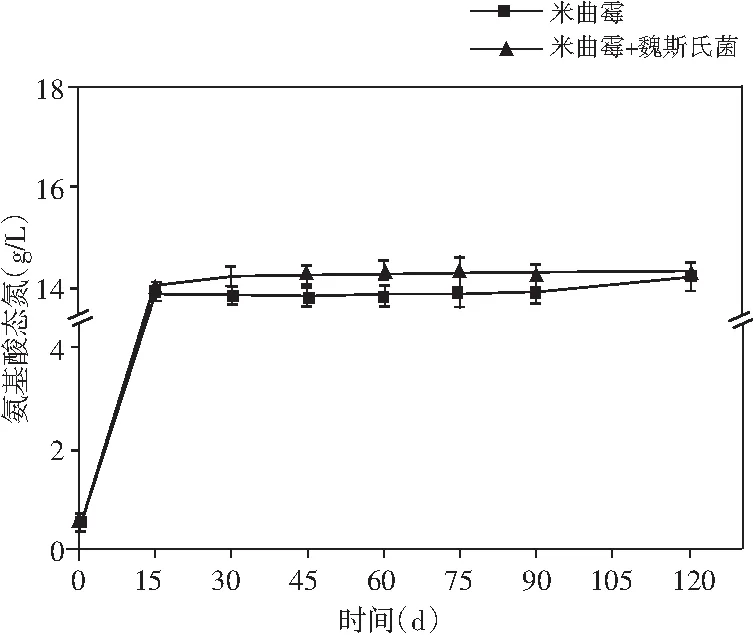
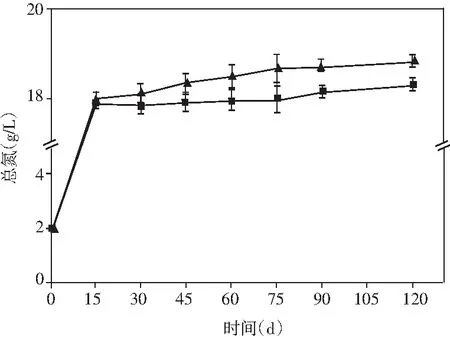

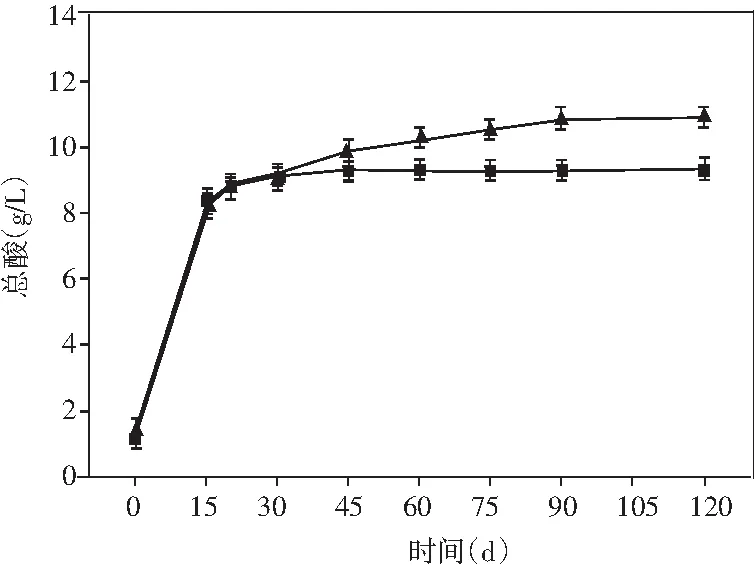
圖4 醬油發酵過程中氨基酸態氮、總氮、 還原糖和總酸含量的動態變化Fig.4 Dynamic changes of amino acid nitrogen, total nitrogen, reducing sugar and total acid content during soy sauce fermentation
醬油中的氨基酸態氮、總氮、還原糖和總酸的含量都有利于醬油產生特定風味物質[26]。研究了添加乳酸菌制曲的醬油在發酵過程中上述4種物質含量的動態變化。由圖4可知,氨基酸態氮、總氮和總酸的含量呈現先增加然后趨于平緩的趨勢。在發酵完成時,與米曲霉醬油相比,添加了非耐鹽乳酸菌的實驗組氨基酸態氮、總氮均有小幅度提升,總酸的含量提升最為顯著,提高了17.48%。醬油發酵過程中,在發酵的第60天,添加乳酸菌的實驗組還原糖的含量達到最大(79.93 g/L),而米曲霉組的還原糖含量卻在醬油發酵的第45天達到最大,最大值為65.42 g/L。還原糖含量在發酵的前期迅速增加,且實驗組增加的時間高于對照組,可能是在制曲過程中得到大量的淀粉酶,以及添加乳酸菌后,纖維素酶和果膠酶活力的提高,將原料中淀粉、果膠、纖維素類物質大量分解為還原糖,后期還原糖含量的減少可能是還原糖在醬油發酵的后期參與了美拉德反應[27]。上述結果表明:在制曲過程中添加乳酸菌可有效提高醬油的品質。
2.5 醬油發酵過程中多酚類物質和抗氧化能力的動態變化
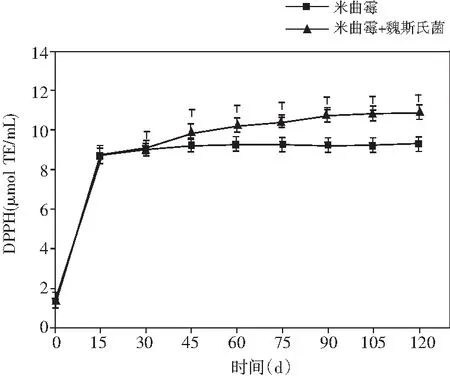
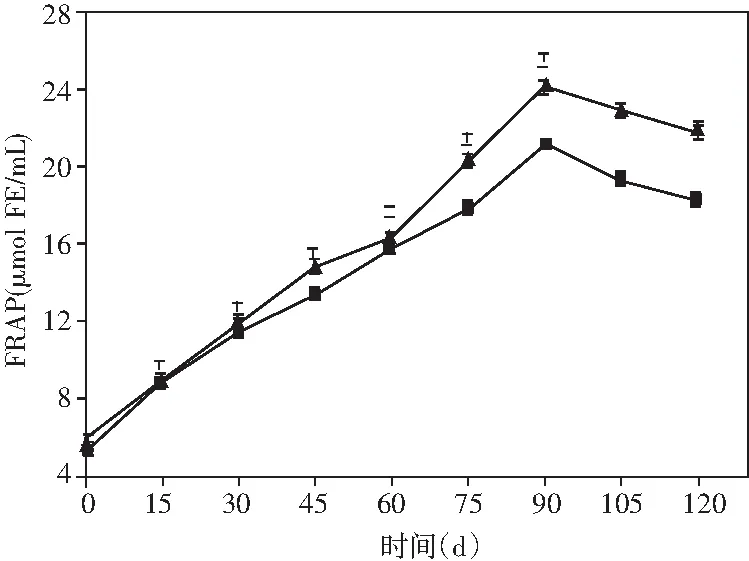

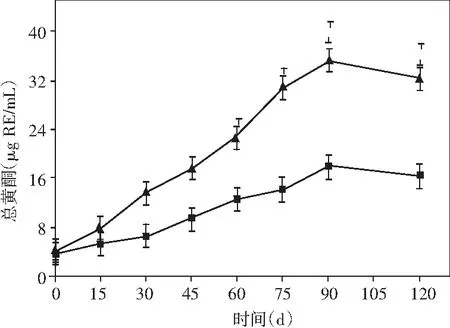
圖5 醬油發酵過程中多酚類物質和抗氧化能力的動態變化Fig.5 Dynamic changes of polyphenols and antioxidant ability during soy sauce fermentation
通過總多酚和總黃酮兩個指標在發酵過程中含量的變化來闡釋醬油發酵中酚類物質的動態變化情況,通過DPPH和FRAP兩個指標在發酵過程中含量的變化來闡釋醬油發酵中抗氧化能力的動態變化情況,見圖5。
由圖5可知,添加乳酸菌的醬油中總多酚、總黃酮含量的變化相似,在發酵階段呈現不斷增加的變化趨勢。在發酵第120天時,米曲霉組總多酚為530.65 μg GAE/mL,而添加乳酸菌組的樣液中總多酚含量則有大幅度提高,較對照組提高了1.21倍,其總多酚含量為640.34 μg GAE/mL。總多酚含量的提升,可能是由于添加了乳酸菌后,使得果膠酶和纖維素酶的活性提高,有研究表明[28],此類酶會破壞酚-肽復合物,促使結合型酚類物質的釋放。故添加乳酸菌可增加醬油中酚類物質的含量,從而改善醬油的功能活性。但總黃酮在發酵的第90天時,含量已經達到最大值35.21 μg RE/mL,而米曲霉組為17.89 μg RE/mL;在發酵結束的第120天時,添加乳酸菌組醪液中的總黃酮含量較米曲霉組提高了1.97倍。這說明添加了乳酸菌的雙菌種釀造醬油可以提高醬油中總黃酮的含量。
醬油中DPPH自由基清除能力變化表現出不斷上升的趨勢,且前15 d增速較快,隨后平穩增長。在發酵結束的第120天,米曲霉組的DPPH為9.27 μmol TE/mL,添加乳酸菌組醬油樣液中DPPH自由基清除能力比米曲霉組提高了17.48%。
與DPPH不同,醬油釀造過程中的FRAP值則呈現出先增加后減少的趨勢。在發酵后期,添加乳酸菌組醬油的FRAP值比米曲霉組提高了19.36%(21.89 μmol FE/mL)。所以,本研究的結果表明添加非耐鹽乳酸菌與米曲霉共同制曲可以顯著提高醬油的抗氧化能力。
2.6 醬油有機酸的含量分析
添加乳酸菌的醬油發酵中有機酸變化結果見表1。醬油中主要含有酒石酸、乳酸、乙酸、琥珀酸、檸檬酸和蘋果酸6種有機酸。在醬油發酵過程中,乳酸和乙酸的含量表現出隨時間增加而持續增加的趨勢,而另外4種酸則呈先增加后減少的趨勢。在發酵第120天,乳酸菌組與米曲霉組有機酸含量差異較小,在10%左右,說明非耐鹽的乳酸菌在高鹽的發酵階段并未充分生長。

表1 醬油中主要有機酸的含量變化情況Table 1 Changes in the content of major organic acids in soy sauce
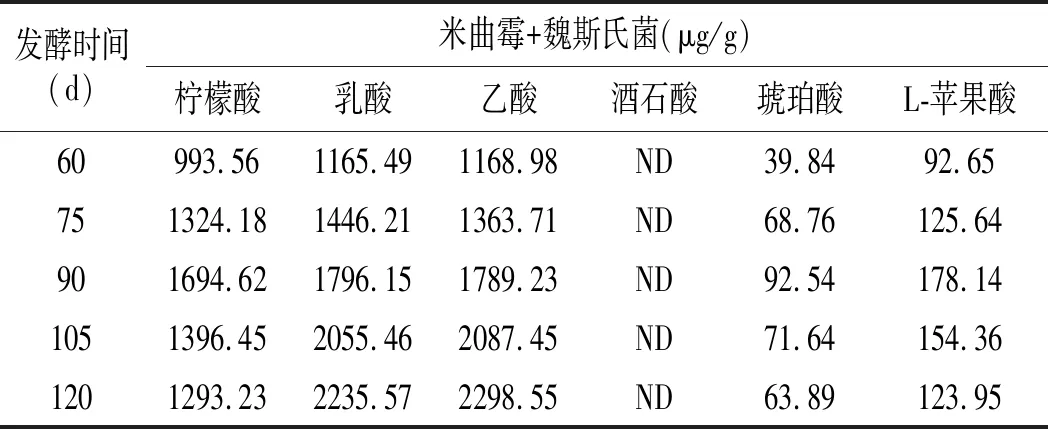
續 表
3 總結
制曲過程中酶系的豐富程度以及酶活力的大小直接決定后期醬油發酵過程中質量指標的好壞,最終影響醬油的品質。而以上結果均表明非耐鹽乳酸菌和米曲霉共生制曲可有效改善酶系的豐富程度及活力大小。
在制曲過程中添加非耐鹽乳酸菌后的醬油,不僅提高了醬油中酚類物質的含量及增強醬油的抗氧化活性,還增加了風味物質的種類和含量以及總游離氨基酸的含量,顯著改善了醬油的風味。

