乳酸菌制劑對環(huán)磷酰胺致大鼠免疫抑制的調(diào)節(jié)作用
張振忠 ,岳壽松,陳 靚,滕素玲,孫培錄,王 燕,李 軍 *
(1.濟南大學 山東省醫(yī)學科學院 醫(yī)學與生命科學學院,山東 濟南 250200;2.山東第一醫(yī)科大學 山東省醫(yī)學科學院 藥物研究所,山東 濟南 250062;3.山東省農(nóng)業(yè)科學院 生物技術研究中心,山東 濟南 250100;4.國家衛(wèi)生部生物技術藥物重點實驗室,山東省罕少見病重點實驗室,山東 濟南 250062)
環(huán)磷酰胺(cyclophosphamide,CTX)是最常用的烷化劑類抗腫瘤藥物之一[1],同多種化療藥物一樣在殺傷腫瘤細胞的同時還對患者產(chǎn)生毒副作用尤其是對免疫系統(tǒng)產(chǎn)生抑制,這是困擾其在腫瘤化療中應用的難題[2]。探尋改善化療藥物的毒副作用、提高機體免疫措施一直是人們關注的重點。乳酸菌作為公認的益生菌,已在食品及醫(yī)藥行業(yè)中廣泛應用,已有研究顯示其可調(diào)節(jié)機體免疫系統(tǒng),進一步提高機體抗腫瘤能力[3]。因此深入研究乳酸菌對免疫活性的影響具有重要臨床意義。本研究選用3種乳酸菌菌株配比形成的復合制劑,研究其對環(huán)磷酰胺所致免疫低下大鼠模型的免疫調(diào)節(jié)作用,以期為腫瘤化療探尋新的輔助干預措施。
1 儀器與材料
1.1 儀器
YP3001N型電子天平(上海精密科學儀器有限公司);SL3001N型電子天平(上海民橋精密科學儀器有限公司);LDZ5-2低速自動平衡離心機(北京京立離心機有限公司);J-25型高速冷凍離心機(美國Beckman公司);XT-2000iv自動血球分析儀(日本希森美康東亞株式會社);Infinite M200 PRO全波長酶標儀(法國TECAN公司);BD FACSCalibur流式細胞儀(美國BD公司);CFX96 Touch熒光定量PCR儀(美國伯樂公司)。
1.2 試劑
乳酸菌制劑由山東省農(nóng)業(yè)科學院生物技術研究中心微生物研究室制備。將嗜酸乳桿菌(Lactobacillus acidophilus)SD65、干酪乳桿菌(Lactobacillus casei)SD07和植物乳桿菌(Lactobacillus plantarum)SD02分別活化、液體培養(yǎng),收集菌體,生理鹽水懸浮菌體成109CFU/ml,等比例混合制得;注射用環(huán)磷酰胺(CTX,江蘇盛迪醫(yī)藥有限公司,規(guī)格:0.2 g/支);血液學質(zhì)控品(Sysmex Corporation);血液學檢測試劑盒[Sysmex Corporation及希森美康生物科技(無錫)有限公司];流式細胞檢測CD4、CD8抗體(Ebioscience公司生產(chǎn));SYBR GreenqPCR Master mix(日本TOYOBO公司);TRIzol?試劑(Thermo Fisher Scientific);cDNA反轉錄試劑盒(Thermo Fisher Scientific)。
1.3 實驗動物
Sprague-Dawley(SD)大鼠,SPF級,雄性,體重260~316 g,購自濟南朋悅實驗動物繁育有限公司,實驗動物生產(chǎn)許可證號:SCXK(魯)2014 0007。動物飼養(yǎng)于山東省醫(yī)學科學院藥物研究所普通動物房。實驗動物使用許可證號:SYXK(魯)2017 0003。試驗方案通過山東省醫(yī)學科學院藥物研究所實驗動物倫理委員會同意。
2 方法
2.1 實驗動物的分組與給藥
雄性SD大鼠50只,隨機分為正常對照組、模型組、乳酸菌制劑1.25,2.5,5 ml/kg 3個劑量組,每組10只。除正常對照組外,各組動物于第1,5,8,15,22天腹腔注射10 mg/ml的CTX,給藥體積4 ml/kg;正常對照組注射等體積生理鹽水。同時從第1天開始,乳酸菌制劑組灌胃給予乳酸菌制劑原液1.25,2.5,5.0 ml/kg,模型組和正常對照組給予等容積的動物飲用水,灌胃前分別以動物飲用水補足5.0 ml/kg。
2.2 指標檢測
2.2.1 動物體重測量 分別于動物開始給藥后每隔1周左右稱量體重。試驗結束剖檢稱量動物臟器重、計算臟器系數(shù)。
2.2.2 血常規(guī)指標檢測 動物禁食不禁水12~15 h,采抗凝血,測定白細胞計數(shù)、中性粒細胞比率和淋巴細胞比率。
2.2.3 淋巴細胞亞群檢測 取抗凝全血100 μl,流式細胞儀檢測淋巴細胞亞群。
2.2.4 血清白介素6(IL-6)和腫瘤壞死因子α(TNF-α)水平檢測 取血清,酶聯(lián)免疫法檢測IL-6和TNF-α水平。
2.2.5 脾臟IL-2、IL-6及TNF-α基因表達水平檢測摘取脾臟液氮凍存,采用TRIzol?試劑提取總RNA,采用逆轉錄實時定量PCR檢測脾臟IL-2、IL-6以及TNF-α基因表達水平,實驗所需各基因的引物序列見表1。
2.3 統(tǒng)計學分析
采用SPSS 22.0對實驗結果進行單因素方差分析,數(shù)據(jù)均以平均值±標差(±s)表示。
3 結果與分析
3.1 乳酸菌制劑對大鼠生長的影響
CTX模型組大鼠在灌胃給藥的第7天~藥后27天,動物體重增重緩慢,體重顯著低于正常對照組(P<0.01或P<0.05)。乳酸菌制劑干預后第7天~藥后27天動物體重高于CTX模型組(P<0.01或P<0.05),且作用呈劑量相關性。結果見表2。

表1 實時定量PCR檢測基因的引物序列
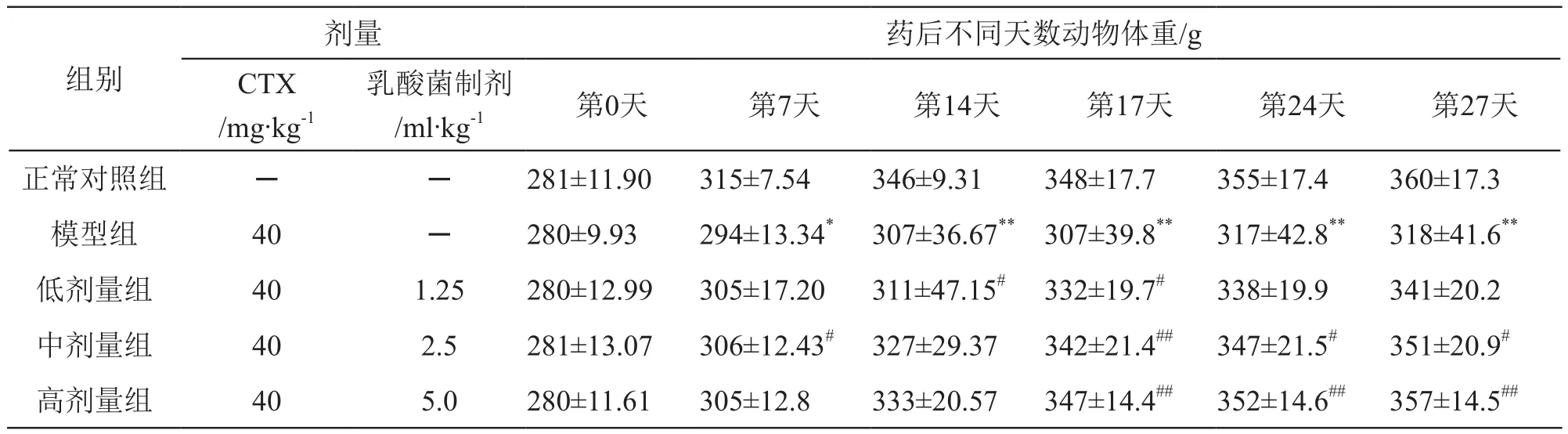
表2 乳酸菌制劑對大鼠體重增長的影響(n=10)
3.2 乳酸菌制劑對大鼠胸腺和脾臟系數(shù)的影響
結果見表3。由表3可見,CTX模型組大鼠的胸腺指數(shù)顯著低于正常對照組,差異有統(tǒng)計學意義(P<0.01),表明CTX有較強的免疫抑制毒性。乳酸菌制劑5 ml/kg組大鼠胸腺指數(shù)高于模型組,差異有統(tǒng)計學意義(P<0.05)。乳酸菌制劑2.5,5 ml/kg組大鼠脾臟指數(shù)高于模型對照組,差異有高度統(tǒng)計學意義(P<0.01)。
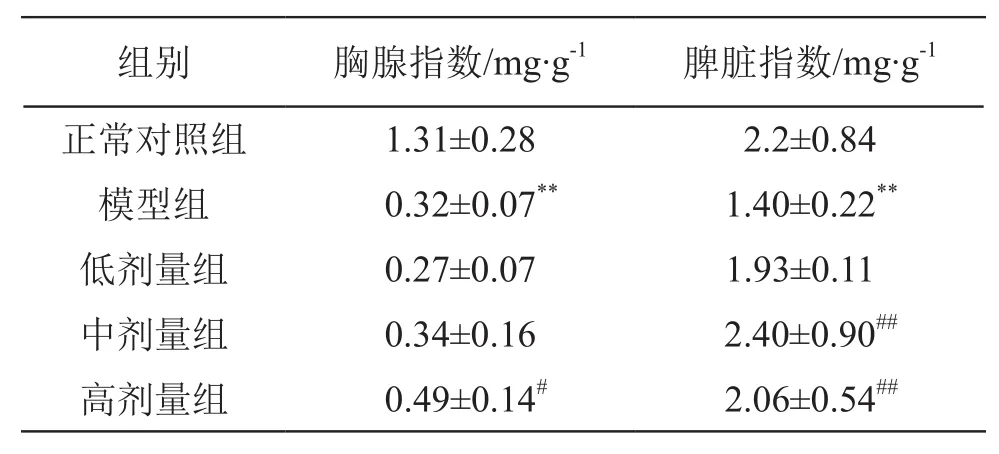
表3 乳酸菌制劑對胸腺和脾臟指數(shù)的影響(n=10)
3.3 乳酸菌制劑對大鼠部分免疫細胞的影響
結果見表4。由表4可見,CTX模型組大鼠的白細胞數(shù)目、淋巴細胞數(shù)目均低于正常對照組,差異有高度統(tǒng)計學意義(P<0.01)。乳酸菌制劑高劑量組白細胞數(shù)目高于模型組,差異有統(tǒng)計學意義(P<0.05);乳酸菌制劑低、中、高劑量組CD4/CD8均高于模型組,差異有統(tǒng)計學意義(P<0.05或P<0.01)。
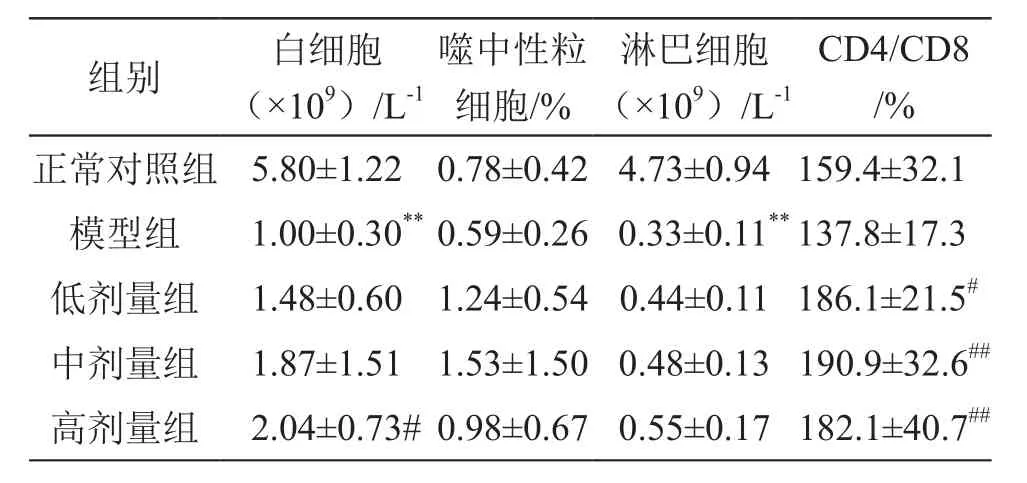
表4 乳酸菌制劑對大鼠部分固有免疫細胞及CD4/CD8的影響(n=10)
3.4 乳酸菌制劑對大鼠血清IL-6、TNF-α含量的影響
結果見表5。由表5可見,模型組大鼠血清IL-6含量低于正常對照組(P<0.05),TNF-α含量高于正常對照組(P<0.05或P<0.01)。乳酸菌制劑2.5,5.0 ml/kg劑量組血清IL-6含量顯著高于模型組(P<0.05);乳酸菌制劑1.25,2.5,5.0 ml/kg劑量組血清TNF-α含量顯著低于模型組(P<0.05或P<0.01)。
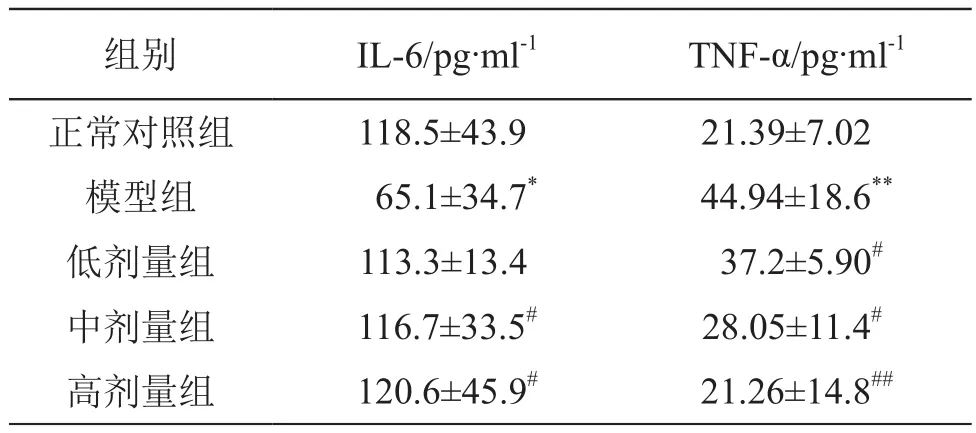
表5 乳酸菌制劑對大鼠血清IL-6、TNF-α含量(n=10)
3.5 乳酸菌制劑對大鼠IL-2、IL-6以及TNF-α基因表達的影響
實時定量PCR檢測大鼠脾臟相關基因的表達結果見圖1。模型組大鼠的IL-2和IL-6的表達水平顯著低于正常對照組(P<0.05),模型組的TNF-α表達水平顯著高于正常對照組(P<0.01)。乳酸菌制劑2.5,5.0 ml/kg干預組IL-2基因表達水平高于模型組(P<0.05),2.5 ml/kg干預組IL-6基因表達水平高于模型組(P<0.05),作用呈劑量依賴性。乳酸菌制劑高劑量組的TNF-α基因表達水平顯著低于模型組,差異有統(tǒng)計學意義(P<0.05)。
4 討論
CTX作為抗腫瘤藥物,主要用于惡性淋巴瘤、多發(fā)性骨髓瘤、白血病、乳腺癌等的治療[1,4-5]。它代謝生成的丙烯醛可產(chǎn)生膀胱炎、血尿等一系列尿毒性癥狀[6]。CTX還能殺傷免疫細胞,進而影響免疫的各階段,嚴重干擾人的正常免疫功能。本實驗參考文獻[2]方法并略作改進,大鼠腹腔注射40 mg/kg CTX 5次后,大鼠的體重增長顯著滯后于正常對照組、免疫器官萎縮變小,免疫細胞數(shù)量減少,刺激免疫應答的IL-2、IL-6含量降低,損傷相關因子TNF-α的含量顯著增加。由此可見應用CTX腹腔注射大鼠可對動物產(chǎn)生較全面的毒性作用,特別是造成大鼠免疫功能低下的狀態(tài)。此模型可用于觀察不同劑量的乳酸菌制劑對大鼠損傷及免疫功能的影響。
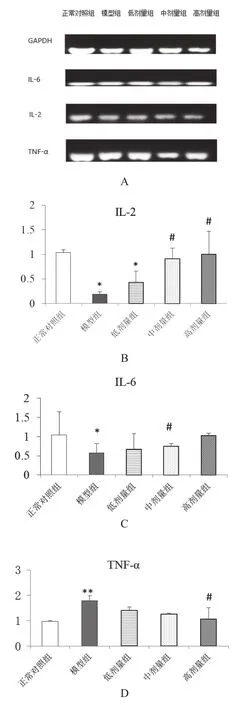
圖1 乳酸菌制劑對大鼠IL-2、IL-6及TNF-α基因表達的影響
免疫系統(tǒng)由免疫器官、免疫細胞和免疫活性物質(zhì)組成,機體免疫應答可分為固有性免疫(先天性免疫或非特異性免疫)和適應性免疫(獲得性免疫或特異性免疫)兩大類,執(zhí)行機體免疫監(jiān)視、防御、調(diào)控等功能。機體紊亂或者環(huán)境、藥物、治療等引起的免疫系統(tǒng)任一方面異常都可能引起免疫功能的障礙[7]。腫瘤發(fā)生過程的初期免疫機能失衡,同時又由于化療過程中化療藥物對免疫系統(tǒng)的損傷,進一步影響機體的免疫機能,降低了機體對腫瘤的自我抵抗能力。已有研究顯示乳酸菌可調(diào)節(jié)機體免疫系統(tǒng),提高機體抗腫瘤能力[3]。篩選化療損傷狀態(tài)下提高人休免疫活性的乳酸菌菌株,研究乳酸菌對CTX等化療藥物損傷免疫應答不同時期干預作用的效果及機制有重要的臨床意義。
本研究以3種乳酸菌制得的口服制劑為研究對象,研究其對機體的免疫調(diào)節(jié)作用。研究結果表明乳酸菌復合制劑可明顯提高CTX所致免疫低下大鼠的免疫功能,有望在臨床上應用于化療免疫低下病人的輔助治療。

