腎透明細胞癌中X染色體生殖同源盆基因F1(Rhox F1)表達及其甲基化狀態研究
程 歡,趙 浩,吳建強,李 望,王軍起 (徐州醫科大學附屬醫院泌尿外科,江蘇 徐州 221000)
葉酸是人體內主要的甲基基團供體,亞甲基四氫葉酸還原酶(methylenetetrahydrofolate reductase,MTHFR)是葉酸代謝途徑的關鍵酶之一,其催化作用決定了DNA甲基化與DNA合成之間的平衡。MTHFR基因呈多態性,其中以位于催化區的677(C→T)轉換最為常見[1],此種基因轉換通過破壞總基因DNA甲基化、DNA合成與修復障礙而發揮致癌作用[2]。近年來有研究發現同源異型域轉錄因子在正常個體發育過程中發揮非常重要的作用,但一些同源異型域轉錄蛋白參與腫瘤的始動和轉移過程[3],如X染色體生殖同源盒基因家族(reproductive homeobox on X-chromosome,Rhox)。研究發現DNA甲基化使Rhox家族種系特異性基因處于沉默狀態保證了正常的大鼠胚胎形成[4]。而人類的X染色體生殖同源盒基因F1(Rhox F1)在腫瘤細胞株中表達異常增高,而在正常組織如睪丸中該基因則處于不表達狀態[5]。因此,本研究分析在腎癌中MTHFR基因多態性對Rhox F1的甲基化狀態及其mRNA表達的影響,以期進一步闡明腎癌發生、發展的分子機制。
1 資料與方法
1.1材料:收集2010年3月~2010年9月徐州醫科大學附屬醫院泌尿外科手術切除且均經病理證實為透明細胞癌的新鮮腎癌組織38例,并取相應的癌旁正常腎臟組織標本作為正常對照組,切除后立即置液氮凍存,所有患者術前均未接受過放化療,均有詳細的臨床資料和手術記錄,此項研究已通過徐州醫科大學附屬醫院倫理委員會同意并取得受試對象的知情同意。
1.2方法
1.2.1Rhox F1基因的表達情況: 按總RNA提取試劑盒(Trizol)的操作說明分別提取不同來源組織的RNA。在提取的總RNA中取10 μg按反轉錄試劑盒說明以50 μl體系反轉錄成cDNA,實時PCR采用定量PCR中的相對定量法,以GAPDH作為內參照,同時以外周正常組織為基準,癌區組織RNA的SFRP 1基因(x)表達量均表達成外周正常組織的N倍(即Nx)。用于PCR擴增的SFRP 1特異性引物序列為正向:5′-GTGCGGGTTTGGTTTAAGAA-3′,反向:5′-CCAGAAAAACCCATCTCCAA-3′;內參照GAPDH引物序列為正向:5′-CCCTTCATTGACCTCAACTACATGG-3′,反向:5′-CCTGCTTCACCACCTTCTTGATGTC-3′。每次定量反應后產物都經30 g/L瓊脂糖電泳證明為所需擴增的片段。通常情況下,正常組織Nx位于0.3~3.0之間,Nx≥3.0為陽性表達,而<0.3為陰性表達。反應條件94℃ 5 min,92℃ 15 s,60℃ 1 min,40個循環,每次反應均設3復孔,CT值取其均值。Nx=2-△△Ct。△△Ct=△Ct樣品-△Ct基準=(Ct樣品x﹣Ct樣品GAPDH)-(Ct基準x-Ct基準GAPDH)。內參基因序列為TTTTAGGTGTGAAGAGGTGAGTTAGA。
1.2.2Rhox F1基因啟動子甲基化分析:符合后續實驗要求樣本DNA中取5~12 μl,按EZ DNA Methylation Gold Kit甲基化修飾試劑盒(美國ZYMO公司)說明書進行甲基化修飾,修飾完成并純化的DNA經10 μl的M-Elution Buffer洗脫后立即進行分析。甲基化特異性PCR(MSP)引物序列正向:5′-GTGAAGTGGTTTTAGTGTTTATATT-3′,反向:5′-CTCAAAAACTACCCTCCACC-3′。反應條件:94 ℃預變性5 min,94 ℃變性30 s,57 ℃退火30 s,72 ℃延伸45 s,共35個循環,72 ℃再延伸5 min。PCR產物采用20 g/L瓊脂糖電泳,生物電泳圖像系統分析結果。
1.2.3MTHFR基因型檢測: 將MTHFR PCR擴增產物理想的樣品進行限制性片段長度多態性聚合酶鏈反應(PCR-RFLP)技術分析。限制性核酸內切酶Hinf Ⅰ特異識別GAGTC酶切位點,當677位點C→T顛換后,會產生1個Hinf Ⅰ酶切位點取PCR擴增產物,PCR反應體系為25 μl,10×Buffer 2.5 μl,引物終濃度0.2 μmol/L,Taq DNA聚合酶1 U,模板2 μl。擴增條件為:95℃預變性5 min,然后進行35個循環(每個循環包括94℃ 1 min,60.5℃ 1 min,72℃ 1 min),最后72 ℃延伸8 min。選用PCR擴增產物測序確定是MTHFR 677位基因陽性的腎癌標本作為陽性對照,以高壓雙蒸水代替DNA模板作為空白對照。PCR產物由上海基康生物技術公司純化并測序。每個酶切體系的體積為20 μl,上述反應體系置于37 ℃水浴5~8 h酶切消化,取酶切產物5 μl,20 g/L瓊脂糖凝膠電泳,凝膠成像圖像分析儀觀察結果。
1.3統計學處理:采用SAS 6.12統計軟件包進行統計處理。計數資料用率(%)表示,兩樣本率比較用χ2檢驗或Fisher確切概率法。通過方差檢驗比較腎癌組織TT、CT和CC基因型mRNA的表達,再通過Dunnett-t法進行兩兩比較。檢驗水準α=0.05,以P<0.05為差異有統計學意義。
2 結果
2.1Rhox F1 mRNA的表達:正常組織中,14例Rhox F1基因mRNA陽性表達(36.8%);腎癌組中34例Rhox F1基因mRNA陽性表達(89.5%)。兩組間Rhox F1的mRNA陽性表達差異有統計學意義(χ2=22.619;P<0.001)。Rhox F1 mRNA的表達情況見圖1。
2.2Rhox F1啟動子甲基化狀態分析:在正常組,30例Rhox F1啟動子甲基化呈陽性;在腎癌組僅有7例甲基化陽性,正常組織中Rhox F1啟動子CpG島甲基化率(78.9%)顯著高于腎癌組織(18.4%),差異有統計學意義(χ2=27.861,P<0.001)。見圖2。
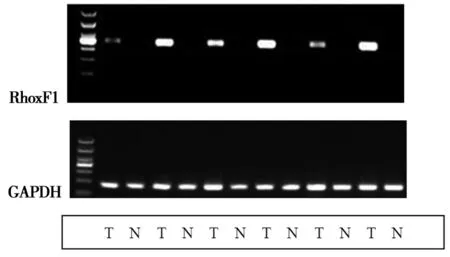
注:Rhox F1為X染色體生殖同源盒基因F1;T為腎癌組織;N為正常組織

注:Rhox F1為X染色體生殖同源盒基因F1;M為甲基化;U為去甲基化
2.3腎癌中Rhox F1啟動子甲基化率與其mRNA表達的關系:34例表達Rhox F1 mRNA的癌組織中有30例發生去甲基化,發生率高達88.2%(30/34),在4例Rhox F1 mRNA表達缺失的癌組織中1例發生去甲基化,發生率為25.0%(1/4)。Rhox F1 mRNA陽性患者的Rhox F1啟動子較Rhox F1 mRNA陰性患者去甲基化率高,差異有統計學意義(P=0.015)。表明Rhox F1 mRNA陽性表達患者,其啟動子更容易去甲基化。
2.4MTHFR 677(C→T)基因多態性:34例Rhox F1 mRNA 陽性表達的腎癌組織[MTHFR 677(C→T)]中TT基因型患者25例,CT基因型5例,CC基因型4例。TT、CT、CC基因Rhox F1 mRNA表達水平差異具有統計學意義(F=80.201,P<0.001),其中TT基因Rhox F1 mRNA表達水平(0.91±0.01)顯著高于CT基因型(0.33±0.03)和CC基因型(0.26±0.03),差異均有統計學意義(均P<0.001);CT與CC基因型組間Rhox F1 mRNA表達水平差異無統計學意義(P>0.05),見圖3。TT基因型中有24例Rhox F1啟動子去甲基化(96.0%),CT基因型有2例(40.0%),CC基因型有1例(25.0%)。TT、CT、CC三組基因Rhox F1啟動子去甲基化率差異具有統計學意義(P<0.001),其中TT基因Rhox F1啟動子去甲基化率顯著高于CT基因型和CC基因型(P=0.009,P=0.004)。CT與CC基因型組間Rhox F1啟動子去甲基化率差異無統計學意義(P=0.595)。
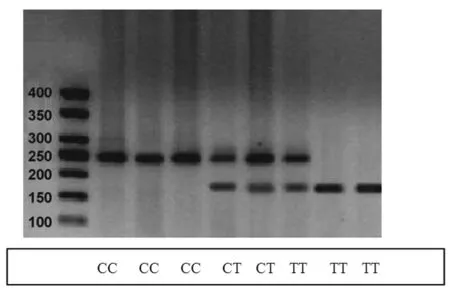
注:MTHFR為亞甲基四氫葉酸還原酶;CC、CT、TT為基因型
3 討論
腎癌是泌尿系統最常見的惡性腫瘤之一,其發生、發展涉及眾多原癌基因和抑癌基因的協同作用。近年來的研究結果顯示,DNA甲基化廣泛存在于各種惡性腫瘤,包括泌尿系統腫瘤[6]。在對大鼠的研究中,Rhox家族中超過30種功能性基因已被證實,其中大多數集中于Rhox 5[7],最新研究表明異常的Rhox 5表達可干擾神經生長因子-1受體基因Unc5c的轉錄[8],而Unc5c在結腸癌的發病過程中扮演著抑癌基因的角色[9]。由于Rhox家族基因存在同源性,可見其他功能性基因可能存在著與Rhox 5相同或者相似的生物學致癌作用,其表達水平的調節機制顯得尤為重要。盡管如此,目前對主要存在于人類中的Rhox家族成員Rhox F1、Rhox F2和Rhox F2B的研究甚少,它們在人類癌癥中的表達水平及其甲基化是否參與調節機制尚不明了。本研究結果顯示,在腎透明細胞癌組織中Rhox F1 mRNA表達水平明顯高于正常組織,癌組織中Rhox F1啟動子去甲基化率明顯高于正常組織,二者關系分析提示Rhox F1 mRNA表達水平異常增高可能是腎透明細胞癌發生與進展的機制之一,而Rhox F1 mRNA高水平表達可能是通過其啟動子區域去甲基化來實現的。
在甲基化過程中,葉酸是主要的甲基基團供體,葉酸缺乏或代謝障礙與許多腫瘤的發病風險增高相關[10]。而MTHFR C677T能夠不可逆地催化5,10-亞甲基四氫葉酸轉變為5-甲基四氫葉酸,它通過合成S-腺苷基甲硫氨酸(SAM)而參與多種甲基化過程,可使變異體酶對熱不穩定且活性顯著降低,影響酶的活性,TT純合基因型的酶活性僅為CC野生型的30%[11],而酶活性的降低改變了SAM水平,從而導致DNA去甲基化或低甲基化,增加了染色體的不穩定性。目前已有研究發現葉酸攝入和MTHFR基因多態性與部分腫瘤相關基因甲基化紊亂有關。本研究結果顯示腎癌組織中攜帶677 TT的患者Rhox F1啟動子去甲基化率和mRNA表達明顯高于CT和CC基因型,可能機制為MTHFR 677 TT基因型個體中MTHFR的酶活性較其他兩種基因型低,減少了同型半胱氨酸向甲硫氨酸的轉變,使SAM水平異常下降,導致了Rhox F1啟動子區域去甲基化,異常激活Rhox F1過量表達,干擾抑癌基因的轉錄,打破了某些原癌基因與抑癌基因的平衡關系,最終導致腫瘤的發生。
腎癌的發生及發展是一個多階段的復雜病變過程,位點特異的DNA甲基化調控基因的表達極其重要[12]。由于去甲基化異常激活及表達,影響了某些抑癌基因的轉錄合成,直接導致腎癌的發生;而葉酸代謝酶MTHFR 677 TT多態性可影響Rhox F1啟動子的甲基化和核酸的穩定性,從而間接參與腫瘤的形成[13]。但由于樣本數量有限,本研究未能進一步探究其余兩種Rhox基因與MTHFR多態性的關系,但從這次實驗中可看出一定趨勢,即MTHFR多態性通過影響部分Rhox基因啟動子區域甲基化狀態而調控其表達。因此,大樣本的實驗有待開展,進一步驗證本研究結果,深入了解腎癌發生、發展的分子機制,可為個體化的臨床輔助診斷、病程監控和治療提供新的理論參考依據。

