SSR 與SRAP 分子標記在烤后煙葉中的應用及烤煙遺傳多樣性分析
軒貝貝,胡利偉,田陽陽,過偉民,郭建華,劉 魁,王正旭,田欒欒,趙艷珍,孟祥宇,余 涵,張艷玲*
1. 中國煙草總公司鄭州煙草研究院,鄭州高新技術產業開發區楓楊街2 號 450001 2. 紅塔煙草(集團)有限責任公司,云南省玉溪市紅塔大道118 號 653100
煙葉烘烤是烤煙生產中的一個重要環節。烘烤期間煙葉外觀以及內部化學組成均發生了較大變化,除煙葉中的淀粉、蛋白質等大分子物質會隨烘烤時間延長發生不同程度降解外[1-2],煙葉基因組DNA 也會隨烘烤進程而發生變化。目前國內外對煙葉在烘烤過程中基因組DNA 的變化情況研究較少。郭兆奎等[3]對適于PCR 分析的烤后煙葉DNA 提取方法進行了試驗,認為高溫烘烤條件下煙葉DNA 會發生嚴重降解,且對后續PCR 反應造成較大影響。在自然條件下,植物葉片離體后DNA 在核酸酶的作用下緩慢降解,而烘烤過程在一定程度上加快了煙葉DNA 的降解速率,研究發現影響葉片DNA 降解的因素很多,其中環境溫度、濕度等為主要因素[4]。但烘烤過程中的煙葉DNA 降解程度如何,烤后煙葉DNA 能否繼續用于分子標記等方面的研究還相對較少。
隨著分子生物技術的發展與應用,分子標記的優勢逐漸凸顯,因其兼具穩定準確、干擾因素少、檢測手段便捷等優點已成為應用率較高的技術之一[5-6]。在植物遺傳多樣性研究中常用的分子標記多以PCR 反應為基礎,主要有隨機擴增多態 性DNA 標 記(Random Amplified Polymorphic DNA,RAPD)、擴增片段長度多態性(Amplified Fragment Length Polymorphism,AFLP)、相 關序列擴增多態性(Sequence Related Amplified Polymorphism,SRAP)、簡單重復序列(Simple Sequence Repeat,SSR)等[7-10]。除此之外,還有一些新型分子標記,如單核苷酸多態性(Single Nucleotide Polymorphism,SNP)或插入缺失(InDels)、表達序列標簽(Expressed Sequences Tags,EST)[11]等。這些分子標記各有所長,應用領域也有所不同。有研究發現SSR 標記比ISSR(Inter-Simple Sequence Repeats,ISSR)標記能更好地反映物種間基因遺傳多樣性[12],SRAP 標記比AFLP 標記能更清楚地揭示植物形態學差異及進化史[13]。由于SRAP 與SSR 標記的優勢明顯,其在烤煙上的應用也非常廣泛。聶瓊等[14]對5 個煙草屬134 個種質的研究表明,SRAP 標記具有較好的多態性,能很好反映煙草品種間的親緣關系;鄧力超等[15]利用SRAP標記對52 份普通栽培煙草進行分類鑒定,證實了SRAP 標記以新鮮煙葉為材料分析烤煙遺傳多樣性的高效性與有效性;Bindler 等[16]公布了1 張標記位點最多、密度最大的煙草高密度遺傳圖譜,為煙草分子標記提供大量的遺傳信息。近年來的研究顯示,SSR 標記在種質資源的鑒定與利用、基因定位等方面具有較好的應用前景[17-18]。黃莉莎等[19]利用SSR 標記構建了煙草主栽品種的遺傳圖譜,為烤煙遺傳多樣性分析提供了有效的SSR 引物;陳芳等[20]篩選出了8 對重復性好、多態性高的SSR 引物,可將32 份煙草種質資源分為4 個大類,充分顯示了SSR 標記在煙草品種遺傳多樣性分析中有著良好的應用潛力。然而,以上分子標記在煙草上的應用多以苗期煙葉為研究材料,很少涉及烤后煙葉。隨著研究技術的成熟及生產的需要,用烤后煙葉分析烤煙遺傳多樣性很有必要。由于烤后煙葉無論是形態特征還是生理生化特性均發生較大變化,對其進行烤煙遺傳多樣性分析必須尋找適用于烤后煙葉的分子標記。而目前SRAP 與SSR 分子標記在煙草上的應用較多,為此以烤后煙葉為研究對象,利用毛細管電泳檢測技術分析了SRAP 與SSR 兩種分子標記在烤后煙葉中的穩定性及多態性,以期篩選出適用于烤后煙葉的分子標記并用于烤煙品種遺傳多樣性分析。
1 材料與方法
1.1 試驗材料
供試烤煙材料見表1。2018 年11 月在中國煙草總公司鄭州煙草研究院溫室中育苗,培養至60 d左右,每個品種取10 個單株葉片混合后作為試驗樣本。
采用三段式烘烤工藝進行煙葉調制。在烘烤過程中全程跟蹤取樣,每隔24 h 取樣1 次,包括變黃階段(烘烤0、24 和48 h)、定色階段(烘烤72 和96 h)、干筋階段(烘烤120、144 和168 h)等3 個階段的8 個時間點。9 個烤煙品種的烤后煙葉樣品除NC297 和云煙116 來自云南玉溪峨山產區外,其他7 個品種均來自云南玉溪世界煙草品種園。每個品種取樣10 片,煙葉混合后作為試驗樣本。

表1 供試烤煙材料的來源Tab.1 Flue-cured tobacco cultivars used in this study
1.2 儀器與試劑
NanoDrop 2000 超微量分光光度計、超低溫冰箱(美國Thermo Fisher 公司);Milli-Q 超純水處理儀(美國Millipore 公司);微波爐(松下家電有限公司);電泳儀及電泳槽(北京六一儀器廠);凝膠成像系統、PCR 儀(美國Bio-Rad 公司);移液器、高速離心機(德國Eppendorf 公司);電子天平(精密度0.01 mg,德國賽多利斯科學儀器有限公司);水浴鍋(上海精宏實驗設備有限公司);3730XLDNA 序列分析儀(美國ABI 公司)。
Ezup 柱式植物基因組DNA 提取試劑盒、瓊脂糖、TAE 緩沖液、SSR 和SRAP 引物等由生工生物工程(上海)有限公司提供;混合型聚合酶、dNTPs、6×DNA 上樣緩沖液、λDNA/EcoRI+HindIII Marker 等均購于寶生物工程(大連)有限公司。
1.3 煙葉基因組DNA 的提取與檢測
根據Ezup 柱式植物基因組DNA 提取試劑盒說明書進行煙葉基因組DNA 的提取,煙葉中糖類、蛋白質、RNA 和酚類等物質的去除是DNA 提取成功的關鍵 。為滿足后續PCR 的要求,提取DNA 時加入2% β-巰基乙醇,并用酚∶氯仿∶異戊醇(25∶24∶1)重復抽提,以除去煙葉中的蛋白質等雜質,提高煙葉DNA 純度。將每個品種的10 份試驗樣品混合并提取煙葉基因組DNA,重復提取3 次,最 后 溶 解 于50 μ L TE 緩 沖 液(含EDTA 的Tris-HCl,pH 8.0)中,用 超 微 量 分 光 光 度 計NanoDrop 2000 檢測煙葉DNA 濃度與純度,并將DNA 樣品貯存于-20 ℃備用。
1.4 瓊脂糖凝膠電泳
配制濃度為1.5%的瓊脂糖凝膠,取5 μL DNA溶液與1 μL 6×DNA 上樣緩沖液充分混合,小心添加到加樣孔中進行瓊脂糖凝膠電泳。電壓設為100 V,在室溫下電泳45 min,將瓊脂糖凝膠置于GelRed 染液中浸染45 min,然后在凝膠成像儀中觀察并拍照記錄電泳結果。
1.5 SRAP 與SSR 引物的合成
SRAP 與SSR 引物主要來源于文獻查找,主要有Bindler 等[16]公開發表的SSR 引物,以及薛懷裕等[22]篩選的SRAP 引物。熒光引物是在正向引物的5'端隨機標記FAM 或HEX 熒光,其中藍色為FAM 熒光標記,綠色為HEX 熒光標記。所有引物均由生工生物工程(上海)股份有限公司合成,引物信息見表2 和表3。

表2 SRAP 引物序列信息Tab.2 Sequences of SRAP primers

表3 SSR 引物序列信息Tab.3 Sequences of SSR primers
1.6 熒光引物PCR 擴增
配制25 μL PCR 擴增體系[23]:包括50 ng 模板DNA、2 mmol/L MgCl2、0.2 mmol/L dNTPs、0.2 mmol/L 正向和反向引物、10×PCR Buffer、1.0 U TaqDNA 聚合酶,其余用超純水補足。
SSR-PCR擴增程序及參數:94 ℃預變性5 min;94 ℃變性30 s、60 ℃退火30 s、72 ℃延伸30 s,循環10 次;94 ℃變性30 s、55 ℃退火30 s、72 ℃延伸30 s,循環20 次;最后72 ℃延伸10 min。PCR產物直接用于瓊脂糖凝膠電泳檢測,或置于-20 ℃保存備用。
SRAP-PCR擴增程序及參數:94 ℃預變性3 min;94 ℃變性60 s、35 ℃退火30 s、72 ℃延伸30 s,循環10 次;94 ℃變性30 s、55 ℃退火30 s、72 ℃延伸30 s,循環30 次;最后72 ℃延伸10 min。PCR產物直接用于瓊脂糖凝膠電泳檢測,或置于-20 ℃保存備用。
1.7 毛細管電泳檢測
吸取990 μL HIDI 和10 μL LIZ500 的混合物,加入到96 孔反應板中;5 000 r/min 短暫離心,在標記好的96孔板孔中加入相應的PCR產物,5 000 r/min短暫離心;將96孔板用封板膜密封,再次5 000 r/min短暫離心。將96 孔板置于PCR 儀上。變性程序為:98 ℃變性5 min,完成后立即將96 孔板置于冰上迅速冷卻,10 000 r/min 短暫離心。使用ABI3730XLDNA 序列分析儀進行毛細管電泳,檢測PCR 擴增產物的片段大小。采用Genemapper 軟件讀取檢測結果,以信號峰圖形式輸出。圖譜中的每一個電泳峰代表PCR 擴增產物,根據電泳峰的位置和形狀選擇清晰且穩定的峰判斷并記錄DNA 片段長度,將峰圖清晰穩定出現的標記為“1”,相同位置無峰的標記為“0”,建立“0”與“1”二元數據矩陣。利用NTSYS-2.10e 軟件計算供試烤煙品種間的遺傳相似系數,基于SHAN 算法進行UPGMA 聚類分析,并構建遺傳聚類圖[24]。
2 結果與分析
2.1 煙葉DNA 提取與檢測
將提取的所有DNA 樣品經超微量分光光度計檢測濃度與純度,煙葉DNA 濃度為115.6~150.8 ng/μL,OD260/280值在1.77~2.03 之間。說明提取的煙葉DNA 純度較高,所采用的商售試劑盒能夠較好地將煙葉中的蛋白質、酚類等物質除去,對提取過程中殘留的乙醇、三氯甲烷等的去除效果也較好,提取的DNA 能滿足分子標記篩選等后續試驗要求。
2.2 烘烤過程中煙葉DNA 的降解
將不同烘烤時間段的煙葉基因組DNA,利用1.5%的瓊脂糖凝膠進行電泳檢測,結果見圖1。
烘烤過程中煙葉DNA 的瓊脂糖凝膠電泳結果顯示,隨著烘烤時間的延長DNA 條帶亮度整體呈減弱趨勢,其中泳道1~6 的條帶清晰且集中,大小約18 kb,彌散帶亮度弱且短,從烘烤開始至烘烤的干筋前期煙葉DNA 并未發生明顯降解;泳道7、8 的條帶亮度明顯減弱,彌散帶相對增強,彌散帶范圍在3~18 kb 之間,表明DNA 發生了部分降解,可能原因為在干筋中后期烘烤溫度大幅升高,高溫條件下造成DNA 解鏈或斷裂。

圖1 不同烘烤時間段的煙葉DNA 電泳圖譜Fig.1 DNA electrophoretogram of tobacco leaves cured for different time
2.3 烤后煙葉和新鮮煙葉的DNA 完整度比較
9 個烤煙品種的新鮮煙葉和烤后煙葉DNA 電泳檢測結果(圖2)顯示,新鮮煙葉DNA 條帶清晰、帶型單一,煙葉DNA 較為完整,未發生明顯降解現象;而烤后煙葉DNA 條帶均呈現彌散狀分布,其中泳道2(NC297)、14(云煙116)及18(云煙87)的彌散范圍較小,約在1~18 kb 之間,泳道4(中煙100)、6(翠碧1 號)、8(K326)、10(KRK26)、12(云煙97)、16(紅花大金元)的彌散范圍相對較長,從18 kb 延續到0.5 kb 以下。總體上看,烤后煙葉DNA 均發生嚴重降解,但不同品種降解程度略有不同。

圖2 不同品種新鮮煙葉與烤后煙葉的DNA 電泳圖譜Fig.2 DNA electropherogram of fresh and cured tobacco leaves from different cultivars
2.4 SRAP 與SSR 引物PCR 擴增穩定性比較
以9 個烤煙品種的烤后煙葉DNA 為模板,利用熒光標記的SRAP 引物和SSR 引物進行PCR 擴增,經毛細管電泳檢測兩種分子標記在9 個烤煙品種中的擴增結果,見圖3 和圖4。
SRAP 引物PCR 擴增結果(圖3)顯示,引物SRAP5 雖然在NC297 和云煙87 兩個品種中擴增產物相對穩定且擴增產物約為110 bp,但在其他7個烤煙品種的3 次重復中擴增產物的數量及片段長度均存在差異;引物SRAP7 除NC297 擴增結果較穩定外,其他8 個烤煙品種的3 次生物學重復中常出現或長或短的非目的片段;引物SRAP16 在9個烤煙品種中擴增結果較穩定的有NC297、中煙100 和翠碧1 號等,在其他6 個品種的3 次重復中出現不穩定存在的擴增產物。總體來看,SRAP標記在烤煙品種中均有良好的多態性,但在3 次生物學重復中表現不穩定,其結果可靠性偏低。
SSR 引物PCR 擴增結果(圖4)顯示,引物NTGS66292 在云煙87、云煙116 以及紅花大金元等3 個烤煙品種中擴增產物片段大小均為136 bp,且3 次重復無明顯差異,其余6 個烤煙品種中均為150 bp,總體穩定性較好;引物PT30403 在翠碧1號的3 次生物學重復中PCR 擴增產物均為245 bp,在其他8 個烤煙PCR 擴增產物均為230 bp,引物PT30361 在云煙116 和紅花大金元兩個烤煙品種中的PCR 擴增產物均為174 bp,在KRK26 的PCR擴增中同時出現174 bp 和186 bp 兩種產物。3 對引物在9 個烤煙的3 次生物學重復中均保持良好的擴增穩定性,表明SSR 標記在烤后煙葉中也較為穩定,且重復性較好,結果可靠性高。
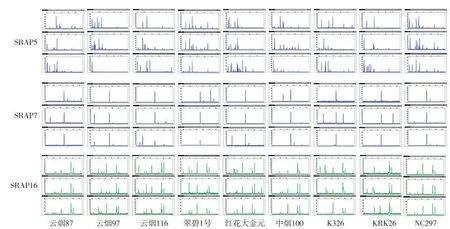
圖3 SRAP 標記在烤后煙葉中的擴增穩定性Fig.3 Amplification stability of SRAP markers in cured tobacco leaves

圖4 SSR 標記在烤后煙葉中的擴增穩定性Fig.4 Amplification stability of SSR markers in cured tobacco leaves
2.5 SSR 引物篩選與烤煙遺傳多樣性分析
鑒于SSR 標記較好的穩定性,以9 個烤煙品種的烤后煙葉DNA 為模板,從文獻中篩選54 對SSR引物進行PCR,結合毛細管電泳檢測技術,并優化PCR 條件,從54 對SSR 引物中篩選出8 對能夠穩定擴增并在品種間有差異的引物,分別是NTGS66290、NTGS66292、NTGS66295、PT30008、PT30169、PT30361、PT30403 和PT30424。統計毛細管電泳檢測結果,并繪制出8 對SSR 引物在供試品種中的0、1 矩陣,結果見表4。

表4 9 個烤煙品種的指紋圖譜Tab.4 Fingerprints of 9 flue-cured tobacco cultivars
根據8 對SSR 引物在9 個烤煙品種中的PCR擴增結果繪制出烤煙指紋圖譜(表4)可知,8 對SSR 引物在9 個烤煙品種中共檢測到92 個擴增產物,其片段大小處于92~245 bp 之間,其中多態性條帶20 個,多態性檢出率為21.74%,8 對SSR 引物能夠將9 個烤煙品種區分開,其中NTGS66290和PT30424 兩對引物的多態性較好,PT30008和PT30403 分別是紅花大金元、翠碧1 號的特征引物。
采用UPGMA 算法計算遺傳9 個烤煙品種的遺傳相似系數并繪制遺傳聚類圖,9 個烤煙品種間遺傳相似系數分布在0.250~0.900 之間,平均值為0.622(表5)。由遺傳相似系數獲得的聚類圖(圖5)表明,當遺傳相似系數為0.649 時,可將9 個烤煙品種分為4 個類群。其中云煙87、云煙116、K326、KRK26、中煙100 和NC297 聚為一類,而紅花大金元、翠碧1 號及云煙97 與這一類的遺傳距離較遠。云煙87 與K326 首先聚在一起,說明兩者遺傳背景較近,遺傳相似系數為0.900。遺傳相似系數最小為0.250,出現在紅花大金元和云煙97 兩個品種間。由此可見,8 對SSR 引物可將9 個烤煙品種進行有效區分。

表5 9 個烤煙品種的遺傳相似性分析Tab.5 Genetic similarity analysis of 9 flue-cured tobacco cultivars
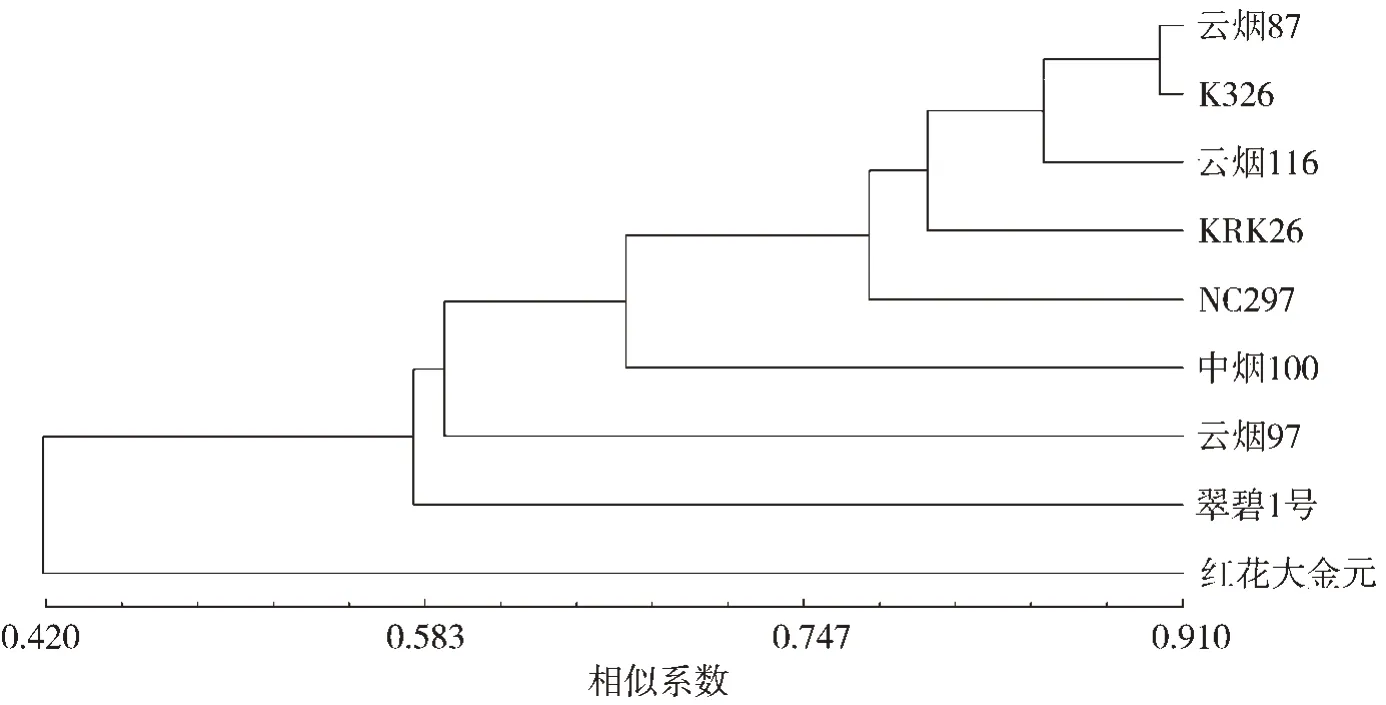
圖5 9 個烤煙品種的SSR 標記聚類圖Fig.5 Dendrogram of 9 flue-cured tobacco cultivars based on SSR markers
3 討論
本研究中通過提取新鮮煙葉、烘烤中煙葉、烤后煙葉基因組DNA,結果表明新鮮煙葉DNA 條帶單一,其片段大小約18 kb,這與Xin 等[25]研究結果類似;在烘烤過程的中后期,煙葉DNA 出現一定程度降解,而烤后煙葉則出現大量降解,說明煙葉基因組DNA 的降解始于烘烤的干筋期。烤后煙葉DNA 之所以出現大量降解的原因可能是煙葉烘烤完成并移出烤房后的貯存環境相對濕度增大,加快了DNA 的降解速率,這與前人研究DNA的降解規律相符合[26-27]。
在引物多態性方面,SRAP 標記多態性較好,SSR 標記多態性一般,說明SRAP 標記的多態性略優于SSR 標記,這與玉米、馬鈴薯、草莓等作物中的研究結果基本一致[28-30]。而在穩定性方面,SRAP 標記在烤后煙葉中的穩定性遠劣于SSR 標記,部分原因可能是SRAP 標記主要在ORF 特定區域進行特異擴增,位于功能性區域,其多態性條帶較多,PCR 擴增結果不穩定[31]。有學者研究顯示,與其他基于PCR 的分子標記相比,SSR 標記的優勢體現在較好的重復性[32],SSR 標記有更高的穩定性可能是因為SSR 標記長度一般較短,兩側序列也較為保守,且均勻分布于植物整個基因組中。孫九喆[33]等利用SSR 標記構建不同烤煙品種的指紋圖譜,能夠對初烤煙葉品種進行快速區分。另外有研究顯示隨著DNA 的降解,SSR 標記甚至比SNP 標記的效果更好[34],基于SSR 標記在烤后煙葉中的重復性、可靠性以及特異性,在烤后煙葉的遺傳多樣性研究中將發揮重要作用。
栽培煙草(尤其是烤煙)由于經歷長時間的人工馴化和定向選擇導致遺傳基礎相對狹窄[35-36],在本試驗中也出現相同的結果。9 個煙草主栽品種的遺傳相似系數在0.250~0.900 之間,如云煙116與云煙87、K326 與KRK26 間的遺傳相似系數高達0.900。雖然品種間遺傳相似性較高,但SSR 分子標記依然能夠將其區分開來,說明基于烤后煙葉利用SSR 分子標記技術分析烤煙品種遺傳多樣性的策略可行。由于9 個主栽品種間親緣關系較近,引物篩選難度較大,因此在篩選更多的鑒別能力強的引物,進而對品種進行更加快速有效地區分方面仍有待進一步深入研究。
4 結論
烘烤過程中煙葉DNA 在變黃期、定色期以及干筋期的前期并未發生明顯降解,僅在干筋期的中、后期出現部分降解,而烤后煙葉DNA 的降解則非常嚴重。SRAP 與SSR 兩種分子標記在烤后煙葉中的擴增穩定性與多態性方面,SRAP 標記的多態性略優于SSR 標記,而SSR 標記比SRAP 標記具有更好的重復性和穩定性。因此,針對烤后煙葉利用SSR 標記分析烤煙品種遺傳多樣性更為可靠。其中NTGS66290、NTGS66292、NTGS66295、PT30008、PT30169、PT30361、PT30403 和PT30424等8 對SSR 引物能將9 個烤煙品種進行有效區分,其遺傳相似性系數為0.250~0.900,平均值為0.622。

