轉運系統(tǒng)集成改造提升大腸桿菌胞外蛋氨酸積累
董 偉, 李由然, 張 梁, 丁重陽, 石貴陽*
(1. 江南大學 糧食發(fā)酵工藝與技術國家工程實驗室,江蘇 無錫 214122;2. 江南大學 生物工程學院,江蘇 無錫214122)
蛋氨酸作為一種含硫氨基酸被廣泛應用于飼料添加,食品制造,生物制藥等領域[1-3],目前,蛋氨酸的生產(chǎn)仍然停留在利用化石燃料通過化工合成的辦法滿足市場需求, 對生態(tài)環(huán)境造成很大壓力。微生物發(fā)酵法生產(chǎn)L-蛋氨酸因其低成本與環(huán)境友好型等特點,受到越來越多專家學者的親賴。 通過隨機誘變和代謝工程可以選育蛋氨酸高產(chǎn)菌株,但前者不確定性較強,工作量較大。 隨著全基因組測序技術和系統(tǒng)代謝工程的日趨成熟,使理性改造菌株發(fā)酵生產(chǎn)蛋氨酸成為代謝合成研究的熱點[4]。
目前,微生物代謝工程改造增強蛋氨酸合成主要通過加強蛋氨酸合成酶編碼基因metB[5-6]、S-腺苷甲硫氨酸合成酶編碼基因metK[7]、解除反饋抑制的高絲氨酸轉琥珀酰基酶HTSFbr[8]和高絲氨酸琥珀酰基轉移酶編碼基因metA[9]的表達等方式來增強碳代謝途徑,敲除MetJ 阻遏蛋白編碼基因metJ、MetD 運輸系統(tǒng)的編碼基因metNIQ、賴氨酸合成途徑編碼基因lysA 和蘇氨酸合成途徑編碼基因thrC 等方式阻斷支路降解途徑,同時也有關于硫代謝途徑和葡萄糖運輸途徑修飾相關的研究報道[10,11]。微生物代謝合成網(wǎng)絡結構復雜,為了避免代謝流流向一些未知的支路途徑和減少胞內(nèi)氨基酸的過量積累對菌體生長造成負擔,氨基酸轉運系統(tǒng)成為一些研究者關注的重點,如本研究室曾發(fā)現(xiàn)轉運蛋白對蘇氨酸代謝合成起到非常重要的作用[11]。大腸桿菌蛋氨酸MetD吸收轉運系統(tǒng)編碼基因metN、metI 和metQ 的全部敲除可以降低E.coli W3110 胞外蛋氨酸的吸收速率,YjeH 和YeaS 分泌系統(tǒng)可以加強蛋氨酸向胞外轉運,但目前并沒有將兩者相結合進行胞外蛋氨酸積累影響的報道[12]。
本研究中以E.coli W3110 為出發(fā)菌株,通過比較metN、metI 和metQ 單基因敲除菌株與metN、metI 和metQ 的全部敲除菌株胞外蛋氨酸吸收速率, 選擇胞外吸收速率最小的菌株進行YjeH 和YeaS 分泌系統(tǒng)研究,闡述弱化蛋氨酸吸收與增強蛋氨酸分泌集成改造策略對胞外蛋氨酸積累的影響。
1材料與方法
1.1 材料
1.1.1 菌株與質(zhì)粒 本研究中所用的基座菌株E.coli W3110 為實驗室保藏, 基因敲除所需要的質(zhì)粒pKD13、pKD46、pCP20 購于美國耶魯大學大腸桿菌菌 株 庫 (CGSC,E.coli Genetic Stock Center,New Haven,USA)[12]。 實驗室構建和保藏的質(zhì)粒pETABY, 由pN25 啟動子控制蛋氨酸操縱子編碼框pET-ABY 的表達,metA、metB、malY 分別編碼高絲氨酸琥珀酰轉移酶、γ-胱硫醚聚合酶、β-胱硫醚酶。重 組 菌M10、M11、M12、M13、M14、M15、M16 為 本研究構建,各菌株及質(zhì)粒見表1。

表1 本研究中主要的菌株和質(zhì)粒Table 1 Main strains and plasmids used in this study
1.1.2 工具酶及試劑 實驗所用的RNA 提取試劑盒、2×taq PCR master mix、 質(zhì)粒DNA 提取試劑盒,購自杭州寶賽生物公司;胰蛋白胨、瓊脂粉、酵母粉,購自英國Oxoid 公司;瓊脂糖,購自Biowest 公司;氨芐青霉素、氯霉素、卡那霉素,購自Sigma 公司;其他試劑均為國產(chǎn)或進口分析純。

續(xù)表1
1.1.3 培養(yǎng)基及培養(yǎng)條件 SOB 培養(yǎng)基(g/L):酵母粉5,KCl 0.186,MgCl20.95,NaCl 0.5,蛋白胨20;轉接攜帶有質(zhì)粒pKD46 的液體SOB 培養(yǎng)基需另加入7.5 g/L L-阿拉伯糖。
搖瓶發(fā)酵培養(yǎng)基為改進的TPM 培養(yǎng)基(g/L)[13]:維 生 素B120.01, 葡 萄 糖 20,MgSO4·7H2O 2,MnSO4·4H2O 0.5, 酵母粉4,KH2PO44,(NH4)2SO414,L-threonine 0.238,L-lysine 0.164,CaCO310,PLP 0.01,生物素0.01,微量元素母液5 mL。 微量元素母液成份(g/L):CuSO4·5H2O 1,CaCl21.35,Na2B4O7·10H2O 0.23,ZnSO4·7H2O 2.25,F(xiàn)eSO4·7H2O 10, (NH4)6Mo7O24·4H2O 0.106,35 g/dL HCl,10 mL, 調(diào)整最終pH 為7.0。接種體積分數(shù)2%,31°C、250 r/min 搖床培養(yǎng)48 h。
分析培養(yǎng)基(g/L):蛋氨酸0.5,H3BO31,MgSO42.05,MnSO420,(NH4)2SO40.75,NH4Cl 0.13,F(xiàn)eSO440,CaCl240,CoCl28,(NH4)2HPO42,ZnSO44,CuCl22,(NH4)2Mo2O72.8,Na2HPO42,K2HPO44,調(diào)整最終pH 6.7。
1.1.4 引物

表2 本實驗所用引物Table 2 Oligonucleotides used in this study

續(xù)表2
1.2 方法
1.2.1 基因敲除和基因組替換方法 利用Red 重組技術進行基因敲除[14]。1)PCR 打靶片段的制備:質(zhì)粒pKD13 作為模版, 以InmetQ-FW/InmetQ-RV、InmetI-FW/InmetI-RV、InmetN-FW/InmetN-RV為引物,2×taq聚合酶擴增片段大小為1.4 kb 的敲除盒metQ、metI、metN。PCR 擴增體系10 μL,2×PCR master mix 5 μL,ddH2O 4.7 μL,模板0.1 μL,引物各0.1 μL。2)突變盒的純化濃縮:PCR 反應產(chǎn)物凝膠電泳純化后所得片段中加入1/50 倍體積5 mol/L NaCl和2 倍體積預冷的無水乙醇,于-70 ℃冰箱靜置20 min,取出后4 ℃、12000 r/min 離心10 min,去除上清液后得到黏附于管壁的絮狀沉淀,加入無水乙醇(預冷),4 ℃、12000 r/min 離心4 min, 用適量ddH2O振蕩溶解。 3)基因敲除:制備含有質(zhì)粒pKD46 的E.coli感受態(tài)細胞,電轉體系為:感受態(tài)細胞,95 μL;突變盒片段,5 μL;電壓,1800 V;后培養(yǎng)37 °C,1 h。以YmetQ-FW/YmetQ-RV、YmetI-FW/YmetI-RV、YmetN-FW/YmetN-RV 作為引物進行PCR 驗證。4)卡那霉素抗性的消除:制備整合了敲除盒的E.coli菌株的感受態(tài)細胞,通過電激轉化導入質(zhì)粒pCP20,利用含有氯霉素抗性的SOB 固體平板進行篩選,挑取轉化子進行PCR 驗證。
基因組上整合替換,所用引物見表2。打靶片段的制備參見文獻[15]。 利用Red 重組在E.coliW3110染色體上單拷貝整合yjeH、yeaS。
1.2.2 菌體生長曲線的測定 分別挑取E. coliW3110、M11、M12、M13 的單菌落于20 mL SOB 液體培養(yǎng)基,37 °C、200 r/min 過夜培養(yǎng), 轉接50 mL FM 培養(yǎng)基,37 ℃、200 r/min 培養(yǎng),每隔2 h 取樣檢測分光光度計600 nm 下的菌體密度,測定生長曲線。
1.2.3 菌體生物量的測定 菌體濃度以分光光度計600 nm 下的吸光值OD600表示,菌體干重(DCW)以本實驗室的經(jīng)驗公式換算獲得:
DCW=OD600×0.3809-0.0048[12]
1.2.4 蛋氨酸的測定 HPLC 柱前鄰苯二醛(OPA)自動衍生法測定蛋氨酸的濃度,Waters C18(250 mm×4.6 mm,0.5 μm) 反相柱分離,A、B 流動相梯度洗脫,洗脫程序如表3 所示,柱溫40 ℃,紫外檢測器檢測,檢測波長338 nm。

表3 HPLC 蛋氨酸分析洗脫程序Table 3 Gradient elution for analysis of L-methionine by HPLC
1.2.5 熒光定量PCR (RT-qPCR) 利用試劑盒提取大腸桿菌總的RNA,qPCR CT 值的校正以引物pf-16S,pr-16S 擴增16SrRNA 作為內(nèi)參基因, 相對表達量以2-△△CT模型進行檢測[16],所用引物見表2。
1.2.6 蛋氨酸胞內(nèi)運輸能力檢測 SOB 培養(yǎng)基中添加0.5 g/L 蛋氨酸作為種子培養(yǎng)基, 過夜培養(yǎng),誘導菌株表達蛋氨酸吸收載體。 在蛋氨酸分析培養(yǎng)基中添加1 g/L 的蛋氨酸作為碳源, 發(fā)酵過程中檢測菌體生長過程中蛋氨酸的消耗情況,以蛋氨酸對菌體的比消耗速率表征大腸桿菌吸收蛋氨酸的能力。
2結果與分析
2.1 MetD 運輸系統(tǒng)缺失菌株的構建
以E. coliW3110 為出發(fā)菌株, 按照1.2.1 的方法敲除metN、metI、metQ,構建菌株M11、M12、M13,結果如圖1 所示。metN、metI、metQ的鑒定引物分別為YmetN-FW/YmetN-RV、YmetI-FW/YmetIRV、YmetQ-FW/YmetQ-RV,利用2 對引物與K1、K2 對敲除菌株進行菌落PCR 驗證,得到990、740、1170 bp 和1170、1420、1090 bp 的PCR 片段,電泳結果與理論值相符,消除kan抗性后,得到850、880、950 bp 的DNA 片段,送生工測序結果正確,成功構建了metN、metI、metQ基因敲除菌株。
2.2 弱化蛋氨酸吸收基座菌株的篩選

圖1 metN、metI、met 突變轉化子的PCR 鑒定Fig. 1 PCR identification of metN, metI, metQ gene mutants
按照1.2.6 的方法對大腸桿菌W3110 和重組菌株M11、M12、M13 蛋氨酸吸收能力進行了檢測。 圖2 表示搖瓶培養(yǎng)10 h 菌體的生長以及培養(yǎng)基中蛋氨酸質(zhì)量濃度的變化,表4 列出了重組菌株蛋氨酸的比消耗速率。 由圖2 可知,在蛋氨酸分析培養(yǎng)基中重組菌與對照菌株均生長緩慢,但是對蛋氨酸的消耗速率顯著差異。 由表4 可知, 搖瓶培養(yǎng)10 h,metN、metI、metQ 基因單敲除菌株M11、M12、M13 蛋氨酸平均比消耗速率分別為11.23、10.34、12.03 mg/(L·h),與對照菌W3110 相比蛋氨酸的平均比消耗速率分別降低了9.5%、16.7%、3.1%。 metI 基因的敲除顯著降低了大腸桿菌對于胞外蛋氨酸的吸收效率,metN 次之;敲除基因metQ,蛋氨酸吸收能力降低幅度最小。 本研究室前期研究發(fā)現(xiàn),metNIQ 三敲除菌株胞外蛋氨酸吸收速率降低了13.4%[12], 基因metI 單敲除更加有利于減少大腸桿菌對胞外蛋氨酸的重吸收。 因此,本研究將M12 作為弱化蛋氨酸吸收基座菌株與蛋氨酸分泌系統(tǒng)相結合進行集成改造,考察胞外蛋氨酸的積累。
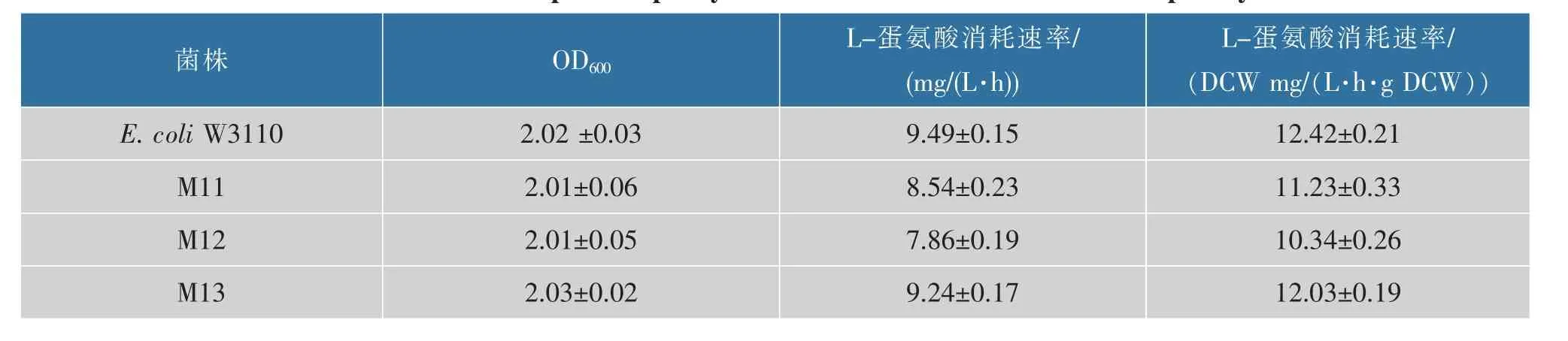
表4 重組菌株蛋氨酸吸收能力Table 4 L-methionine uptake capacity of strains with MetD modified transport system

圖2 蛋氨酸分析培養(yǎng)基中重組菌株生長狀況Fig. 2 Growth status of recombinant strains in methionine assay medium
2.3 YjeH,YeaS 運輸系統(tǒng)游離表達對菌株生長以及蛋氨酸胞外積累的影響

圖3 重組菌株E. coli M12、M12(pET-ABY)、M12(pETABY /pKK-yjeH)、M12 (pKK-yjeH)、M12 (pKKyeaS)、M12(pET-ABY /pKK-yeaS)生長曲線Fig. 3 Growth curves of recombinant strains E.coli M12,M12(pET-ABY),M12(pET-ABY/pKK-yjeH),M12(pKK-yjeH),M12(pKK-yeaS) and M12(pET-ABY/pKK-yeaS)mutants
將實驗室前期構建的yjeH、yeaS 基因過表達載體pKK-yjeH、pKK-yeaS 轉染M12, 記錄菌體生長以及胞外蛋氨酸積累情況。從圖3 可以看出yjeH 與yeaS 的過表達在一定程度上均抑制了菌體的生長,本研究室前期構建用來表達解除了反饋抑制的高絲氨酸轉琥珀酰基酶和增強蛋氨酸代謝過程中的γ-胱硫醚聚合酶以及β-胱硫醚酶[12]的質(zhì)粒pETABY 的表達可以有效緩解生長抑制。 yjeH、yeaS 的過量表達可能使大腸桿菌胞內(nèi)蛋氨酸質(zhì)量濃度過低, 影響了大腸桿菌生長過程中所需要物質(zhì)的合成,菌體的生長受到抑制,同時胞外蛋氨酸的質(zhì)量濃度過高也會抑制菌體的生長, 質(zhì)粒pET-ABY 的表達強化了蛋氨酸合成途徑,在基因交互作用的影響下其生長抑制得到了有效緩解。 對比M12(pETABY)、M12 (pET-ABY/pKK-yjeH) 和M12 (pETABY/pKK-yeaS)發(fā)酵過程中胞內(nèi)蛋氨酸的質(zhì)量濃度變化,如圖4 所示,YjeH、YeaS 運輸系統(tǒng)的強化促進了大腸桿菌向胞外分泌L-蛋氨酸, 降低了胞內(nèi)L-蛋氨酸的積累,YjeH 運輸系統(tǒng)的效果更為顯著。 我們對2 種轉運系統(tǒng)游離表達菌株進行了發(fā)酵實驗,結果如圖5 所示,YjeH 與YeaS 運輸系統(tǒng)的表達都能夠在胞外積累一定量的蛋氨酸, 其最大積累量分別為0.21 g/L 和0.18 g/L,蛋氨酸產(chǎn)率分別為0.06 g/g DCW 和0.05 g/g DCW。

圖4 重組菌株發(fā)酵過程中胞內(nèi)蛋氨酸的質(zhì)量分數(shù)Fig. 4 Intracellular methionine concentration during fermentation of recombinant strains
2.4 YjeH 和YeaS 在染色體上的整合表達
metJ為大腸桿菌蛋氨酸代謝過程中的關鍵阻遏基因, 其通過與代謝過程中關鍵基因metK、metQIN、metF、metC、metE、metBL和metR等啟動子的Met-box 相結合來影響蛋氨酸代謝通路,為了降低SAM 和metJ的共阻遏效應, 我們通過敲除編碼基因metJ構建解除阻遏調(diào)控的重組菌株[17-20]。 構建打靶質(zhì)粒T-metJPtacM[15],通過電激轉化的方法,在E. coliW3110 染色體上敲除metJ基因并單拷貝整合yjeH和yeaS基因, 一步實現(xiàn)metJ的敲除和yjeH、yeaS在染色體上的整合表達。 以W3110 染色體為模板,用引物YjeH-SmaI-FW/YjeH-HindIIIRV、YeaS-SmaI-FW/YeaS-HindIII-RV PCR 擴增yjeH,yeaS,將所得到的基因片段,與經(jīng)過HindIII,SmaI 酶切處理過的載體T-metJPtacM 連接, 酶切得到大小分別為1257 bp/5059 bp 和639 bp/5059 bp的片段如圖6(a)、6(c)所示,測序結果無堿基突變,說明載 體T-metJPtacMyjeH,T-metJPtacMyeaS構 建 成功。按照1.2.1 的方法將metJPtacMyjeH,metJPtacMyeaS整合到W3110 的染色體上,構建菌株M15、M16,鑒定結果如圖6(b)、6(d)所示。

圖5 重組菌M12 (pKK-yeaS/pET-ABY)、M12 (pKKyjeH/pET-ABY)搖瓶發(fā)酵生長代謝狀況Fig. 5 Growth and metabolism of recombinant M12 (pKK-yeaS/pET-ABY) and M12 (pKKyjeH/pET-ABY) during shake flask fermentation
2.5 YjeH 運輸系統(tǒng)整合表達對菌株生長以及蛋氨酸胞外積累的影響
利用RT-qPCR 比較了菌株M15 相對于野生E. coliW3110yjeH和yeaS基因的表達比率, 結果如圖7 所示,與原始菌株相比,yjeH、yeaS基因的表達水平分別提高了1.65 倍和1.59 倍。對M15(pETABY)和M16(pET-ABY)進行了發(fā)酵實驗驗證基因yjeH、yeaS整合表達對蛋氨酸胞外分泌的影響,如圖8 所示,M15(pET-ABY)和M16(pET-ABY)最大胞外蛋氨酸的積累量分別為0.48 g/L 和0.25 g/L,蛋氨酸產(chǎn)率分別為0.13 g/g DCW 和0.08 g/g DCW。與游離表達相比, 其產(chǎn)量分別提高了128%和38.9%,產(chǎn)率提高了85.7%和60%。

圖6 菌株M15,M16 的PCR 鑒定電泳圖Fig. 6 PCR identification of strain M15 and M16

圖7 不同菌株yjeH 轉錄水平測定Fig. 7 Relative gene transcriptional levels of yjeH in the different strain

圖8 重組菌M15(pET-ABY)、M16(pET-ABY)搖瓶發(fā)酵生長代謝狀況Fig. 8 Growth and metabolism of recombinantM15 (pETABY) and M16 (pET-ABY) during shake flask fermentation
3結 語
隨著對微生物氨基酸合成途徑的深入了解,轉運系統(tǒng)在氨基酸育種研究中的作用越來越受到人們的重視,近年來的研究表明,對氨基酸向胞內(nèi)吸收和胞外運輸途徑進行改造,是提高氨基酸產(chǎn)量行之有效的方法。MetD 運輸系統(tǒng)是蛋氨酸吸收的主要途徑,與過表達代謝途徑中促進蛋氨酸合成的關鍵酶相比,修飾蛋氨酸向胞內(nèi)的運輸系統(tǒng)并不能提高蛋氨酸生物合成代謝流,但能夠有效減少組織對胞外蛋氨酸的吸收,降低胞內(nèi)蛋氨酸的濃度,改善內(nèi)部環(huán)境,從而減弱蛋氨酸對細胞的毒害作用以及降低無效循環(huán),進而可以提高魯棒性以及氨基酸合成的能力[12]。 本實驗以E. coli W3110 為基座菌株,利用Red 重組技術分別獲得E. coli W3110 中MetD運輸系統(tǒng)的關鍵組分metN、metI 和metQ 單敲除菌株, 與菌株W3110 相比,metI 的缺失使胞外蛋氨酸吸收速率降低了16.7%。 為了避免多拷貝引起的轉基因沉默以及基因表達水平過高抑制菌體生長,對M12 進行yjeH 和yeaS 基因單拷貝整合有效促進了胞外蛋氨酸的積累,同時緩解了游離表達造成的菌體生長抑制現(xiàn)象,M15 (pET-ABY) 和M16 (pETABY) 最大胞外蛋氨酸產(chǎn)量分別提高了128%和38.9%。 可見,在弱化蛋氨酸吸收基座菌株的基礎上加強胞內(nèi)蛋氨酸的分泌進行集成改造可以有效提高胞外蛋氨酸的積累。 盡管很多研究人員分別進行氨基酸轉運分泌系統(tǒng)和吸收系統(tǒng)的研究,但將兩者有機結合進行系統(tǒng)的分析改造是轉運系統(tǒng)工程研究的重要趨勢,在以后蛋氨酸以及其他氨基酸生產(chǎn)菌株的理性改造過程中必將發(fā)揮愈來愈重要的作用。

