植烷醇磷酸甘露糖的酶法合成及應用
李盛陶, 王 寧, 高曉冬*
(1.江南大學 生物工程學院,江蘇 無錫214122;2.江南大學糖化學與生物技術教育部重點實驗室,江蘇 無錫214122)
蛋白質的糖基化修飾是真核細胞翻譯后修飾的主要形式之一,在蛋白質折疊,轉運和定位過程中發揮著重要作用[1]。 分泌蛋白和細胞表面蛋白的糖基化發生在內質網(ER)和高爾基體上,主要包括有:N-糖基化[2]、糖基磷脂酰肌醇(GPI)錨定化[3]、O-[4]及C-甘露糖基化[5]等4 種修飾。 在ER 腔內的甘露糖基化修飾共同存在于上述4 種途徑中,在糖基化修飾過程中起著重要的作用。 ER 腔內的甘露糖基化是利用糖基轉移酶將甘露糖(Man)從供體多萜醇磷酸甘露糖(Dol-P-Man)轉移到受體上,因此Dol-PMan 的合成對于理解不同種類的蛋白糖基化修飾具有重要的意義[6]。
在所有真核生物中,Dol-P-Man 的合成發生在ER 胞質區,利用多萜醇磷酸甘露糖合成酶(DPM 合成酶)將Man 從供體鳥苷二磷酸甘露糖(GDP-Man)轉移到受體多萜醇磷酸(Dol-P)上[7]。 為了體外酶法合成Dol-P-Man,早期的研究利用酵母細胞及豬肝破碎后分離微粒體(含ER 成份),制備天然的DPM合成酶, 體外催化GDP-Man 和Dol-P 生成Dol-PMan[8-9]。 隨著酵母DPM 合成酶基因(DPM1)的克隆鑒定[10],后面的研究采用了重組大量表達酵母Dpm1用于Dol-P-Man 的合成[11]。但是由于多萜醇(Dolichol)的結構非常復雜, 含有超過100 個碳原子的脂肪鏈[12],因此難以獲得及在體外反應中難以溶解等因素進一步地限制了Dol-P-Man 的體外合成。 Wilson等發現植烷醇(Phytanol)作為一個簡單的結構(含有20 個碳),能夠替代Dolichol,在體外反應中酵母Dpm1 能夠催化植烷醇磷酸(Phy-P)與GDP-Man 形成Phy-P-Man[13]。 但是結構簡單的替代物Phy-PMan 作為供體能否被ER 腔內的甘露糖基轉移酶(如N-糖基化途徑中的酶Alg3)所識別并不知道。
為了解決上述存在的問題,本文作者成功地原核表達并純化了酵母Dpm1,利用簡單的結構Phy-P與GDP-Man 催化合成了Phy-P-Man。 更進一步地證明,Phy-P-Man 能夠作為Alg3 的底物用于N-糖基化的研究。
1材料與方法
1.1 原核表達載體的構建
原核表達酵母Dpm1 蛋白質重組載體的構建如下:首先從NCBI 中下載釀酒酵母DPM1 基因序列,設計一對引物分別在5′ 端和3′ 端引入BamHI 和EcoRI 酶切位點。以釀酒酵母基因組為模板,擴增得到DPM1 PCR 產物, 酶切連接構建得到重組載體pET28a-Dpm1。 Dpm1 的突變蛋白質采用定點突變重疊PCR 方法引入[14]。 酵母Alg3 蛋白質的原核表達在N 端融合了Mistic 標簽,Mistic 的序列參照以前的文獻[15]。載體構建如下:首先人工合成Mistic 基因序列, 連接到pET28a 的NdeI 和NheI 酶切位點之間構建載體pET28a-Mistic。釀酒酵母ALG3 基因從釀酒酵母基因組上擴增, 連接到載體pET28a-Mistic 的BamHI 和XhoI 酶切位點之間構建載體pET28a-Mistic-Alg3。 所有載體都經過測序確認(華大基因)。
1.2 重組蛋白Dpm1 的大量表達與純化
將重組原核表達質粒pET28a-Dpm1 轉入Rosetta(DE3)(Thermo Scientific)原核表達宿主菌,構建重組原核表達宿主菌。挑取單菌落接種于5 mL LB(含Kan50 μg/mL 氯霉素34 μg/mL)液體培養基中,37 ℃振蕩培養過夜。取2 mL 過夜培養的菌液接種于200 mL TB(含Kan、氯霉素)液體培養基中,37 ℃、200 r/min 振蕩培養3 h,使OD600達到0.6~0.8,然后轉移至16 ℃繼續培養1 h 再加入IPTG 使其終濃度達到0.1 mmol/L, 200 r/min 誘導培養20 h。 離心收集菌體, 重懸于20 mL A 緩沖液 (25 mmol/L Tris/HCl(pH 8.0),150 mmol/L NaCl)中,超聲破碎,4000 g、4 ℃離心20 min,棄沉淀,收集上清液20000 g,4 ℃高速離心90 min, 棄上清液, 沉淀重懸于10 mL B緩沖液 (25 mmol/L Tris/HCl (pH 8.0), 150 mmol/L NaCl, 體積分數1% Triton X-100)4 ℃放置30 min后12000 g 離心30 min,收集上清用于純化。 純化步驟如下:HisTrap HP 1 mL 親和層析柱(GE)先用10 倍體積的B 液流速1 min/mL 平衡后,上樣10 mL左右上清液,然后分別用含20、60、500 mmol/L 咪唑的B 液各10 mL 洗柱子, 分別收集與離心管中,取樣進行SDS-PAGE 電泳檢測。
1.3 重組蛋白Mistic-Alg3 的大量表達、膜成份制備及western blotting 檢測
將重組原核表達質粒pET28a-Mistic-Alg3 轉入Rosetta(DE3)原核表達宿主菌。 表達條件與上述Dpm1 一致。 為了制備含有Mistic-Alg3(M-Alg3)蛋白的大腸桿菌膜成份,離心收集誘導表達的10 mL 重組菌體,重懸于1 mL A 緩沖液中,超聲破碎,4000 g、4 ℃離心20 min,棄沉淀,收集上清液100000 g、4 ℃高速離心60 min, 棄上清液, 沉淀重懸溶解于0.1 mL 緩沖液 (50 mmol/L 2-(N-嗎啉) 乙磺酸(MES) pH 6.5,體積分數30% glycerol),即得到大腸桿菌細胞膜成分, 蛋白免疫印跡(Western blotting)進行檢測M-Alg3 的表達。 具體操作如下:取10 μg 細胞膜成份進行SDS-PAGE, 然后轉到PVDF 膜上。 5 g/dL 的脫脂牛奶(上海生工)封閉1 h后,2000 倍 稀 釋 的 一 抗 (anti-His Mouse mAb,TRANS)孵育1 h,TBST 洗滌3 次。 5000 倍稀釋的二抗(HRP-Goat Anti-Mous lgG, TRANS)孵育1 h,TBST 洗滌3 次后,ECL 顯色試劑(BIO-RAD)顯色,放入ImageQuant LAS 4000 凝膠成像系統(GE)中曝光觀察結果。
1.4 重組蛋白Dpm1 的酶活檢測
Dpm1 的底物phytanyl-phosphate(Phy-P)根據早期的文獻和作者之前的文章化學合成[16-17]。 標準的酶反應條件如下 (50 μL 體系):50 mmol/L Tris/HCl (pH 7.5),10 mmol/L MgCl2, 體積分數1%NP-40,20 mmol/L Phy-P,50 mmol/L GDP-Man (Sigma) 和2 mg/mL 純化的Dpm1 蛋白。 反應在30 ℃下孵育10 h。 酶的活性檢測用薄層層析方法(TLC)檢測,具體如下:反應結束后,用毛細管取少量點于硅膠板(Merck), 吹干后在氯仿/甲醇/水(6.5∶3.5∶0.4, 體積比)的展開劑中層析。 結束后,浸于乙醇/硫酸(19∶1,體積比)溶液中,然后加熱顯色。
1.5 重組蛋白M-Alg3 的酶活檢測
重組蛋白M-Alg3 的底物Phy-PP-GlcNAc2-Man5(Phy-PP-M5) 在我們之前的文章中合成[17-18]。標準的酶反應條件如下 (60 μL 體系): 14 mmol/L MES(pH 6.0),4 mmol/L potassium citrate,10 mmol/L MgCl2,10 mmol/L MnCl2,1 mmol/L sucrose,50 μmol/L Phy-PP-M5,2 mmol/L Phy-P-Man, 體積分數0.05%NP-40 和20 mg/mL 的M-Alg3 膜成份。反應在30 ℃下孵育12 h。 反應結束后加入0.2 mL 濃度為20 mmol/L 的HCl 于100 ℃下酸解1 h,釋放糖鏈與脂肪鏈Phytanol。 酸解產物12000 g 離心1 min,上清液通過1 mL 固相萃取填料Supelclean ENVICarb Slurry(Sigma)進行純化,糖鏈成分用3 mL 體積分數25%的乙腈洗脫后冷凍干燥。 最終得到的純化糖鏈溶解于40 μL 的純水中,通過超效液相色譜儀Dionex Ultimate 3000 UPLC(Thermo Scientific)自動進樣1 μL 到氨基色譜柱 (Waters Acquity UPLC BEH Amide Column 1.7 μm 2.1 mm×100 mm)中,乙腈線性梯度洗脫(溶液A: 乙腈;B: 水; 洗脫條件(體積分數): 0~2 min, 20% B;2~15 min, 20%~50%B;15%~18 min;50% B;流速: 0.2 mL/min)分離底物與產物。 流出液通過ESI-MS 儀器TSQ Quantum Ultra(hermo Scientific)步檢測相對分子質量(離子模式下掃描400~1600 m/z 范圍)
2結果與分析
2.1 重組蛋白Dpm1 的純化及活性檢測
基于多萜醇磷酸甘露糖(Dol-P-Man)在ER 糖基化4 種修飾中的重要作用, 本研究將利用酵母Dpm1 進行酶法合成, 并采用結構簡單的Phytanol(含有20 個碳),替代Dolichol(含有100 個碳以上)(圖1)。
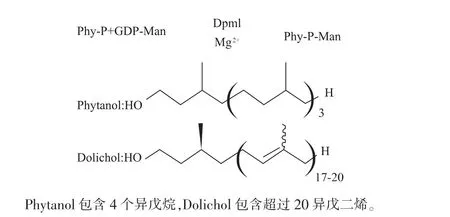
圖1 Dpm1 催化生產Phy-P-Man 的反應示意圖Fig. 1 Yeast Dpm1 catalyzes the transfer of mannose from GDP-Man to Phy-P to produce Phy-PMan
首先構建了原核表達質粒pET28a-Dpm1,轉入Rosetta DE3)大腸桿菌中,低溫過夜誘導。 誘導菌體破碎提取細胞膜成份,溶解于去污劑Triton X-100,利用鎳親和層析純化。 對500 mmol/L 咪唑洗脫液SDS-PAGE 分析,結果如圖2(a)顯示3×104左右,有一條明顯的條帶,與Dpm1 預期的大小相一致,成功實現了Dpm1 的純化。 接下來,利用純化的Dpm1催化Phy-P 與GDP-Man 形成Phy-P-Man。 如圖2(b)的TLC 結果所示,底物Phy-P 的比移值(Rf)為0.64(條帶1),在加入Dpm1 后Rf 變為0.58(條帶2)。Rf的降低是由于親水性的Man 基團加入到底物中形成了產物Phy-P-Man 導致極性變大,從而在展開劑中遷移率變慢。 此結果說明原核表達純化的Dpm1 活性很高, 能完全催化Phy-P 生成Phy-PMan。
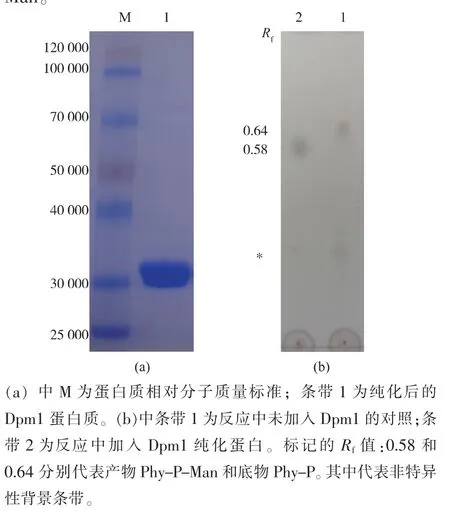
圖2 釀酒酵母Dpm1 的純化及活性檢測Fig. 2 Purification and activity detection of yeast Dpm1
2.2 Dpm1 的保守性模體 (motif) DXD 為活性所必須
前期的文章證明了Dpm1 的酶活依賴于Mg2+的加入[19-20]。 目前,大量的研究表明采用GT-A 方式折疊的糖基轉移酶含有DXD motif,2 個天冬氨酸能夠與Mg2+結合發揮催化功能[21]。 我們通過carbohydrate active enZyme(CAZy)數據庫檢索,Dpm1 屬于GT2類,采用GT-A 方式折疊(http://www. cazy.org)。 我們因此推測Dpm1 依賴于Mg2+的原因可能存在DXD motif。 接下來,對不同物種來源的Dpm1 進行序列比對,發現存在一個保守性的DXD motif(圖3(a)),在酵母Dpm1 的95-97 位氨基酸序列上。為了驗證酵母Dpm1 的DXD motif 的重要作用, 我們構建了D95A 和D97A2 個突變,在大腸桿菌中進行了純化(圖3(b)),并測定了它們的活性。 TLC 結果如圖3(c)所示,D95A(條帶1)和D97A(條帶2)相對于野生型(WT)完全喪失了活性,說明了DXD motif對Dpm1 活性的重要作用。更進一步地,與以前的報告一致, 當在野生型Dpm1 的反應中不加Mg2+同樣地喪失了活性(條帶3)。 因此,推測DXD motif 在Dpm1 的作用可能和別的GT-A 類糖基轉移酶一樣能夠與Mg2+結合參與催化功能。
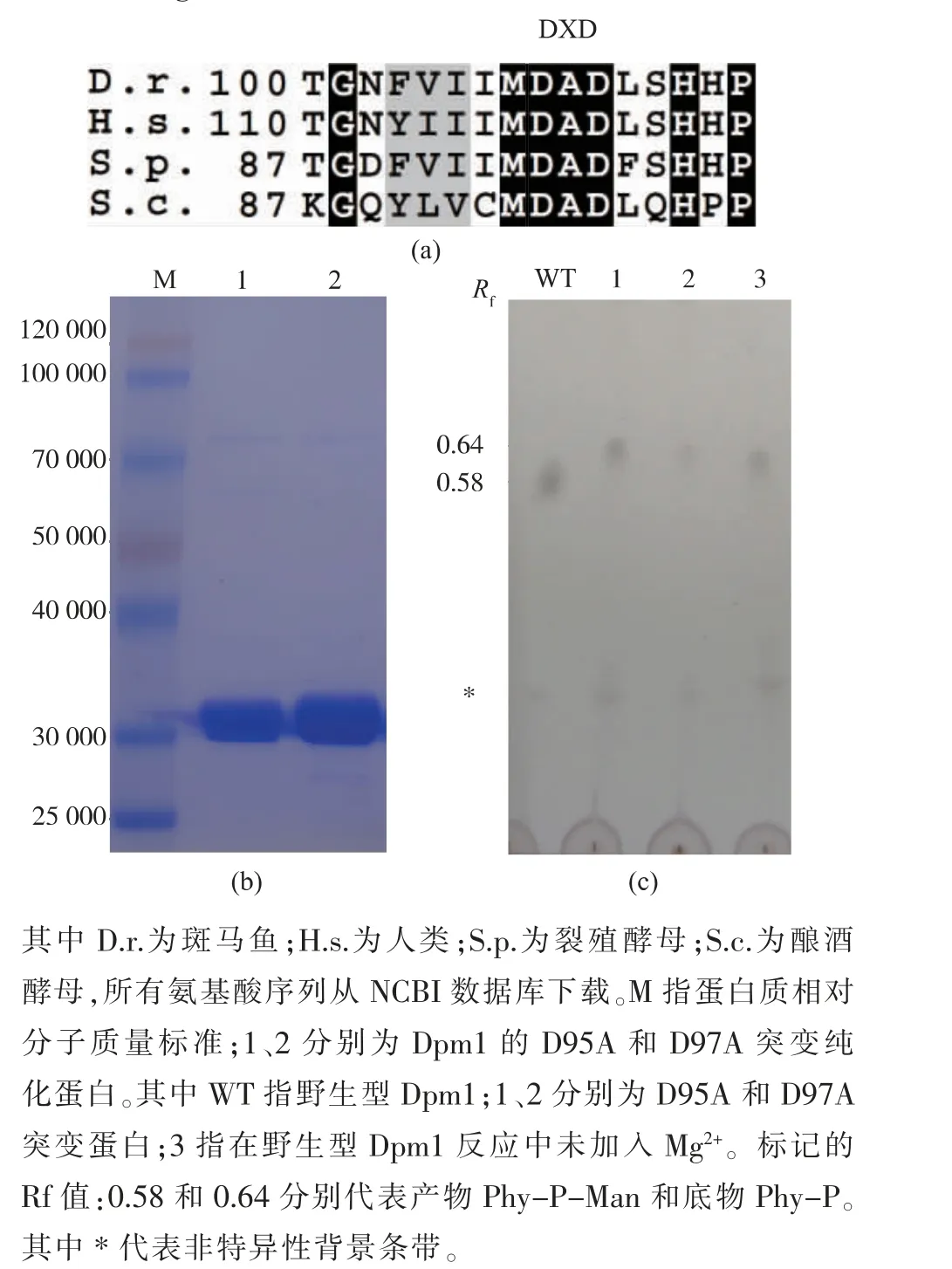
圖3 Dpm1 的DXD motif 突變蛋白的純化及活性檢測Fig.3 Purification and activity detection of Dpm1 mutants in DXD motif
2.3 Dpm1 的產物Phy-P-Man 能夠被糖基轉移酶Alg3 催化
通過純化的Dpm1 合成了Phy-P-Man,但能否替代Dol-P-Man 應用于ER 腔內的甘露糖基化修飾并不清楚。 為了弄清上述問題,選擇了N-糖基化途徑中以Dol-P-Man 為底物供體的酶Alg3 作為研究對象。 糖基轉移酶Alg3 能夠催化Dol-PPGlcNAc2 -Man5 和Dol -P -Man 生 成Dol -PP -GlcNAc2-Man6[22]。 為了驗證Alg3 能否以Phy-PMan 為底物供體,利用實驗室前期合成的Alg3 的替代底物Phy-PP-GlcNAc2-Man5(Phy-PP-M5),并表達Alg3 蛋白進行體外反應(圖4)。
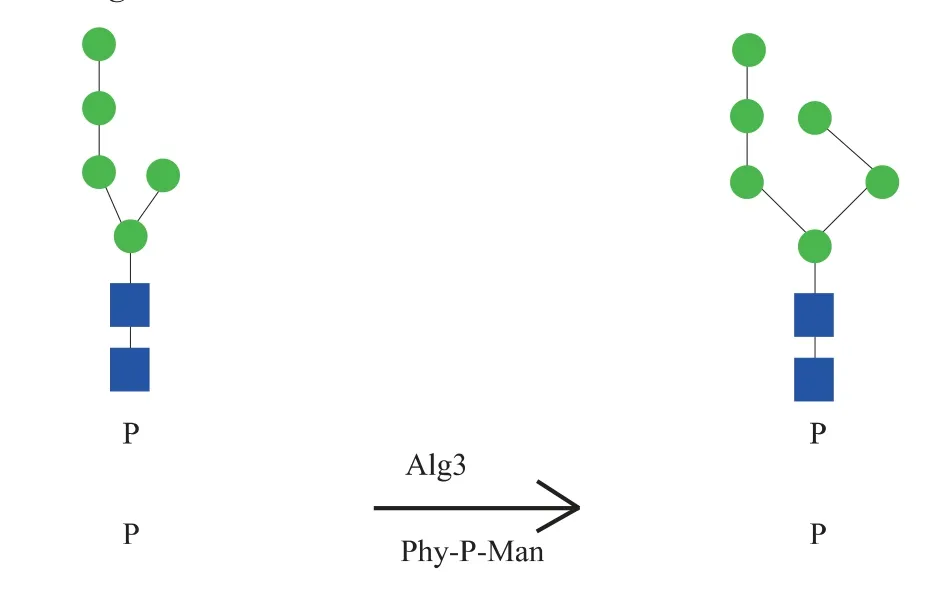
圖4 Alg3 催化Phy-PP-M5 與Phy-P-Man 生成Phy-PP-M6 的反應示意圖Fig. 4 Alg3 catalyzes the transfer of mannose from Phy-P-Man to Phy-PP-M5 to produce Phy-PP-M6
首先,嘗試原核表達釀酒酵母Alg3,由于Alg3為多跨膜域蛋白質,在大腸桿菌中容易降解,因此在N 端融合了促進真核膜蛋白表達的Mistic 標簽(M-Alg3)[15]。 圖5 的Western blotting 結果顯示相對于空載對照(條帶1)在6.5×104左右處,有一條明顯的條帶(條帶2),與M-Alg3 預期的大小相一致,從而證明M-Alg3 成功的在大腸桿菌中進行了表達。

圖5 酵母重組蛋白M-Alg3 的原核表達Western blotting 圖Fig.5 Western blot analysis of expression of yeast M-Alg3
接下來, 利用含有重組蛋白M-Alg3 的大腸桿菌膜成份催化Phy-PP-M5 與Phy-P-Man, 反應結束后酸解去掉脂肪鏈部分, 純化糖鏈后LC-MS 分析結果。 如圖6(a)所示,與空載大腸桿菌膜成份比較, 含有重組蛋白M-Alg3 的大腸桿菌膜成份催化后多了一組峰。 ESI-MS 確證了2 組峰分別起源于底物Phy-PP-M5 (14.6,14.8) 和產物Phy-PP-M6(15.4,15.5)(圖6(b))。 綜上證明Phy-P-Man 能夠被Alg3 所催化應用到N-糖基化途徑研究。
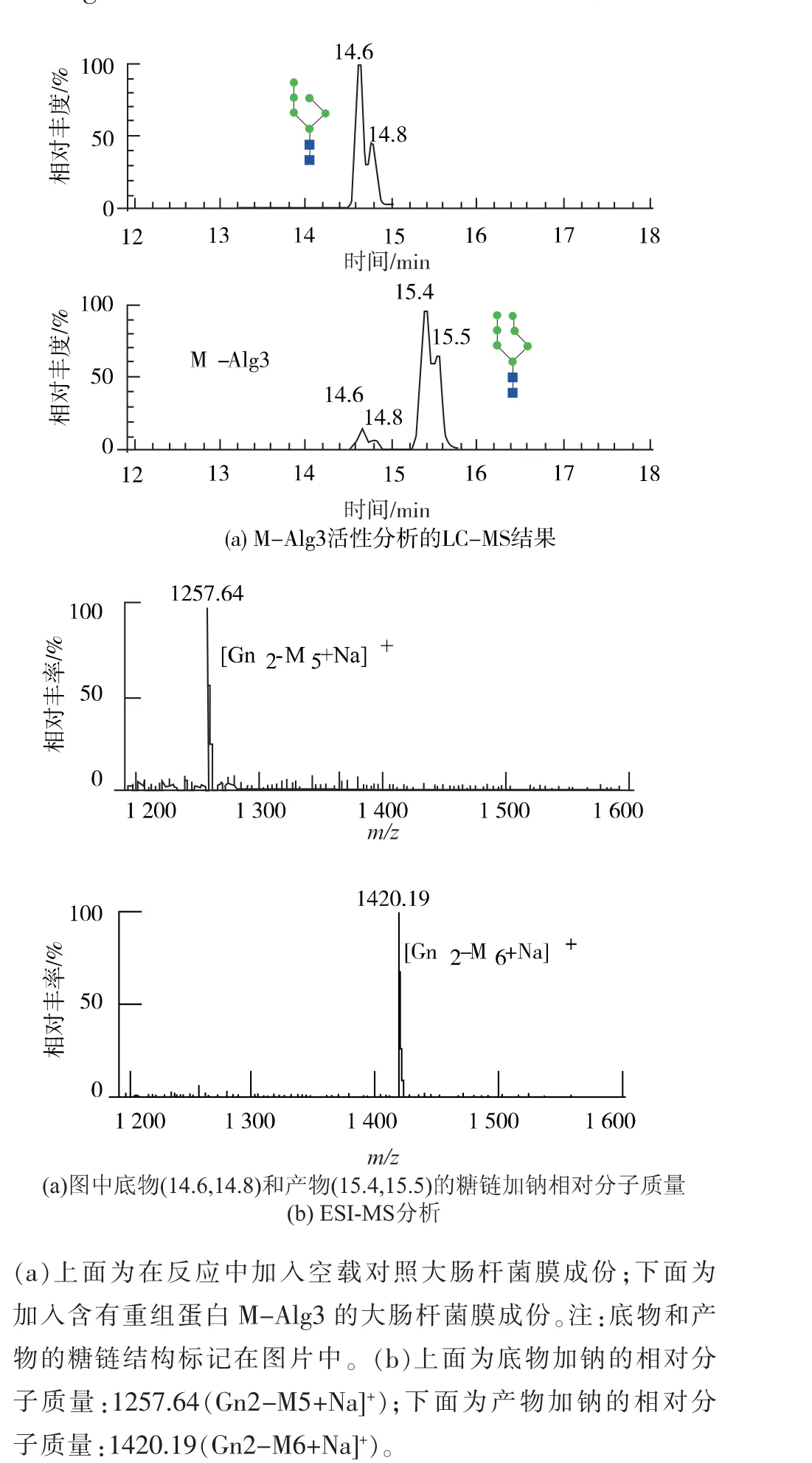
圖6 Phy-P-Man 用于重組蛋白M-Alg3 的催化反應Fig. 6 Activity detection of recombinant M-Alg3 using Phy-P-Man as a donor
3結 語
Dpm1 為所有真核生物的必須基因,人體Dpm1發生突變會導致嚴重的先天性糖基化缺陷綜合癥(CDG)[23]。 本研究獲得了純化的酵母Dpm1 蛋白,并鑒定了重要的DXD motif, 有可能跟Mg2+結合參與催化。 未來的研究將利用純化的蛋白質,獲得Dpm1蛋白的晶體結構,解釋其催化機制,更重要的是,結構信息的獲得對于理解CDG 發病的分子機制具有重要的意義。 另外, 本研究中通過Dpm1 將Phy-P與GDP-Man 催化合成了Phy-P-Man。 Phy-P-Man相對于天然結構Dol-P-Man 具有結構簡單,水溶性好等優點, 并且Phy-P-Man 能夠被Alg3 所催化應用到N-糖基化途徑研究。 另外,N-糖基化途徑中Alg3 反應后,Alg9 和Alg12 催化的后三步的反應形成高甘露糖結構(Dol-PP-M9) 也是以Dol-P-Man為底物供體[2]。 接下來的研究將進一步地以Phy-PMan 為底物供體期望能夠體外合成Phy-PP-M9 結構。 同樣的,Phy-P-Man 將來也可應用于GPI 錨定化、O-及C-甘露糖基化的研究。 特別是在人體中ER 腔內的甘露糖基化修飾途徑中的酶發生突變將會導致嚴重的先天性糖基化缺陷綜合癥 (CDG)[24],我們合成的Phy-P-Man 作為這些酶的底物,將會應用于對CDG 相關突變酶的活性檢測乃至開發出衡量疾病嚴重程度的定量方法。

