萬壽菊懸浮培養細胞生產游離葉黃素工藝的研究
徐曉輝,王莉潔,孫丹,郭健
(1.遼寧何氏醫學院健康營養學院,遼寧沈陽 110163;2.遼寧何氏醫學院藥學院,遼寧沈陽 110163)
天然產物及其衍生物的使用存在嚴重的供應問題[1]。在許多情況下,當某種植物成為一種商業化草藥或者其中某個成分開始用于制藥時,由于大規模的野外采伐和不可持續的采收技術,使其數量受到威脅[2]。雖然栽培作為一種可持續的方法可以替代野外采伐,但在50 000種藥用植物中,有2/3依然來自野外采收,使得4 000~10 000種藥用植物瀕臨滅絕[3]。此外,植物來源的化合物結構比較復雜,多數情況下不具備利用化學合成生產的經濟可行性[4]。
植物細胞懸浮培養提供了另外一種獲得藥用化合物的方式[5]。利用植物細胞培養技術生產次生代謝產物的優勢主要表現在:(1)是一個連續生產系統,不受環境條件影響和限制;生產是在限定的可控條件下完成的,無農用化學品,可以更好地控制產品的產量和質量;(2)生物量積累迅速,目標化合物產率高;(3)下游分離、純化過程簡單,減少了有害溶劑的使用,更加環境友好[6]。迄今為止,已經有17種藥用化合物可以利用植物細胞培養技術進行商業化生產,其中大規模生產的主要有:來自紫草(Lithospermum erythrorhizon)的抗炎藥物紫草素;來自短葉紅豆杉(Taxus brevifolia)的抗癌藥物紫杉醇;來自人參(Panax ginseng)并具有心臟保護作用的人參皂甙[7]。
葉黃素經常用作改善眼部健康的補充劑,能夠預防和改善年齡相關性黃斑變性和白內障[8],但是人體不能合成葉黃素,完全依賴于從飲食中攝取來滿足對葉黃素的需求[9]。目前,商業化生產的葉黃素主要提取自萬壽菊(Tagetes erecta L.)的花瓣[10]。然而,從萬壽菊的花瓣中提取來生產葉黃素會受到鮮花的季節性供應、土地需求大、需要大量技術工人以及葉黃素含量低等因素限制[11]。此外,萬壽菊中葉黃素有兩種存在形式,分別為游離葉黃素和葉黃素酯,其中葉黃素酯占80%~100%[12],葉黃素酯必須經過皂化反應除去脂肪酸,才能得到游離葉黃素[13],提取和純化過程比較復雜。基于上述限制性因素,迫切需要建立新的葉黃素來源,用于其商業化生產,以滿足日益增長的市場需求。
在前期研究中,以萬壽菊花瓣為外植體構建得到能夠生產游離葉黃素的萬壽菊懸浮培養細胞系,并建立了培養細胞中葉黃素的超高效液相色譜分析方法[14]。因此通過考察細胞培養條件以及誘導子等對培養細胞中葉黃素合成的影響,建立懸浮培養細胞生產葉黃素的生產工藝,為下一步中試放大培養打下基礎。
1 材料與方法
1.1 儀器與試劑
超高效液相色譜儀(ACQUITYTMUPLC,Waters,美國);純水/超純水一體化系統(MING-CHE 24UV,Merck Millipore,法國);超聲波清洗器(KQ3200E,昆山市超聲儀器有限公司);冷凍離心機(5430R,Eppendorf AG,德國);旋轉蒸發器(RE-52AA,上海亞榮生化儀器廠);移液器(Research?plus,Eppendorf AG,德國)。
葉黃素(Sigma-Aldrich,美國);乙腈(HPLC級,Sigma-Aldrich,美國);甲醇(HPLC級,Fisher Scientific,美國);甲醇(分析純,國藥集團化學試劑有限公司);水楊酸(分析純,天津市科密歐化學試劑有限公司);茉莉酸甲酯(Sigma-Aldrich,美國)。
1.2 色譜條件[14]
色譜柱:Waters ACQUITY UPLC?BEH C18色譜柱(50 mm×2.1 mm,1.7 μm);流動相:A為乙腈-甲醇(90∶10,v/v),B為水;梯度洗脫程序:0.0~2.5 min,90%A;2.5~3.0 min,90%~100% A;3.0~6.0 min,100% A;6.0~6.5 min,100%~90% A;6.5~9.5 min,90% A。柱溫:25 ℃;流速:0.4 mL/min;進樣體積:5 μL;檢測波長:448 nm。
1.3 萬壽菊懸浮培養細胞
萬壽菊懸浮培養細胞所用的培養基為MS(Murashige and Skoog,1962)基礎培養基,添加1 mg/L NAA(1-Naphthaleneacetic acid),1 mg/L KT(kinetin),30 g/L蔗糖。用1 mol/L NaOH將培養基的pH值調到5.8,然后116 ℃滅菌30 min。細胞每兩周繼代培養一次,接種密度為75 g/L。所用搖瓶為100 mL,內裝20 mL培養基。搖瓶以雙層鋁箔紙封口,置于100 r/min的搖床上光照培養,溫度為25 ℃,光照強度為8 000 Lx,光照時間為24 h/d。
1.4 細胞生物量的測定方法
1.4.1 細胞鮮重
將細胞樣品倒入布氏漏斗中,減壓抽濾除去培養基,用去離子水清洗至少3次后稱重,所得為細胞鮮重(Fresh cell weight)。
1.4.2 細胞干重
減壓抽濾后的細胞樣品置于冷凍干燥機中冷凍干燥48 h至恒重,然后稱重,所得為細胞干重(Dry cell weight)。
1.5 誘導子溶液的配制及添加方法
將茉莉酸甲酯(MJA)和水楊酸(SA)分別溶于無水乙醇中,配制成儲備液。在生物安全柜內,經0.22 μm微孔濾膜注射過濾除菌后,添加到細胞培養基中。
1.6 培養時間對細胞生長和游離葉黃素生產的影響
分別于細胞生長的第0 d、3 d、7 d、10 d、14 d、17 d、21 d、24 d和28 d取樣,測定細胞鮮重和細胞干重,并利用UPLC測定細胞中游離葉黃素的含量,計算培養細胞中游離葉黃素的體積產率。
1.7 誘導子對細胞生長和游離葉黃素生產的影響
于細胞生長的第7 d,在懸浮培養細胞液體培養基中分別添加終濃度為10 μmol/L的水楊酸以及10 μmol/L的茉莉酸甲酯,在細胞生長的第14 d收獲細胞,測定細胞鮮重、細胞干重以及細胞中游離葉黃素的含量,計算細胞中游離葉黃素的體積產率。
1.8 光照對細胞生長和游離葉黃素生產的影響
將培養細胞分成兩組,其中一組按照1.3中所述方法進行光照培養;另一組進行暗培養,其它培養條件均完全相同。培養第14 d收獲細胞,測定細胞鮮重、細胞干重以及細胞中游離葉黃素的含量,計算細胞中游離葉黃素的體積產率。
2 結果與討論
2.1 細胞生長曲線
植物細胞的生長一般可分為以下4個階段:延滯期(Lag phase)、指數期(Exponential phase)、穩定期(Stationary phase)和衰亡期(Decline phase)。萬壽菊懸浮培養細胞的生長曲線如圖1所示。可以看出,對于萬壽菊懸浮培養細胞,細胞鮮重和細胞干重的積累表現出基本相同的規律。第0~3 d為延滯期,在此階段,細胞剛剛轉入新鮮培養基,還處在適應階段,逐漸恢復分裂能力。第3~14 d為指數期,細胞一方面通過分裂,實現細胞數目的增多;另一方面,通過細胞體積的增大,最終實現細胞生物量的快速積累。第14~21 d為穩定期,細胞生長速率下降,新生的細胞數和死亡的細胞數相當,細胞數達到最大值。第21~28 d為衰亡期,細胞停止生長和分裂,開始衰老和死亡。
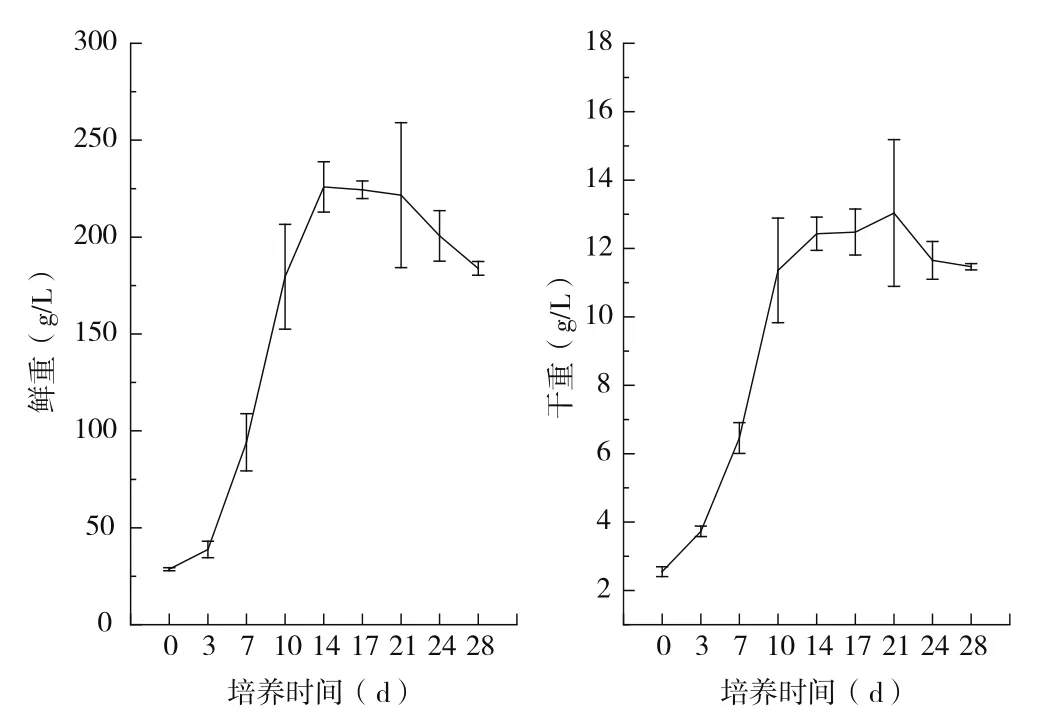
圖1 萬壽菊懸浮培養細胞的生長曲線
在細胞生長的第14 d,細胞鮮重達到最大值;在細胞生長的第21 d,細胞干重達到最大值,為13.04±2.15 g/L。鑒于培養細胞從14 d進入穩定期,且就細胞干重而言,經統計學分析,第14 d、17 d以及21 d,無顯著性差異。考慮生產成本和發酵周期,以懸浮培養細胞生物量為參數時,培養細胞收獲的最佳時間為細胞生長的第14 d。在細胞生長的第14 d,細胞鮮重為225.86±12.99 g/L,為第0 d的7.9倍;細胞干重為12.43±0.49 g/L,為第0 d的4.9倍。
2.2 細胞中游離葉黃素的生產曲線
萬壽菊懸浮培養細胞中游離葉黃素的生產曲線如圖2所示。萬壽菊懸浮培養細胞中游離葉黃素的積累和細胞生物量的積累(細胞干重)具有相同的規律,幾乎完全吻合。這表明,萬壽菊懸浮培養細胞生產游離葉黃素和細胞生長是偶聯的。基于此,在下一步中試放大培養階段,可以通過細胞的高密度培養,實現細胞生物量的快速積累,進而實現高產游離葉黃素。
萬壽菊培養細胞生產游離葉黃素,在細胞生長的第14 d,開始進入穩定期,一直持續到第24 d,然后游離葉黃素的產率開始下降。游離葉黃素的產率在細胞生長的第21 d達到最大值,體積產率為1.57±0.52 mg/L。同細胞生長曲線一樣,經統計學分析,葉黃素產率在細胞生長的第14 d、17 d、21 d以及24 d,無顯著性差異。考慮生產成本和生產周期,培養細胞生產游離葉黃素時,細胞收獲的最佳時間為細胞生長的第14 d。在細胞生長的第14 d,游離葉黃素產率為1.29±0.09 mg/L,為第0 d的8.48倍。
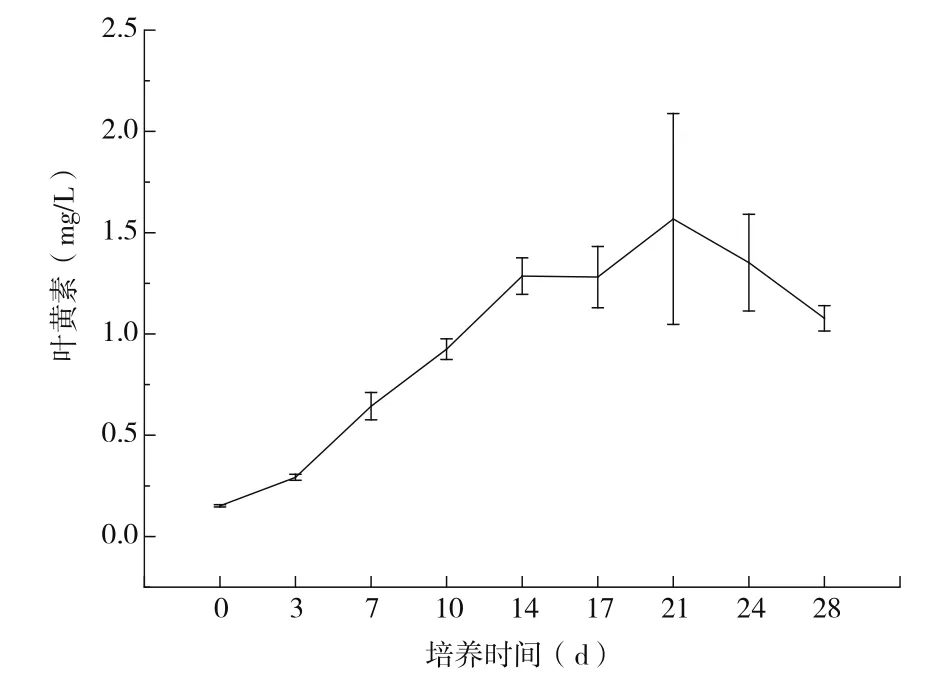
圖2 萬壽菊懸浮培養細胞中游離葉黃素的生產曲線
2.3 誘導子對細胞生長和游離葉黃素生產的影響
分別添加誘導子茉莉酸甲酯(MJA)和水楊酸(SA)對萬壽菊懸浮培養細胞生長的影響如圖3所示。添加茉莉酸甲酯和添加水楊酸的兩個處理組之間,細胞鮮重接近,且均低于對照組細胞,處理組與對照組均無顯著性差異;而對于細胞干重而言,對照組細胞與處理組細胞,3組值都接近,且無顯著性差異。上述結果表明,以茉莉酸甲酯或者以水楊酸作為誘導子添加,對萬壽菊懸浮培養細胞生長均無顯著性影響。
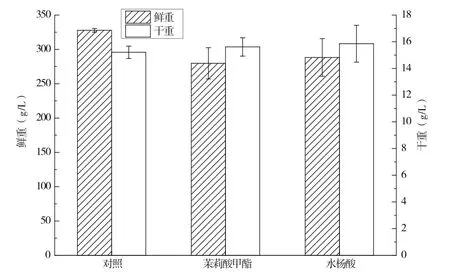
圖3 茉莉酸甲酯和水楊酸對萬壽菊懸浮培養細胞生長的影響
分別添加誘導子茉莉酸甲酯和水楊酸對萬壽菊懸浮培養細胞生產游離葉黃素的影響如圖4所示。由圖4可知,添加茉莉酸甲酯組細胞中游離葉黃素的產率與對照組細胞產率接近,無顯著性差異,但兩者均高于添加水楊酸組細胞中游離葉黃素的產率。上述結果表明,以茉莉酸甲酯或者以水楊酸作為誘導子,對萬壽菊懸浮培養細胞生產游離葉黃素無顯著性促進作用。
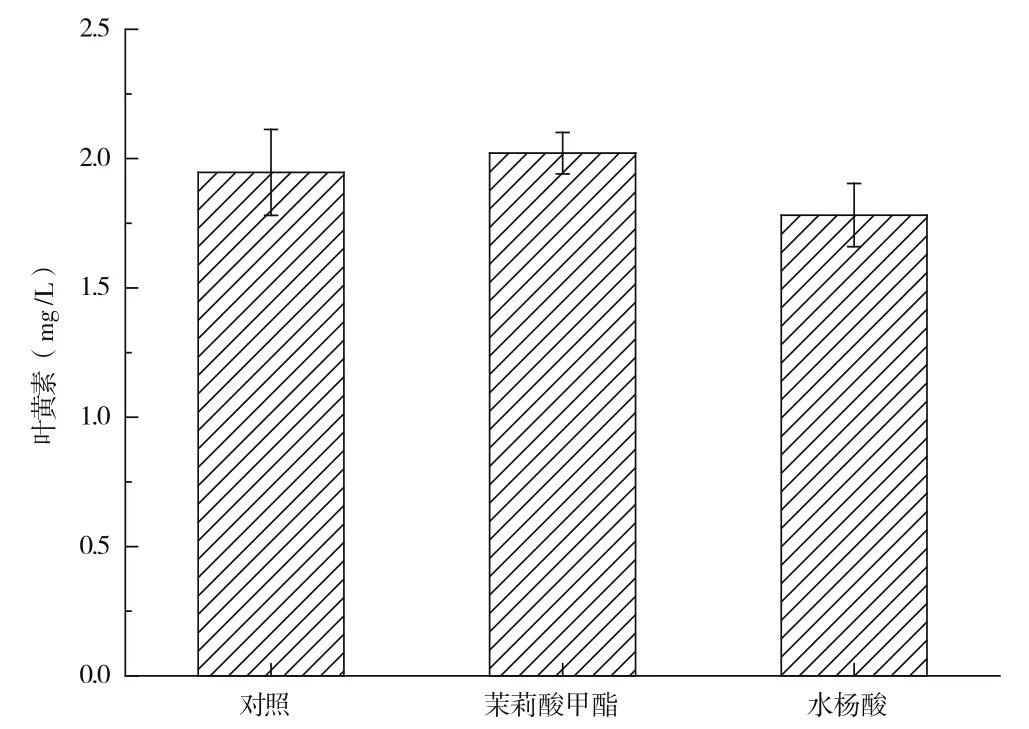
圖4 茉莉酸甲酯和水楊酸對游離葉黃素生產的影響
2.4 光照對細胞生長和游離葉黃素生產的影響
光照培養、暗培養以及暗培養添加茉莉酸甲酯3種培養條件下,萬壽菊懸浮培養細胞生長情況如圖5所示。由圖5可知,就細胞鮮重而言,光照組細胞最高,且與暗培養細胞之間為顯著性差異,而暗培養添加茉莉酸甲酯組細胞鮮重最低,細胞干重亦顯示出相同的規律,說明暗培養以及暗培養添加茉莉酸甲酯抑制細胞生長。上述結果表明,光照對于萬壽菊懸浮細胞生長具有顯著促進作用。
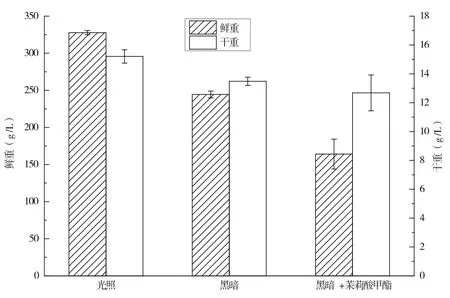
圖5 光照對萬壽菊懸浮培養細胞生長的影響
光照培養、暗培養以及暗培養添加茉莉酸甲酯3種培養條件下,萬壽菊懸浮培養細胞生產游離葉黃素的情況如圖6所示。由圖6可知,3組細胞中游離葉黃素的產率以光照培養組細胞中最高,達到1.95±0.17 mg/L,而暗培養組細胞中游離葉黃素的產率僅為0.34±0.02 mg/L,暗培養添加茉莉酸甲酯組細胞中游離葉黃素產率為0.32±0.01 mg/L。光照培養組細胞中游離葉黃素產率為暗培養組細胞產率的5.7倍;光照培養組細胞游離葉黃素產率為暗培養添加茉莉酸甲酯組細胞產率的6.1倍。上述結果表明,光照對于萬壽菊懸浮培養細胞生產游離葉黃素具有顯著促進作用。推測這可能與葉黃素是光合色素有關。同時,暗培養條件下,茉莉酸甲酯對培養細胞生產葉黃素無顯著性影響。
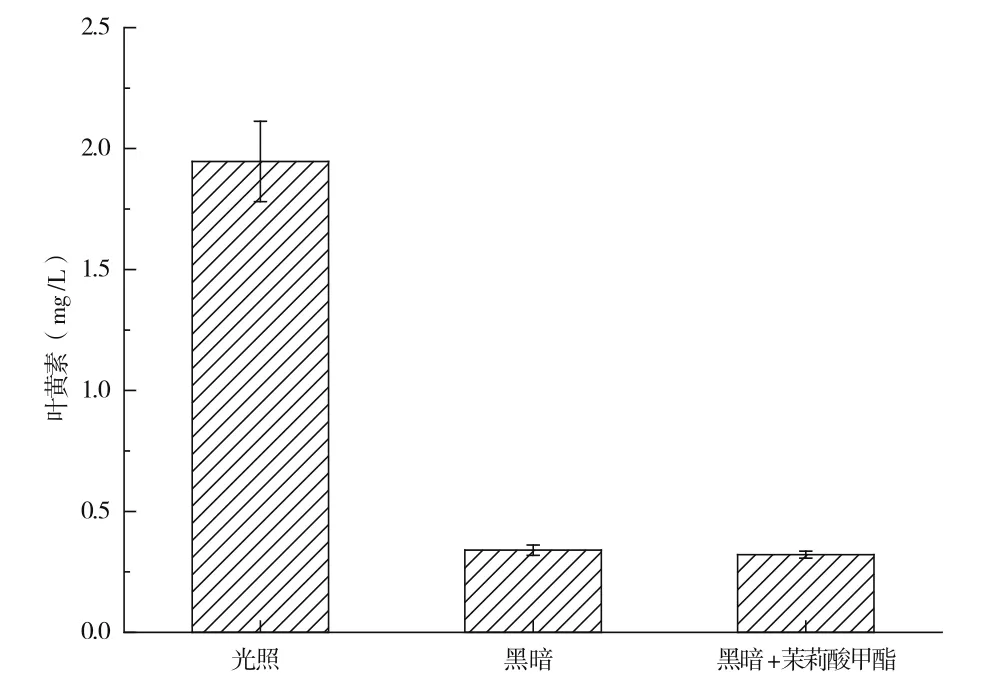
圖6 光照對游離葉黃素生產的影響
3 結論
通過建立萬壽菊懸浮培養細胞生產游離葉黃素的工藝,發現細胞最佳收獲時間為生長的第14 d,此時為穩定期。萬壽菊懸浮培養細胞生產游離葉黃素和細胞生長是偶聯的,可以通過培養細胞的高密度培養,實現細胞生物量的快速積累,進而實現高產游離葉黃素,這對于下一步中試放大培養意義重大。光照是葉黃素合成的關鍵因素,能夠顯著促進培養細胞生長和生產游離葉黃素。茉莉酸甲酯和水楊酸不能促進培養細胞中游離葉黃素的合成。在暗培養條件下,茉莉酸甲酯不能替代光照誘導游離葉黃素的合成。
未來需根據葉黃素的生物合成途徑,選擇合適的方法實現有效的過程調控。同時,運用分子生物學技術對合成途徑中的關鍵酶等進行改造,以實現反應器放大培養階段葉黃素的穩產和高產。

