農桿菌介導轉化木霉原生質體的研究
顧斌濤,熊大維
(江西省科學院微生物研究所,江西南昌 330096)
根癌農桿菌(Agrobacterium tumefaciens)是一種存在于土壤中的革蘭氏陰性菌,在自然條件下能感染植物的受傷部位,可以轉移腫瘤誘導質粒的片段T-DNA(Transfer DNA)導入到植物基因組中。根癌農桿菌介導轉化法不僅用于植物的轉化,而且能用于酵母、曲霉、木霉和蘑菇等真菌的轉化,根癌農桿菌介導轉化法比傳統聚乙二醇介導的原生質體轉化法效率更高[1-4]。
里氏木霉(Trichoderma reesei)是工業上重要的產酶菌種,其在纖維素基質上生長迅速、培養簡便,發酵工藝成熟,胞外分泌蛋白能力強,產物分離成本低,在產酶條件下不產生毒素,具有良好的安全性[5]。里氏木霉具有纖維二糖水解酶基因的強啟動子,大量同源或異源的酶基因在里氏木霉中獲得表達并應用于工業生產[6-7]。用里氏木霉作為宿主菌進行基因工程改造越來越受到重視,目前對里氏木霉進行轉化效率較高的方法為根癌農桿菌介導轉化法[8]。一般研究常用里氏木霉的分生孢子作為其轉化受體細胞,本研究利用里氏木霉的原生質體作為轉化受體材料,以期提高根癌農桿菌介導轉化的效率,方便對里氏木霉遺傳改造時進行大通量的篩選。
1 材料與方法
1.1 試驗材料
菌株:里氏木霉H7和根癌農桿菌AGL-1為實驗室保存。
質粒:pCAM-pht01為實驗室保存,根癌農桿菌轉化載體,含潮霉素基因表達盒。
PDA培養基:稱取PDA干粉(英國Oxoid公司CM0139)39 g,加入1 L去離子水,攪拌至樣品分散,高壓蒸汽滅菌后傾注平板。
PDA抗性培養基:PDA培養基中加入潮霉素B(150 μg/mL)和頭孢霉素(400 μg/mL)。
IM培養基:取1.25 mol/L磷酸緩沖液800 μL,MgSO4-NaCl緩沖液 20 mL,10 mg/mL CaCl2·2H2O溶液1 mL,1 mg/mL FeSO4·7H2O溶液1 mL,微量元素溶液5 mL,200 mg/mL NaNO3溶液2 mL,50%甘油10 mL,1 mol/L MES溶液40 mL,200 mg/mL葡萄糖溶液5 mL,混勻后加入900.7 mL無菌水[9-10]。
1.2 試驗方法
1.2.1 根癌農桿菌感受態的制備
將根癌農桿菌接至含60 μg/mL利福平的LB液體培養基,28 ℃、180 r/min培養48 h,按接種量為10%轉接至LB液體培養基中,28 ℃、180 r/min培養至OD600達到0.6左右。將菌液分裝并冰浴15 min,離心棄上清。將根癌農桿菌重懸于500 μL預冷的0.1 μmol/L MgCl2溶液,冰浴10 min。離心棄上清,加入100 μL預冷的0.02 μmol/L的CaCl2溶液重懸菌液,冰浴20 min。
1.2.2 質粒導入根癌農桿菌
在農桿菌中加入5 μL的質粒輕輕混合,冰浴15 min后放入液氮冷凍1 min。冷凍后在37 ℃的水浴中放置3 min,再立即冰浴2 min,加入450 μL的LB液體培養基。在100 r/min和28 ℃的搖床上孵育3 h。然后4 000 r/min離心3 min。棄去約400 μL上清,剩下的液體與菌體沉淀混合,涂布至LB固體抗性平板。在28 ℃條件下培養至轉化子長出。
1.2.3 根癌農桿菌介導轉化里氏木霉
根癌農桿菌接LB液體培養基(含利福平25 μg/mL和卡那霉素60 μg/mL)培養36 h;離心收集菌,用IM液體培養基重懸菌至OD660為0.15,添加乙酰丁香酮400 μmol/L,鋁膜避光,在28 ℃和180 r/min的搖床培養至OD660為0.5左右。
里氏木霉接到PDA平板上28 ℃培養7 d,用無菌水從平板上洗下木霉孢子,過濾得孢子液。血球計數板對孢子計數,8 000 r/min離心2 min,棄去上清,用無菌生理鹽水調節孢子液的濃度到106個/mL。
取上述根癌農桿菌和里氏木霉孢子液按體積1∶1混合,然后涂布在IM平板的硝酸纖維素膜上,暗處共培養。將硝酸纖維素膜反鋪到含150 μg/mL潮霉素B和400 μg/mL頭孢霉素的PDA抗性平板上,30 ℃培養至里氏木霉轉化子長出。
2 結果與分析
2.1 根癌農桿菌的濃度對轉化效率的影響
根癌瘤農桿菌介導轉化不同宿主菌的能力不同,過高或過低的農桿菌濃度對轉化效率有直接的影響,一般處于對數生長期的農桿菌轉化能力較強,實驗選擇不同濃度的農桿菌(OD660=0.4~1.0)進行研究,結果(圖1)表明根癌農桿菌的濃度對轉化效率有顯著的影響,根癌農桿菌OD660為0.8時的轉化效率最高,當OD660超過0.8時,轉化效率反而降低,可能由于過高的菌濃使得培養基中營養不足,降低了農桿菌的介導能力。因此實驗最適宜的根癌農桿菌菌液OD660為 0.8。

圖1 根癌瘤農桿菌濃度對轉化效率的影響
2.2 乙酰丁香酮濃度對轉化效率的影響
乙酰丁香酮是一種由受傷植物產生的酚類物質,在遺傳轉化中誘導能力較強,其作用機制在于能誘導農桿菌轉化相關基因的轉錄和表達,刺激腫瘤誘導質粒的T-DNA轉移并整合到植物或真菌細胞的基因組中。使用不同濃度的乙酰丁香酮進行農桿菌和木霉的共培養,結果如圖2所示。乙酰丁香酮濃度對轉化效率的影響是顯著的,在一定范圍內,隨乙酰丁香酮濃度的增加轉化效率也增加。但過高濃度的乙酰丁香酮影響了轉化效率。當乙酰丁香酮濃度80 μg/mL時,轉化效率最高,因此后續實驗采用乙酰丁香酮濃度為80 μg/mL。
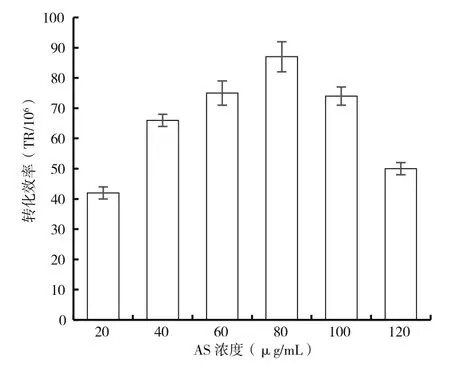
圖2 乙酰丁香酮濃度對轉化效率的影響
2.3 共培養時間對轉化效率的影響
研究不同共培養時間對轉化效率的影響,結果顯示(圖3)共培養12 h時沒有獲得轉化子,隨著共培養時間的延長,轉化效率逐漸提高,共培養48 h轉化率最高。共培養時間過長時,轉化效率反而有些下降,這可能是農桿菌過度生長,一方面消耗了培養基的營養,另一方面在后續培養中產生物理屏障,限制了木霉菌的生長。另外,過長的共培養時間可能導致轉化子菌落會相互重疊,給下一步的篩選帶來困難,因此共培養時間選擇48 h為宜。
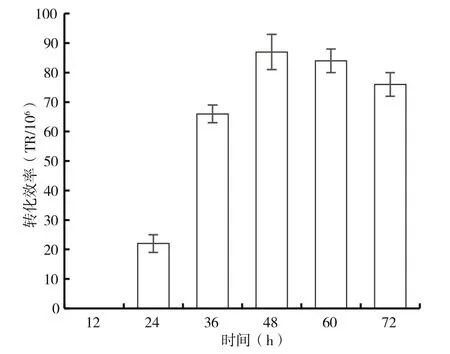
圖3 共培養時間對轉化效率的影響
2.4 共培養溫度對轉化效率的影響
共培養溫度對農桿菌介導轉化有一定的影響,采用 20 ℃、22 ℃、24 ℃、26 ℃、28 ℃和 30 ℃進行實驗,如圖4的結果顯示,在一定溫度范圍內,轉化效率隨著溫度的上升而增加,當溫度24 ℃時轉化效率最高,當溫度過高時,轉化效率隨著溫度的上升而下降。可能由于低溫影響了里氏木霉和農桿菌的生長,高溫影響了農桿菌介導轉化過程中的T-DNA轉移機制。因此實驗選取共培養溫度為24 ℃。
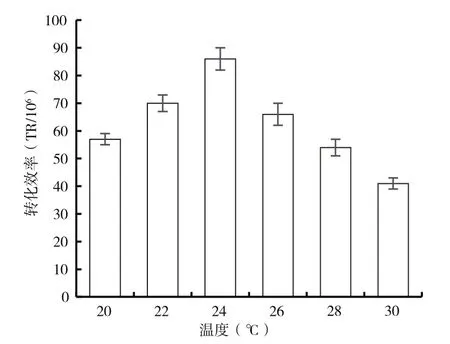
圖4 共培養溫度對轉化率的影響
2.5 共培養pH對轉化效率的影響
共培養基的pH對菌體的生長和代謝有很大的影響,使用根癌農桿菌介導轉化一般需要較低的pH值。采用不同的共培養基pH進行實驗,圖5的結果顯示,當共培養基pH為5.2~5.6,具有較高的轉化效率,其中以pH在5.4時轉化效率最高,達到87個轉化子(每106個細胞),是以孢子為受體(轉化效率46個轉化子/106個孢子)的1.9倍[11]。
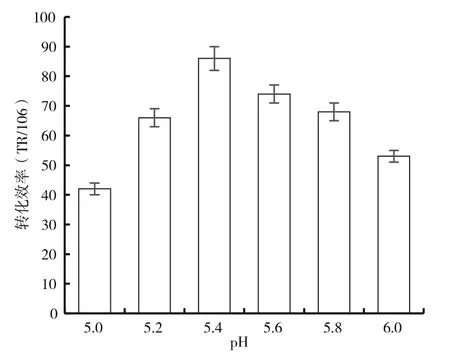
圖5 共培養pH對轉化率的影響
3 討論與結論
絲狀真菌在生產有機酸、抗生素、酶制劑及藥物活性物質中發揮著重要的作用。作為異源蛋白表達的細胞工廠,絲狀真菌具有蛋白分泌能力強、營養需求低、翻譯后修飾加工和產物分離成本低等優勢。絲狀真菌有著良好的生物安全性,黑曲霉、里氏木霉和米曲霉等已在食品行業有長期應用。里氏木霉是生產工業酶制劑的重要菌株,本身能分泌大量的纖維素酶,其纖維素酶酶系組成較為齊全,通過遺傳改造里氏木霉進行同源或異源表達的研究越來越受重視。本研究利用里氏木霉的分生孢子作為其根癌農桿菌介導轉化的受體細胞,獲得轉化的適宜條件為:根癌農桿菌菌液OD660為0.8,乙酰丁香酮濃度為80 μg/mL,共培養時間選擇48 h,共培養溫度為24 ℃,共培養基pH在5.4。在此條件下,根癌農桿菌介導轉化的效率達87個轉化子(每106個細胞),高于傳統以分生孢子作為受體細胞的轉化效率。

