重組蛋白牛防御素5微球對BCG免疫小鼠的影響
劉一朵 , 于國際 , 張 碩 , 梁正敏 , 孫星雅 , 趙德明 , 周向梅
(1.中國農業大學動物醫學院 , 北京 海淀 100193 ; 2. 北京市動物疫病預防控制中心 , 北京 大興 102629)
據統計,2018年全球新增約50萬利福平耐藥結核病病例(其中78%為耐多藥結核病)[1]。牛結核病是一種由牛分枝桿菌(Mycobacteriumbovis,M.bovis)引起的人獸共患病,在很多發展中國家,其仍是人類健康的巨大威脅之一。而已有共識認為卡介苗(Bacilli-calmette-guerin,BCG)對于兒童抗結核具有有效的保護作用,但隨著年齡的增長保護效果逐漸減弱乃至消失[2]。因此,亟需開發新型抗結核藥物或者有效的疫苗策略。
牛防御素5(Bovine neutrophils β-defensins 5,BNBD5)為一種牛源β-防御素類抗菌肽,已證實其在體外有直接抗分枝桿菌活性,本實驗室前期已成功構建表達重組蛋白BNBD5的畢赤酵母菌株[3]。聚乳酸-羥基乙酸(Poly lactic-co-glycolicacid,PLGA)作為一種由乳酸和乙醇酸共聚而成的無刺激、無毒的高分子聚合物,不僅生物相容性好,而且可在體內降解,是一種綠色高分子材料[4]。
本試驗將獲得的牛防御素5作為模型藥物,以PLGA為載體材料,制備牛防御素5-聚乳酸-羥基乙酸緩釋微球(BNBD5-PLGA),進行動物試驗觀察其對BCG免疫小鼠的影響。
1 材料與方法
1.1 試驗材料
1.1.1 菌株及實驗動物 已插入重組質粒mBNBD5-pPIC9K的畢赤酵母菌株GS115、NTSE-2(牛分枝桿菌M.bovis)菌以及BCG,均由中國農業大學國家動物海綿狀腦病實驗室保存;7~8周齡的SPF級BALB/c雌性小鼠,購自北京維通利華實驗動物技術有限公司。
1.1.2 主要試劑與材料 PLGA(美國Sigma公司);鼠抗6×His·tag單克隆抗體和羊抗鼠單克隆抗體(Solarbio公司);ELISA試劑盒(Neobioscience公司);二氯甲烷、乙酸乙酯、聚乙烯醇;抗酸染色試劑盒(Solarbio公司);7H9、7H11 Middiebrook系列培養基和OADC增菌液(BD Biosciences公司)。
1.2 方法
1.2.1 重組蛋白牛防御素5(BNBD5)純化表達及鑒定 根據實驗室已建立的方法,表達和純化重組蛋白BNBD5[3]。鑒定蛋白BNBD5,進行Tricine-SDS-PAGE凝膠電泳,并進行Western Blot檢測,將凝膠轉到PVDF膜上,后于5%脫脂奶粉室溫下孵育1 h,洗滌,鼠抗6×His·tag單克隆抗體4 ℃搖床孵育過夜,羊抗鼠單克隆抗體37 ℃孵育1 h,洗滌后曝光采集圖像。
1.2.2 BNBD5-PLGA微球的制備 稱取0.163 g PLGA,溶于4.5 mL乙酸乙酯,振蕩混勻直至完全溶解,向其中加入0.5 mL蛋白溶液;將上一步制得的溶液在冰浴條件下超聲乳化制備初乳,超聲條件為40 W, 4 min,工作2 s,停止3 s;制備預復乳,將初乳倒入10 mL的1%PVA溶液中,冰浴條件下超聲乳化,超聲條件為40 W,6 min,工作2 s,停止3 s;將制得的預復乳倒入10 mL的0.5%PVA溶液中,制得復乳;室溫攪拌4 h,揮發油相;離心,蒸餾水洗滌2次, 4 ℃保存隔天即用或真空冷凍干燥機干燥得微球粉末。
1.2.3 小鼠免疫 將SPF級小鼠隨機分為5組,分別為正常對照組(8只)、BCG免疫組(8只)、BCG+BNBD5組(8只)、BCG+BNBD5-PLGA組(8只)和攻毒組(5只)。除正常對照組和攻毒組外,其余組對小鼠用1×106CFU的BCG進行皮下接種。接種4周后,BCG+BNBD5組和BCG+BNBD5-PLGA組滴鼻BNBD5(300 μg/只)或BNBD5-PLGA(300 μg/只),而正常對照組與攻毒組滴鼻100 μL PBS,連續3次,每次間隔2周,最后一次滴鼻后4周,每組剖殺3只小鼠(攻毒組除外),取肺泡灌洗液和血清。
1.2.4 ELISA檢測細胞因子及抗體 剖殺小鼠,取肺泡灌洗液,取血分離血清,-80 ℃保存。按試劑盒說明書檢測血清中TNF-α、IL-1β、IL-10、抗體IgG水平和肺泡灌洗液IgA水平。
1.2.5 小鼠攻毒 最后一次滴鼻給藥后4周,除正常對照組外,其他組剩余小鼠滴鼻感染牛分枝桿菌M.bovis,攻毒劑量為1 000 CFU/只,攻毒后觀察小鼠狀態并記錄體重,3周后剖殺小鼠,取肺臟、肝臟、脾臟。
1.2.6 病理學觀察及載菌量檢測 小鼠剖殺后,取完整肺臟稱重,剪下右肺以進行載菌量檢測,剪下小片左肺于福爾馬林溶液中保存固定,進行石蠟切片制作以及蘇木精-伊紅(Hematoxylin-eosin,H.E.)染色,并且按試劑盒說明書進行抗酸染色。載菌量檢測方法:將取下的小鼠右肺放于1 mL的PBS中研磨,研磨均勻后用PBS稀釋103倍,取50 μL于7H10培養基中涂布均勻,培養2~3周觀察菌落生長情況并計數。
1.2.7 統計學分析 運用GraphPad Prism 8.0軟件對試驗數據進行分析,結果以平均值±標準誤(Mean ± SEM)表示,在分析差異時,*表示差異顯著(P<0.05),**表示差異完全顯著(P<0.01),***表示差異極顯著(P<0.001),****表示差異極其顯著(P<0.000 1)。
2 結果
2.1 重組蛋白牛防御素5(BNBD5)的鑒定 將純化獲得的目的蛋白牛防御素5(含有His-tag標簽)分別進行考馬斯亮藍染色和Western Blot檢測,其中Western Blot檢測使用的一抗為鼠抗6×His·tag單克隆抗體。結果顯示,純化透析后的重組蛋白BNBD5顯示與目的蛋白大小一致的蛋白條帶,純度較高(圖1A);Western Blot檢測重組蛋白樣品有單一條帶(圖1B)。
2.2 BNBD5-PLGA微球制備 在掃描電鏡下觀察微球形貌并放入Zeta Potential檢測儀中,運用Malvern Instrument軟件分析數據。結果顯示:冷凍干燥得到的白色微球粉末松散,制備的微球大部分圓滑規整,尺寸均為均一,粘連性低,符合預期(圖2A);納米粒度儀測得的微球Zeta電位為-41.9 mV,說明制備的微球較為穩定,平均粒徑約為207.9 nm,粒徑集中在247 nm左右,多分散系數(PDI)為0.225,表明制備的微球分散性良好、粒徑集中(圖2B)。
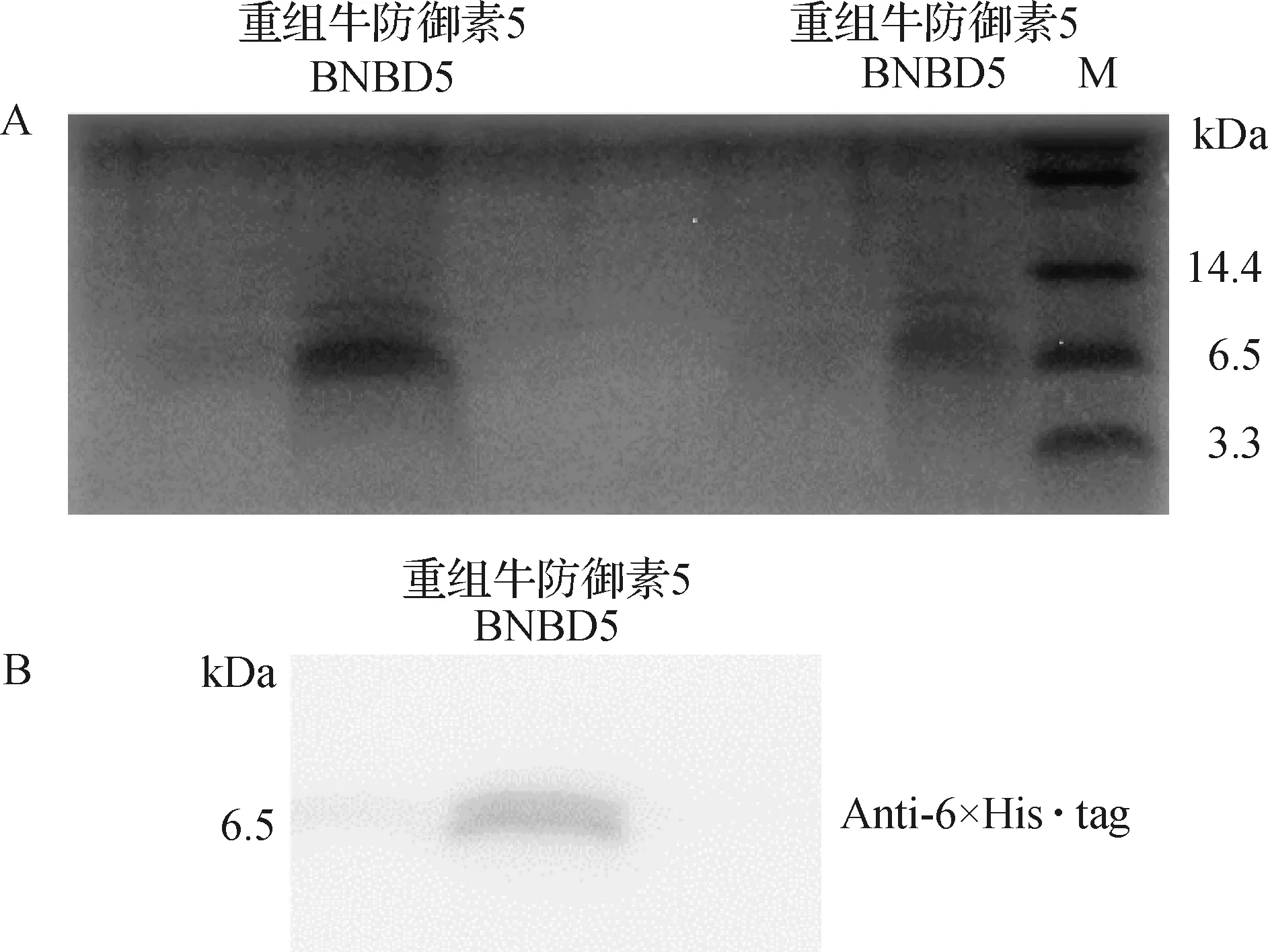
圖1 重組蛋白BNBD5的Tricine-SDS-PAGE分析及Western Blot分析
2.3 小鼠免疫后血清中細胞因子和抗體水平 通過ELISA方法檢測,分析末次滴鼻給藥后4周小鼠血清細胞因子TNF-α、IL-1β、IL-10和抗體IgG水平以及肺泡灌洗液IgA水平。
細胞因子檢測結果發現:(1)BCG+BNBD5-PLGA組小鼠血清中TNF-α水平顯著高于BCG免疫組和BCG+BNBD5組(P<0.001,圖3A);(2)BCG+BNBD5組和BCG+BNBD5-PLGA組IL-1β水平顯著高于BCG組(P<0.05,P<0.01),而BCG+BNBD5組較BCG+BNBD5-PLGA組又有明顯提高(P<0.05,圖3B);(3)除正常對照組外,其余各組小鼠血清中IL-10水平均有顯著性降低(P<0.001),但BCG免疫組、BCG+BNBD5組和BCG+BNBD5-PLGA組間無明顯差異(圖3C)。
抗體檢測結果顯示:(1)BCG免疫組、BCG+BNBD5組和BCG+BNBD5-PLGA組抗體IgG水平高于正常對照組,BCG+BNBD5組和BCG+BNBD5-PLGA組略高于BCG免疫組(圖3D);(2)與BCG免疫組對比,BCG+BNBD5組和BCG+BNBD5-PLGA組小鼠肺泡灌洗液IgA水平有顯著性提高,其中BCG+BNBD5-PLGA組又顯著高于BCG+BNBD5組(P<0.01,圖3E)。
結果顯示,牛防御素5及牛防御素5-PLGA納米微球可以增強小鼠先天性免疫,BCG+BNDB5組和BCG+BNDB5-PLGA微球組小鼠血清中非特異性細胞因子(TNF-α和IL-1β)水平和抗體IgA水平顯著提高。
2.4 攻毒后各組小鼠的體重變化和肺臟指數 末次接種微球后4周攻毒剩余小鼠,觀察小鼠狀態,記錄體重并在3周后剖殺小鼠,取臟器。
結果顯示:(1)與攻毒組相比,處理組體重減輕比率顯著低,而與BCG免疫組比較,BCG+BNBD5-PLGA組體重減輕比率更少(圖4A);(2)雖然BCG+BNBD5-PLGA組和BCG+BNBD 5組肺臟指數略低于BCG免疫組,但組間無顯著差異(圖4B)。
2.5 肺臟載菌量及病理組織學觀察 H.E.染色觀察:攻毒組小鼠左肺形成嚴重的炎性灶和組織損傷,處理組小鼠左肺病變程度均有所減輕(見封三彩版圖5A);抗酸染色觀察:攻毒組病變組織內可發現大量紅染的分枝桿菌,與BCG免疫組相比,BCG+BNBD5組和BCG+BNBD5-PLGA組病變部位紅染的細菌有所減少,且分枝桿菌被局限在炎性灶內,減少了細菌向周圍擴散(見封三彩版圖5B);載菌量結果顯示:BCG+BNBD5組和BCG+BNBD5-PLGA組與BCG免疫組相比左肺載菌量有所減少,但不顯著(見封三彩版圖5C)。

圖2 BNBD5-PLGA微球表征
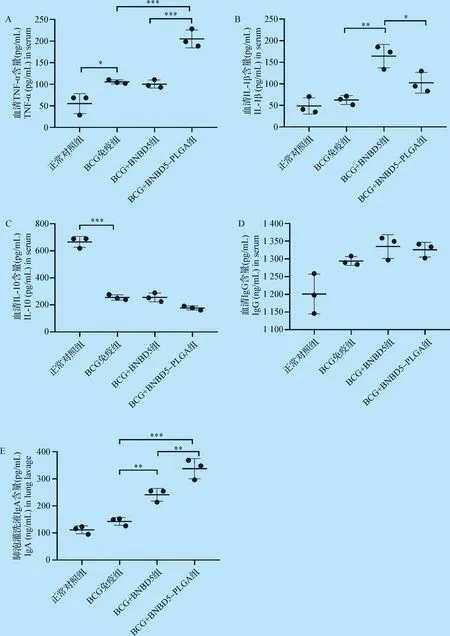
圖3 小鼠接種PLGA微球后不同細胞因子和抗體水平
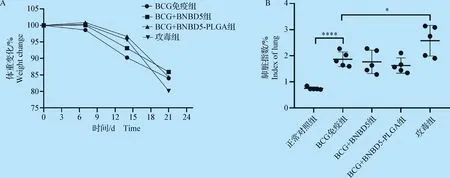
圖4 感染后小鼠體重變化及肺臟指數
3 討論
牛防御素5是一種牛源β-防御素,屬于陽離子型抗菌肽。β-防御素一般含有6個半胱氨酸和3個二硫鍵,二硫鍵的存在使得防御素不易被酶水解,這也是其抑菌活性強于其他抗菌肽的原因之一[5]。牛源防御素類抗菌肽在體內的分布廣泛,本試驗所使用的BNBD5可分布于氣管、肺泡的中性粒細胞和單核巨噬細胞等[6]。
抗菌肽的非特異性多效作用機制和獨特的免疫調節作用優于傳統抗生素,激發了醫藥市場的興趣。目前已有多種抗菌肽在結核防治方面的方法研究:Khara等[7]合成了α-螺旋肽,證實其與利福平聯用具有良好的抗結核分枝桿菌作用;Rekha等[8]發現苯基丁酸酯(PBA)可以誘導促炎型抗菌肽LL-37分泌,從而促進殺傷胞內結核分枝桿菌;Silva等[9]將抗菌肽LLKKK18包在納米凝膠中用于結核治療,效果良好。
但也有發現,外源性抗菌肽給藥有以下缺點:口服或全身給藥后快速降解甚至可能產生毒性、體液穩定性低、在高濃度下可能存在不良副作用(腫瘤,血管增生等)、化學合成成本高等[10]。通過PLGA載體緩釋給藥,可以保護抗菌肽不被快速降解,并且由于PLGA納米顆粒良好的靶向性,抗菌肽可以向特定器官持續不斷的遞送,提高療效[11]。已有研究發現,PLGA與蛋白類抗原制備的顆粒疫苗可誘導機體產生有效的黏膜免疫[12]。
現在普遍認為,機體抗結核感染時的特異性免疫應答以細胞免疫為主,多種細胞因子參與,體液免疫為輔,但這不能全面反映體內免疫應答的復雜性。TNF-α是一種前炎癥細胞因子,可參與巨噬細胞活化、增強吞噬作用,參與肉芽腫形成,從而在感染中發揮作用[13]。已有研究表明,PLGA載體材料可引起小鼠體內TNF-α表達水平上升[14]。IL-1β是單核巨噬細胞分泌的一種促炎細胞因子,可與抗原協同作用,刺激多種不同的間質細胞釋放蛋白水解酶[13]。
IgG是機體特異性免疫分泌的主要抗體,IgA是機體黏膜免疫分泌的主要抗體。氣管黏膜組織是結核桿菌通過氣溶膠傳播入侵機體和定居的第一場所,因此黏膜免疫對于抗結核感染具有重要意義。
本試驗所表達的重組蛋白BNBD5和制備的微球BNBD5-PLGA通過滴鼻給藥的方式在氣管黏膜上皮能發揮非特異性免疫誘導作用,促進細胞因子TNF-α和IL-1β以及抗體IgA的表達。納米載藥顆粒由于其更易被宿主抗原遞呈細胞(Antigen present cell,APC)攝取的特性能增強免疫應答[15],這也與本試驗結果相符,微球BCG+BNBD5-PLGA組相比蛋白BCG+BNBD5組能更有效的誘導黏膜免疫,促進分泌抗體IgA。

