Au7團(tuán)簇吸附O2和CO及其對(duì)CO的催化反應(yīng)機(jī)理研究
陳 宣, 鄧開明
(1.南京信息工程大學(xué) 物理與光電工程學(xué)院, 南京 210044; 2.南京理工大學(xué) 理學(xué)院, 南京 210094)
1 前 言
金歷來被認(rèn)為比其它金屬的活性要低的多,其表面很難吸附大量的氣體分子,不具有催化特性[1-3].自Haruta等人發(fā)現(xiàn)納米金顆粒有著活躍的催化性質(zhì)[4]以來,金團(tuán)簇對(duì)CO催化氧化反應(yīng)成為一個(gè)十分活躍的研究領(lǐng)域[5-10].大量的實(shí)驗(yàn)[11-13]和理論[14, 15]研究表明,當(dāng)金顆粒尺寸為2~5nm時(shí)具有良好的催化活性,反應(yīng)的關(guān)鍵過程是氧分子在團(tuán)簇上的活化,形成一種超氧狀態(tài)[O2]-,然后同吸附的CO分子進(jìn)行反應(yīng).然而,金納米顆粒能夠很好的吸附CO分子,但很難牢牢的吸附O2分子[16].實(shí)驗(yàn)和理論研究表明當(dāng)Aun團(tuán)簇有未配對(duì)電子時(shí)才能對(duì)O2分子展現(xiàn)出良好的吸附能力[13].
目前,Au團(tuán)簇的CO催化氧化反應(yīng)機(jī)理也引起了大量的理論研究[17-23].在Au10團(tuán)簇的研究中發(fā)現(xiàn),O2分子在Au10團(tuán)簇上有可能分裂為兩個(gè)O原子,從而降低CO氧化反應(yīng)時(shí)的反應(yīng)勢(shì)壘[21].在硅烯表面上Au原子對(duì)C催化氧化的研究中表明,CO先吸附在Au上然后在和O2分子反應(yīng),在反應(yīng)過程中形成OCOO結(jié)構(gòu)的中間態(tài)[22].Lin等人在研究Au2n-(n=1-4)團(tuán)簇CO催化氧化反應(yīng)時(shí)提出,CO和O2在反應(yīng)過程中間有可能形成一種穩(wěn)定的CO3結(jié)構(gòu)[23].而Wang等人對(duì)Au3-,Au3和Au3+團(tuán)簇的理論研究表明,離子態(tài)會(huì)影響CO催化氧化活性,在反應(yīng)過程中CO不能直接與吸附在金團(tuán)簇上的O2分子反應(yīng),而時(shí)在反應(yīng)過程中形成了OCOO結(jié)構(gòu)的中間態(tài),并指出反應(yīng)過程中并不一定會(huì)形成穩(wěn)定的CO3結(jié)構(gòu)[24].
Wang等人在研究了Au7團(tuán)簇在TiO2(110)面上的CO催化氧化反應(yīng)時(shí),主要研究了三維立體結(jié)構(gòu)的Au7團(tuán)簇對(duì)CO催化氧化反應(yīng)機(jī)理以及負(fù)載在反應(yīng)中起的作用[25].最近,Gruene等人在實(shí)驗(yàn)中發(fā)現(xiàn)了二維Cs平面結(jié)構(gòu)的Au7團(tuán)簇[26],其較小的尺寸在無(wú)負(fù)載情況下也有可能成為CO氧化的催化劑.本文采用密度泛函理論的方法,研究了Au7團(tuán)簇吸附O2、CO分子情況,并討論了CO在Au7團(tuán)簇上催化氧化的反應(yīng)機(jī)理.
2 計(jì)算方法
本文采用相對(duì)論密度泛函理論中的廣義梯度近似(GGA)[27,28],Perdew,Burke和Ernzerhof交換關(guān)聯(lián)修正函數(shù)[29]和極化函數(shù)擴(kuò)展的雙數(shù)值原子軌道DND基組,也就是說函數(shù)中包含高于自由原子中的最高占據(jù)軌道角動(dòng)量一級(jí)的角動(dòng)量.計(jì)算中采用自旋非限制近似求解Kohn-Sham[30]自洽場(chǎng)方程.結(jié)構(gòu)優(yōu)化采用了Broyden-Fletcher-Goldfarb-Shanno[31]方法,在沒有任何參數(shù)限制(如對(duì)稱性,鍵長(zhǎng),鍵角)條件下,以梯度變化小于10-3a.u、位移變化小于10-3a.u.和能量變化小于10-5a.u.作為收斂標(biāo)準(zhǔn),自洽過程是在能量和電子密度的收斂標(biāo)準(zhǔn)為10-6a.u.下完成.過渡態(tài)的搜索采用的是線性同步度越(linear synchronous transit, LST)和四極同步度越(quadratic synchronous transit, QST)方法.
3 結(jié)果與分析
圖1給出了Au7團(tuán)簇兩種優(yōu)化的幾何結(jié)構(gòu),分別是對(duì)稱性Cs的平面結(jié)構(gòu)[25]和對(duì)稱性D5h的立體結(jié)構(gòu).表1列出了Au7團(tuán)簇兩種結(jié)構(gòu)的結(jié)合能(Eb)和其吸附一個(gè)CO分子或一個(gè)O2分子時(shí)的吸附能(Eads).Eb是組成分子的各原子能量之和減去分子總能量,它反映了各同分異構(gòu)體的熱力學(xué)穩(wěn)定性.Eads是Au7團(tuán)簇能量與O2(或CO)分子能量之和減去Au7-O2(或Au7-CO)團(tuán)簇的能量.由表1可知,Cs結(jié)構(gòu)的Au7團(tuán)簇結(jié)合能比D5h結(jié)構(gòu)的結(jié)合能大,說明C2v結(jié)構(gòu)較穩(wěn)定,Au7團(tuán)簇更傾向與平面結(jié)構(gòu).此外,Cs結(jié)構(gòu)的Au7團(tuán)簇的Eads(O2)和Eads(CO)也比D5h結(jié)構(gòu)的Au7團(tuán)簇大,表明其對(duì)O2和CO的吸附能力較強(qiáng).因此,以下僅討論Cs結(jié)構(gòu)的Au7團(tuán)簇吸附O2、CO分子情況以及其CO催化氧化的反應(yīng)機(jī)理.
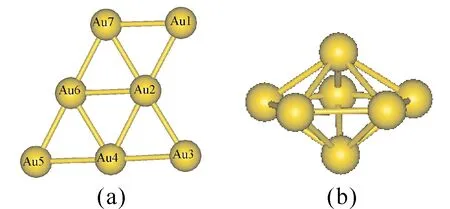
圖1 Au7團(tuán)簇的幾何優(yōu)化結(jié)構(gòu):(a)CS對(duì)稱性結(jié)構(gòu),(b)D5h對(duì)稱性結(jié)構(gòu).Fig.1 Optimized geometries of Au7: (a) CS symmetric structure, (b) D5h symmetric structure.
表1 Au7團(tuán)簇的結(jié)合能以及其CO和O2的吸附能
Table 1 The binding energies of Au7clusters as well as the adsorption energies of CO and O2on Au7

CsD5hEb /eV11.7211.18Eads(O2)/eV0.640.58Eads(CO)/eV1.261.16
3.1 Au7團(tuán)簇對(duì)O2分子的吸附性質(zhì)
O2分子在Au7團(tuán)簇上的吸附位置可以分為三類,分別為吸附在Au原子上,吸附在Au-Au鍵上,和吸附在Au原子形成的面上.計(jì)算結(jié)果表明O2分子更容易吸附在Au原子上.圖2 給出了Au7團(tuán)簇吸附一個(gè)O2分子時(shí)較穩(wěn)定的三種幾何結(jié)構(gòu).表2列出了它們的結(jié)合能、吸附能及其相關(guān)鍵長(zhǎng).由結(jié)合能可以發(fā)現(xiàn),Au7團(tuán)簇吸附一個(gè)O2分子時(shí),最穩(wěn)定的吸附位置為O2分子吸附在Au1原子上,如圖2(a)所示,而O2分子吸附在Au7、Au5原子上時(shí)[圖2(b)和(c)],其結(jié)合能比最穩(wěn)定結(jié)構(gòu)的結(jié)合能小0.09 eV和0.18 eV.此外,在這三種吸附位置中,O-O鍵長(zhǎng)都有所增長(zhǎng),從O2分子的0.123 nm增長(zhǎng)到0.126 nm左右;而Au-O鍵長(zhǎng)隨著結(jié)合能和吸附能的減少而變長(zhǎng).圖3給出了Au7團(tuán)簇的電子最高占據(jù)軌道圖.從該圖可以看出,電子主要分布在Au1、Au5和Au7原子周圍,說明與其它位置相比,當(dāng)O2分子吸附在這三個(gè)位置時(shí),O2分子更容易得到電子,形成超氧狀態(tài).

圖2 Au7O2分子的幾何結(jié)構(gòu)圖:(a)O2分子吸附在Au1原子位置,(b)O2分子吸附在Au7原子位置,(c)O2分子吸附在Au5原子位置.Fig.2 Optimized geometries for the complexes of Au7O2: (a) O2 is adsorbed on Au1 atom, (b) O2 is adsorbed on Au7 atom, (c) O2 is adsorbed on Au5 atom.
表2 O2分子分別吸附在Au1、Au7、Au5上時(shí)的結(jié)合能、吸附能及其相關(guān)鍵長(zhǎng)
Table 2 The binding energies, the adsorption energies and the bond lengths for the structures of O2adsorbed on Au1, Au7 and Au5 atoms, respectively.
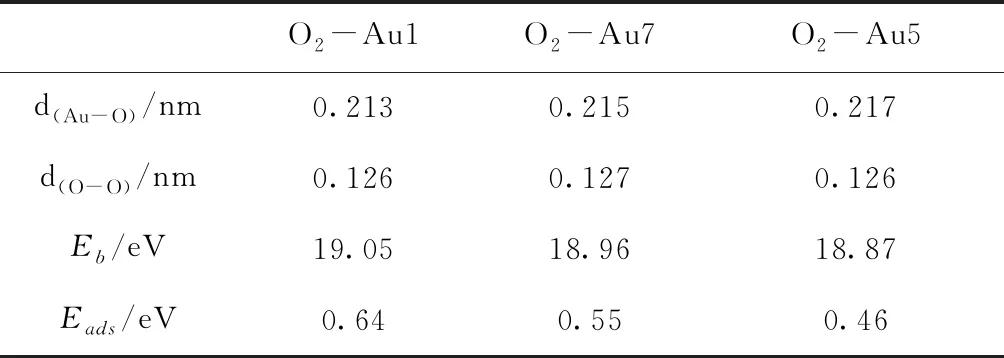
O2-Au1O2-Au7O2-Au5d(Au-O)/nm0.2130.2150.217d(O-O)/nm0.1260.1270.126Eb /eV19.0518.9618.87Eads/eV0.640.550.46
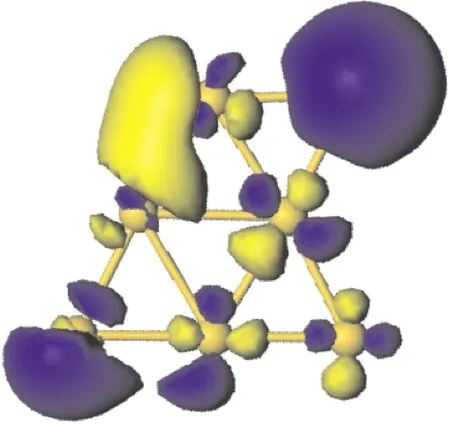
圖3 Au7團(tuán)簇電子最高占據(jù)軌道圖.Fig.3 Typically contour plots of HOMO of Au7 cluster
表3給出了Au7團(tuán)簇吸附多個(gè)O2分子的平均吸附能及相關(guān)鍵長(zhǎng).由表3可以看出,隨著O2分子吸附數(shù)目的增加,O-O鍵略有減小,但Au-O鍵明顯增長(zhǎng).平均吸附能也隨著吸附O2數(shù)目的增加而明顯降低,并且減小的幅度很大.因此Au7團(tuán)簇吸附多個(gè)O2分子的可能性不大.
表3 多個(gè)O2分子吸附在Au7團(tuán)簇表面上時(shí),各穩(wěn)定結(jié)構(gòu)的平均鍵長(zhǎng)及平均吸附能
Table 3 The average adsorption energies and the average geometrical parameters for multiple O2adsorption on the Au7cluster

d(Au-O)/nmd(O-O)/nmEads(O2)/eVAu7-O20.2130.1260.64Au7-2O20.2190.1260.51Au7-3O20.2200.1250.44Au7-4O20.2240.1250.38Au7-5O20.2270.1240.33Au7-6O20.2400.1240.31Au7-7O20.2560.1240.24
3.2 Au7團(tuán)簇對(duì)CO分子的吸附性質(zhì)
圖4給出了Au7團(tuán)簇吸附一個(gè)CO時(shí)四種較穩(wěn)定的幾何優(yōu)化結(jié)構(gòu).與吸附O2分子不同,Au7團(tuán)簇吸附CO分子時(shí),Au7團(tuán)簇的結(jié)構(gòu)發(fā)生了很大的扭曲.表4給出了這四種結(jié)構(gòu)的結(jié)合能、吸附能和相關(guān)的鍵長(zhǎng).當(dāng)CO分子吸附在Au6原子、Au7原子或Au6-Au7鍵上時(shí),Au7團(tuán)簇的結(jié)構(gòu)發(fā)生扭曲,形成最穩(wěn)定的吸附結(jié)構(gòu)[圖4(a)],其吸附能為1.26 eV.此外,當(dāng)CO分子吸附在Au1、Au3和Au5原子位置時(shí),也可以得到較為穩(wěn)定的結(jié)構(gòu),其結(jié)合能比最穩(wěn)定結(jié)構(gòu)的結(jié)合能小0.16、0.11和0.19 eV.與O2分子的吸附能相比,CO分子的吸附能要大于對(duì)O2分子的吸附能,這說明Au7團(tuán)簇更容易吸附CO分子.
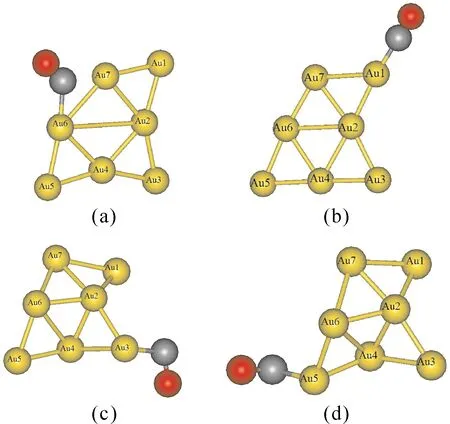
圖4 Au7團(tuán)簇吸附一個(gè)CO分子的幾何結(jié)構(gòu)圖:(a)CO分子吸附在Au6原子位置,(b)CO分子吸附在Au1原子位置,(c)CO分子吸附在Au3原子位置,(d)CO分子吸附在Au5原子位置.Fig.4 Optimized geometries for the complexes of Au7CO: (a) CO is adsorbed on Au6 atom, (b) CO is adsorbed on Au1 atom, (c) CO is adsorbed on Au3 atom, (d) CO is adsorbed on Au5 atom.
表4 CO分子分別吸附在Au1、Au3、Au5和Au6原子時(shí)的結(jié)合能、吸附能及其相關(guān)鍵長(zhǎng)
Table 4 The binding energies, the adsorption energies and the bond lengths for the structures of CO adsorbed on Au1, Au3, Au5 and Au6 atoms, respectively.
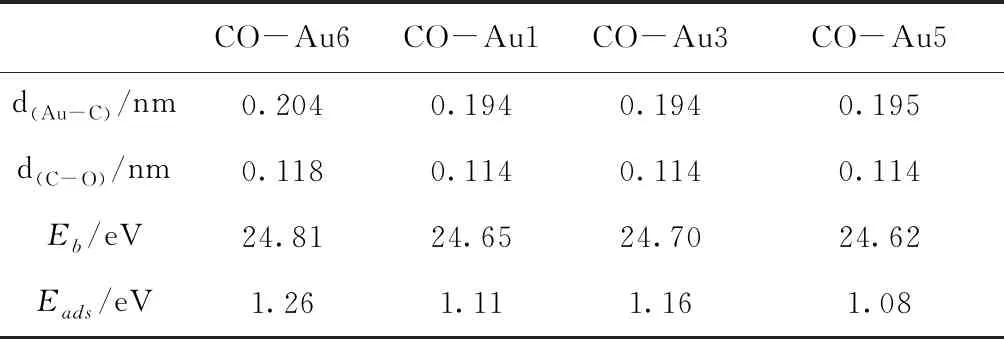
CO-Au6CO-Au1CO-Au3CO-Au5d(Au-C)/nm0.2040.1940.1940.195d(C-O)/nm0.1180.1140.1140.114Eb/eV24.8124.6524.7024.62Eads/eV1.261.111.161.08
表5給出了Au7團(tuán)簇吸附多個(gè)CO分子時(shí)的平均吸附能以及平均鍵長(zhǎng).由表5可以看出,雖然平均吸附能隨著吸附CO分子個(gè)數(shù)的增多而有所減小,但減小的幅度不是很大,這表明Au7團(tuán)簇有可能同時(shí)吸附多個(gè)CO分子.此外,除了吸附一個(gè)CO分子的情況外,Au7團(tuán)簇吸附多個(gè)CO分子時(shí),Au-C鍵長(zhǎng)及C-O鍵長(zhǎng)均變化不大.
表5 多個(gè)CO分子吸附在Au7團(tuán)簇表面上時(shí),各種穩(wěn)定結(jié)構(gòu)的平均鍵長(zhǎng)及平均吸附能
Table 5 The average adsorption energies and the average geometrical parameters for multiple CO adsorption on the Au7cluster

d(Au-C)/nmd(C-O)/nmEads(CO)/eVAu7-CO0.2030.1171.26Au7-2CO0.1940.1141.22Au7-3CO0.1940.1141.20Au7-4CO0.1950.1141.13Au7-5CO0.1980.1151.07Au7-6CO0.1960.1141.03Au7-7CO0.1970.1150.91
3.3 Au7團(tuán)簇對(duì)CO催化氧化反應(yīng)機(jī)理
由上文分析可知,Au7團(tuán)簇更容易吸附CO分子,因此Au7團(tuán)簇CO催化氧化反應(yīng)過程應(yīng)該是CO分子先吸附在Au7團(tuán)簇上,然后和O2分子發(fā)生反應(yīng).圖5給出了Au7團(tuán)簇CO催化氧化過程的勢(shì)能圖以及各狀態(tài)的幾何結(jié)構(gòu)圖.表6列出了反應(yīng)過程中各狀態(tài)的幾何結(jié)構(gòu)參數(shù).由圖5可知,在初態(tài)IS中,以Au7-CO結(jié)構(gòu)為基礎(chǔ),吸附一個(gè)O2分子,其吸附能為0.40 eV,形成了CO和O2分子共吸附在Au7團(tuán)簇上的結(jié)構(gòu).IS克服0.18 eV的勢(shì)壘,到達(dá)過渡態(tài)TS1,CO與O2相互靠近,兩者距離d(O-C)從0.291 nm縮短為0.198 nm,并且O-O鍵開始增長(zhǎng).過渡態(tài)TS1態(tài)釋放0.23 eV能量后,形成一種較為穩(wěn)定的OCOO中間產(chǎn)物.在中間態(tài)MS中,O-O鍵長(zhǎng)有了明顯的增長(zhǎng),變?yōu)?.144 nm,并且CO與O2進(jìn)一步靠近,d(O-C)縮短為0.133 nm.MS克服0.34 eV的勢(shì)壘到達(dá)過渡態(tài)TS2.在TS2中,O-O鍵正在斷開,其之間的距離增長(zhǎng)為0.173 nm,CO2分子即將形成.最終,CO2分子脫離Au7團(tuán)簇,釋放能量3.00 eV.從整體上看,Au7團(tuán)簇CO催化氧化反應(yīng)需克服的最高勢(shì)壘僅為0.34 eV,說明此反應(yīng)是可以進(jìn)行的.

圖5 CO在Au7團(tuán)簇上的催化氧化反應(yīng)過程的勢(shì)能圖,以Au7團(tuán)簇、O2分子和CO分子的能量和作為零勢(shì)能,能量單位為eV.IS為初始狀態(tài),TS1和TS2為過渡態(tài),MS為中間態(tài),F(xiàn)S為終態(tài) Fig.5 Energy diagrams for CO oxidation on Au7 cluster.The corresponding initial, intermediate, transition and final states are presented.The sum of energies of free Au7, O2, and CO is set to zero as a reference.All the energies are in eV.
4 結(jié) 論
本文采用密度泛函理論,研究了Au7團(tuán)簇對(duì)O2和CO分子吸附的情況,探究了CO在Au7團(tuán)簇上的催化氧化反應(yīng)機(jī)理.研究發(fā)現(xiàn):Au7團(tuán)簇吸附一個(gè)O2分子的吸附能為0.64 eV,但在吸附多個(gè)O2分子時(shí),平均吸附能有了明顯的下降,表明Au7團(tuán)簇進(jìn)行多吸附O2分子的可能性不大.Au7團(tuán)簇吸附一個(gè)CO分子的吸附能為1.26 eV,且在吸附多個(gè)CO分子時(shí),平均吸附能減小幅度不大,說明Au7團(tuán)簇有可能吸附多個(gè)CO分子.由吸附能可知,Au7團(tuán)簇更傾向于吸附CO分子,并且Au7團(tuán)簇的CO催化氧化反應(yīng)過程為CO分子先吸附在Au7團(tuán)簇上,然后和O2分子發(fā)生反應(yīng).由反應(yīng)勢(shì)能可知,整個(gè)反應(yīng)要克服的最高勢(shì)壘僅為0.34 eV,因此Au7團(tuán)簇有望成為良好的CO氧化催化劑.
表6 Au7團(tuán)簇CO催化氧化反應(yīng)中各狀態(tài)幾何結(jié)構(gòu)參數(shù),其中d(C-O)為CO中C原子與O原子之間的距離;d(Au-C)為CO與Au7團(tuán)簇之間的距離;d(O-C)為CO與O2之間的距離;d(O-O)為O2中兩個(gè)O原子之間的距離;d(Au-O)為O2與Au7團(tuán)簇之間的距離
Table 6 The geometrical parameters for initial, intermediate, and transition states, respectively.Thed(C-O)is the distance between C and O atoms in CO; the d(Au-C)is the distance between CO and Au7; the d(O-C)is the distance between CO and O2; the d(O-O)is the distance between O and O atoms in O2;the d(Au-O)is the distance between O2and Au7.
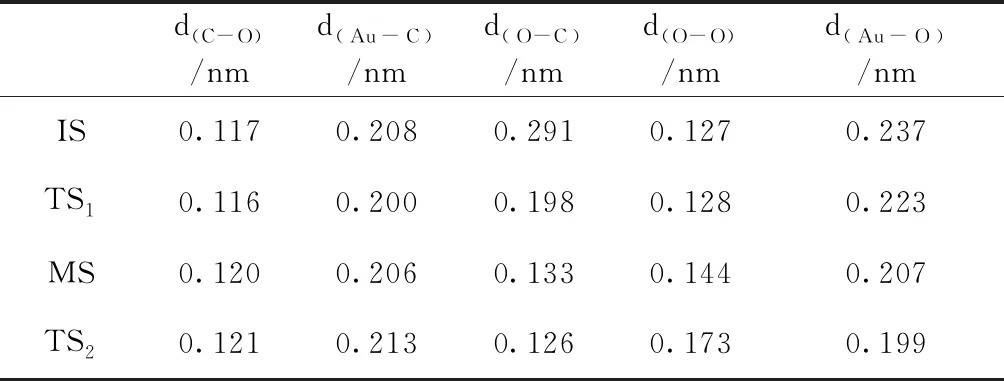
d(C-O)/nmd(Au-C)/nmd(O-C)/nmd(O-O)/nmd(Au-O)/nmIS0.1170.2080.2910.1270.237TS10.1160.2000.1980.1280.223MS0.1200.2060.1330.1440.207TS20.1210.2130.1260.1730.199
- 原子與分子物理學(xué)報(bào)的其它文章
- 原子尺寸對(duì)Lennard-Jones液體玻璃轉(zhuǎn)變過程中動(dòng)力學(xué)不均勻性的影響
- 尋找囚禁在光腔中的玻色-愛因斯坦凝聚體的八重準(zhǔn)晶
- Ab initio calculations of structural evolution and conductance of binary compound GaN chain on gold leads
- 稀土元素(La,Y)摻雜GaN的第一性原理計(jì)算
- 新型稀磁半導(dǎo)體Fe摻雜LiZnP的光電性質(zhì)
- La摻雜6H-SiC電子結(jié)構(gòu)和光學(xué)性質(zhì)的第一性原理研究

