芪黃疽愈方調節ASO大鼠炎癥細胞因子
孫云朝 郭娜 李德輝 葛建立 馬云龍 張欣 蘇坤 (河北省中醫院,河北 石家莊 050000)
肢體動脈硬化閉塞癥(ASO)是外科臨床常見病,發病率隨年齡增長而逐漸升高,患者早期出現間歇性跛行等下肢缺血的臨床表現,病情進一步發展可出現下肢營養障礙,表現為靜息痛,直至肢端發生壞死而截肢,降低了患者生活質量。目前ASO治療有藥物治療、血管介入、手術治療等,但外科手術移植物長期通暢率低,血管介入遠期療效并不肯定,尚缺乏確切理想的治療方法。中醫治療從病因病機到診斷治療均有記載,雖療效尚可,但多不穩定,每易復發,且大多僅為臨床經驗的總結,尚缺乏系統的科學論證。課題組前期對ASO做了大量臨床研究,應用芪黃疽愈方治療ASO取得滿意療效,并且成功制作了大鼠模型,從實驗角度再次證實芪黃疽愈方的治療作用〔1~3〕,但其生物學機制仍待進一步明確。芪黃疽愈方治療ASO可能與調節炎癥反應相關細胞因子有關。本研究旨在探討芪黃疽愈方對ASO大鼠炎癥細胞因子的影響。
1 材料與方法
1.1實驗動物 清潔級雄性SD大鼠50只(4~6周齡),體重(200±20)g,由河北醫科大學實驗動物中心提供。
1.2飼料制備〔4〕高脂飼料,配比為83.5%基礎飼料,5%豬油,1%膽固醇,0.5%膽酸鈉及10%蛋黃粉。
1.3藥物及試劑 芪黃疽愈方:黃芪20 g、黃精12 g、紅花12 g、鬼箭羽12 g、土鱉蟲9 g、雞血藤15 g、延胡索12 g、牛膝9 g、海藻12 g,由河北省中醫院煎藥室煎制,配制成最終濃度分別為0.35 g/ml,0.75 g/ml,1.5 g/ml藥液。實驗過程中每次中藥制劑均按同一標準進行;維生素D3注射液(江蘇吳中蘇州制藥);大鼠內皮素(ET)-1、白細胞介素(IL)-1β試劑盒(欣博盛生物科技有限公司);一氧化氮(NO)試劑盒(武漢華美生物工程有限公司);核因子(NF)-κB p65抗體、腫瘤壞死因子(TNF)-α抗體均購自Abcam公司。
1.4實驗分組與造模 50只雄性SD大鼠隨機分為正常對照組、疾病模型組、芪黃疽愈方高濃度組、芪黃疽愈方中濃度組、芪黃疽愈方低濃度組,每組10只,正常對照組普通飲食喂養,自由飲水。疾病模型組與芪黃疽愈方各劑量組高脂飼料喂養1 w,于清潔動物實驗室內用1%戊苯巴比妥鈉(1 ml/200 g)腹腔注射麻醉;每只大鼠取左后肢消毒,從腹股溝中點向后肢內側縱行切開皮膚,分離并暴露隱動脈,用動脈夾阻斷隱動脈遠近端1.5~2.0 cm,取胰島素注射器1支,沿隱動脈血管長軸由遠端向近端刺入血管腔,將0.2~0.3 ml注射用無菌蒸餾水緩慢注入阻斷部位血管,至血管充盈為止,5 min后取下針頭和動脈夾,壓迫止血,縫合切口,內膜損傷模型完成〔4〕。后疾病模型組大鼠予以高脂飼料喂養,并在大鼠右下肢肌肉注射維生素D3針劑(3×105U/kg體重),每隔30 d重復1次;造模1 w后,給予生理鹽水(1 ml/100 g)灌胃,每日1次,連續12 w,自由飲水。芪黃疽愈方各劑量組(高濃度組、中濃度組、低濃度組)大鼠予以高脂飼料喂養,并在大鼠右下肢肌肉注射維生素D3針劑(3×105U/kg體重),每隔30 d重復1次;造模1 w后,芪黃疽愈方相應濃度中藥灌胃(1 ml/100 g),每日1次,連續12 w,自由飲水。
1.5檢測指標
1.5.1血清ET-1、NO、IL-1β含量檢測 末次給藥前禁食12 h,給藥1 h后,用1%戊苯巴比妥鈉(1 ml/200 g)腹腔注射麻醉,下腔靜脈采血約8 ml,2 500 r/min離心5 min后,分離出血清,用于ET-1、NO、IL-1β檢測。檢測方法按試劑盒說明書。
1.5.2動脈內皮TNF-α、NF-κB蛋白表達水平檢測 切取大鼠左后肢隱動脈放入1.5 ml的EP管中,加裂解液勻漿,離心后吸取上清,4℃保存備用;配制牛血清白蛋白(BSA)濃度梯度標準液及二喹啉甲酸(BCA)工作液,進行蛋白質定量分析;將提取的蛋白電泳、轉膜后,一抗與靶蛋白結合,辣根過氧化物酶標記的二抗與一抗結合;將聚偏氟乙烯(PVDF)膜平鋪于保鮮膜上,加入電化學發光(ECL)液避光反應2 min。采用Quantity One成像系統對PVDF膜進行灰度掃描,運用Image Lab分析軟件對各組條帶進行分析。
1.6統計分析 采用SPSS20.0軟件進行單因素方差分析、t檢驗。
2 結 果
2.1血清ET-1、NO、IL-1β含量水平變化 與正常對照組比較,疾病模型組血清ET-1、IL-1β含量水平顯著升高,NO水平顯著降低(均P<0.01)。與疾病模型組比較,芪黃疽愈方各劑量組血清ET-1、IL-1β含量水平均顯著下降,NO水平顯著升高(均P<0.01,P<0.05),見表1。
2.2動脈內皮TNF-α、NF-κB蛋白表達水平檢測 與正常對照組比較,疾病模型組動脈內皮TNF-α、NF-κB蛋白表達水平明顯升高(均P<0.01);與疾病模型組比較,芪黃疽愈方各劑量組動脈內皮TNF-α、NF-κB蛋白表達水平均顯著下降(P<0.01,P<0.05)。見圖1及表2。
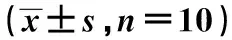
表1 各組血清ET-1、IL-1β含量
與空白對照組比較:1)P<0.01;與疾病模型組比較:2)P<0.05,3)P<0.01;下表同
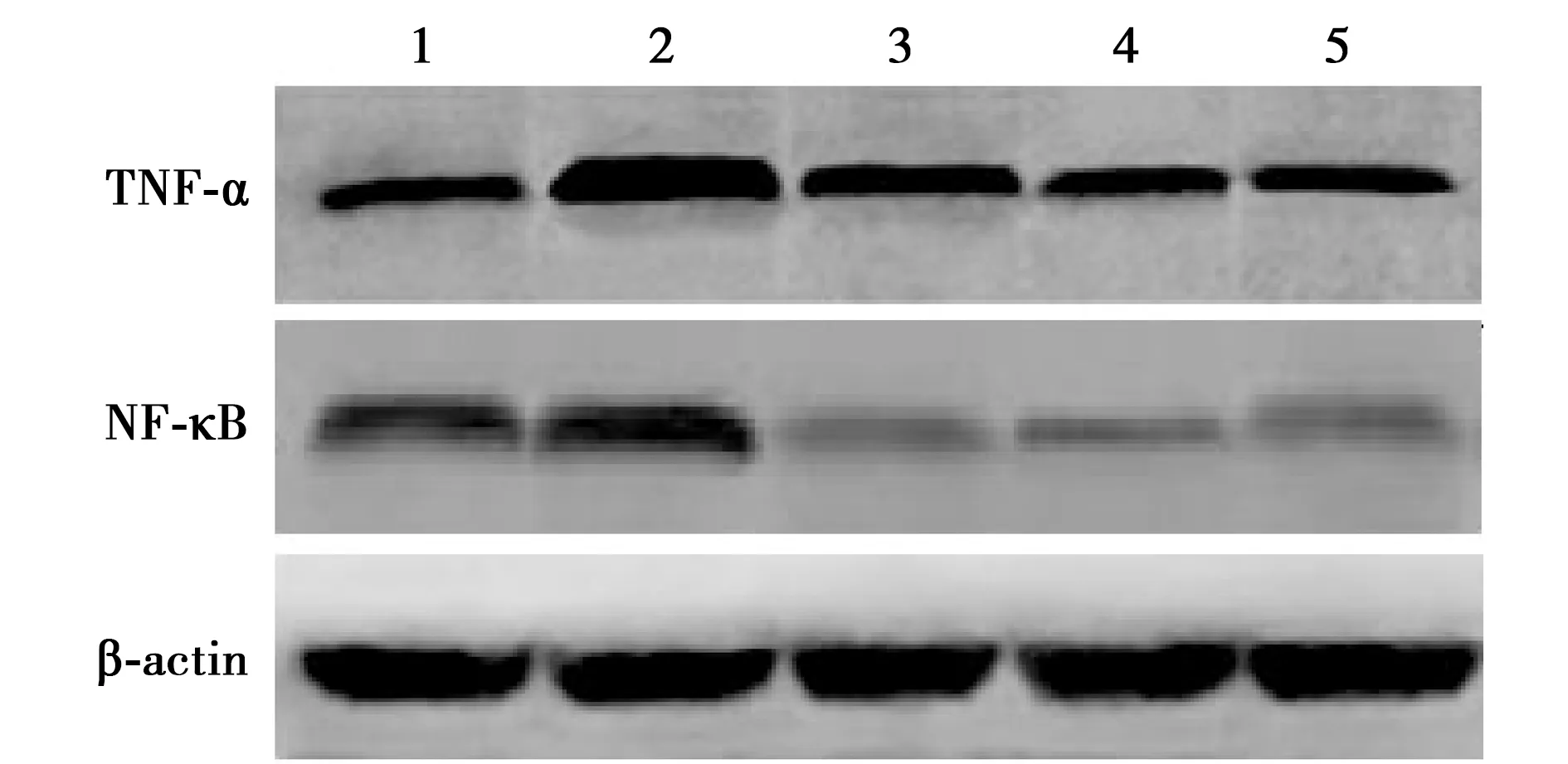
1:正常對照組;2:疾病模型組;3:芪黃疽愈方低濃度組;4:芪黃疽愈方中濃度組;5:芪黃疽愈方高濃度組圖1 各組TNF-α、NF-κB蛋白表達

組別TNF-α/β-actinNF-κB/β-actin正常對照組0.53±0.180.65±0.17疾病模型組0.94±0.321) 0.97±0.281)芪黃疽愈方低濃度組0.86±0.302) 0.68±0.212)芪黃疽愈方中濃度組0.77±0.242) 0.59±0.153)芪黃疽愈方高濃度組 0.55±0.213) 0.52±0.133)
3 討 論
ASO是指由于動脈粥樣硬化導致下肢供血動脈內膜增厚、管腔狹窄或閉塞,病變肢體血流供應不足,從而使肢體出現一系列缺血癥狀的慢性進展性疾病,其臨床表現包括下肢間歇性跛行、皮溫降低、疼痛,乃至發生潰瘍或壞死等〔5〕。ASO的發病機制尚不明確,主要有脂質滲透、內膜損傷、血栓形成和平滑肌反應學說,但大多數學者認為內膜損傷對ASO的形成作用更為突出〔6〕。當血管內皮結構受到損傷時,會出現血管內皮細胞(VEC)內分泌功能的障礙,VEC分泌的活性物質平衡破壞。病理情況下VEC損傷表現為ET-1合成和釋放增加,具有強烈的縮血管和促細胞增殖作用;而內皮保護因子NO分泌水平降低,從而使血管平滑肌處于持續收縮狀態。IL-1又名淋巴細胞刺激因子,主要由活化的單核-巨噬細胞產生,是機體炎癥反應的重要介質。IL-1能夠誘發血管內皮細胞活化并分泌IL-1β,使其表達血管細胞黏附分子(VCAM)-1,介導免疫細胞和脂質浸潤血管壁形成斑塊,在動脈硬化閉塞癥形成過程中發揮重要作用。TNF-α被認為是炎癥的關鍵因子,可通過抑制VEC 一氧化氮合酶(NOS)活性進而減弱NO血管的舒張作用,加速ASO發生和進程,在ASO的形成機制中也起著關鍵作用〔7〕。NF-κB的活化是ASO發生的始動機制之一,通過調控炎癥細胞因子(TNF-α、IL-1、IL-6等)、炎性酶〔誘導型NOS(iNOS)、環氧化酶(COX)-2〕、黏附分子〔細胞間黏附分子(ICAM)-1、VCAM-1〕、人單核細胞趨化蛋白(MCP)-1等基因表達,在ASO的進程中有著關鍵性作用。炎癥因子不但能導致血管內皮損傷,使NF-κB活化,而且隨著NF-κB的活化,釋放更多的炎癥因子,對炎癥反應級聯放大,進而促使ASO形成〔8〕。隨著炎癥的不斷進展,激活白細胞和內皮細胞,使之釋放纖維生長因子等生長因子,促進平滑肌細胞變為合成表型,促使其增殖并進入血管內膜,促使動脈粥樣硬化形成。
ASO屬祖國傳統醫學“脫疽”范疇。初起肢冷麻木,后期趾節壞死脫落,黑腐潰爛,瘡口經久不愈為主要表現。根據中醫“營衛氣血”、“久病入絡”、“久病多瘀”、“久病多虛”等理論,脫疽患者年老體衰,素體氣陰不足,氣虛無力推動,氣血津液不能輸布,津凝為痰,血滯為瘀,痰瘀互結為癥,日久最終導致痰瘀阻絡,經脈不通而發病。可見,脫疽是氣陰兩虛為本,經絡癥積瘀結為標,其病位在血脈,為本虛標實之證。因此治療需以益氣養陰、消癥散結、通經活絡為主,基于此法自擬芪黃疽愈方,應用于ASO患者的治療。經過大量的臨床觀察,芪黃疽愈方使ASO患者循環評分、跛行指數及踝肱比明顯改善,近期療效與西藥組無明顯差異,但遠期療效明顯高于西藥組。通過動物實驗,初步證實,芪黃疽愈方具有調節脂質代謝,降低血液黏稠度的作用〔1~3〕。
本研究表明芪黃疽愈方可通過抑制炎癥反應,保護血管內皮,干預ASO發展的進程。

