神經生長因子對肝星狀細胞生物行為學的影響
吳雄健 朱海燕 毛忠懿 張蕾
(贛南醫學院第一附屬醫院 1消化內科,江西 贛州 341000;2體檢科)
肝星狀細胞(HSCs)又名肝貯脂細胞、Ito細胞、竇周細胞等,位于肝細胞與肝竇內皮細胞之間的Disse腔中,占肝細胞總數的5%~8%,是正常及肝纖維化細胞外基質的主要合成細胞,在肝臟再生、脂質代謝及免疫調節中發揮著重要作用〔1,2〕。活化的HSCs在持續的外界損傷刺激下,轉化為具有膠原分泌及收縮功能特性的肌成纖維母細胞,是肝纖維化、肝硬化發生過程的中心環節〔3〕。因此抑制HSCs的活化和增殖,并誘導其凋亡是肝纖維化治療的重要途徑。神經生長因子(NGF)是一種促進中樞和外周神經發育、分化和生長的活性蛋白質,可通過與不同的NGF受體(NGFR)特異性結合而發揮不同的生物學效應〔4〕。研究顯示,NGF除了具有神經營養因子(NT)的一般功能之外,還可通過與p75NT受體(NTR)的結合介導細胞凋亡的發生〔5〕。本研究擬探究NGF對HSCs增殖、凋亡的影響及其可能的作用機制。
1 材料與方法
1.1材料與儀器 HSC-T6大鼠HSCs購自上海艾研生物科技公司,NGF、Applied Biosystems TaqMan實時熒光定量聚合酶鏈反應(PCR)試劑盒購自美國ThermoFisher Scientific公司。CCK-8細胞增殖檢測試劑盒、逆轉錄試劑盒購自北京索萊寶生物科技有限公司,總RNA提取試劑盒、Annexin V-異硫氰酸熒光素(FITC)細胞凋亡檢測試劑盒購自碧云天生物技術有限公司。抗p53兔多克隆抗體、抗含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3兔多克隆抗體、抗β-Tubulin兔多克隆抗體均購自英國Abcam公司,羊抗兔免疫球蛋白(Ig)G二抗購自美國Cell Signaling Technology公司。iMark酶標儀購自美國Bio-Rad公司,CyFlow? Cube8 流式細胞儀購自德國Partec公司。
1.2細胞培養 HSC-T6復蘇后,重懸于DMEM高糖完全培養基(含10%胎牛血清)中,并置于37℃、5%CO2的培養箱中進行培養。當細胞密度達到90%時,胰酶消化并傳代。
1.3CCK-8法檢測HSCs增殖 取對數生長期細胞胰酶消化后調整細胞密度為2×105個/ml,取0.1 ml加入96孔板中,分為對照組、NGF低、中、高劑量組,每組設置3個復孔,繼續培養24 h至細胞貼壁。將不同劑量的NGF(0、100、200、300 ng/ml)分別加入各組細胞中,繼續培養24 h。每孔加入10 μl CCK-8,孵育4 h后,在450 nm處測定各孔吸光度(OD值)。細胞活力(%)=〔(對照組OD值-實驗組OD值)/(對照組OD值-實驗組OD值)〕×100%。
1.4流式細胞儀檢測HSCs凋亡 分別收集0、100、200、300 ng/ml NGF孵育24 h后的細胞1×106個/ml,磷酸鹽緩沖液(PBS)重懸,1 000 r/min離心5 min,棄上清,加入195 μl Annexin V-FITC結合液輕輕重懸細胞。加入5 μl Annexin V-FITC,輕輕混勻。加入10 μl碘化丙啶(PI)染色液,輕輕混勻。室溫避光孵育20 min,上流式細胞儀進行檢測。
1.5RT-PCR檢測α-平滑肌肌動蛋白(SMA)、Ⅰ型膠原、基質金屬蛋白酶組織抑制因子(TIMP)-1的mRNA表達水平 收集0、100、200、300 ng/ml NGF孵育24 h后的細胞,采用細胞總RNA提取試劑盒提取各組細胞總RNA,瓊脂糖凝膠電泳檢測RNA純度。采用逆轉錄試劑盒將RNA逆轉錄為cDNA。從NCBI數據庫中分別查詢α-SMA、Ⅰ型膠原、TIMP-1的核苷酸序列,設計RT-PCR反應引物:α-SMA-上游引物:5′-GAAGAGGAAGACAGCACAGC-3′,下游引物:5′-CACGATGGATGGGAAAACAG-3′;Ⅰ型膠原上游引物:5′-CTGGAAACAGACCAACAACC-3′,下游引物:5′-GGTCACGTTCAGTTGGTC-3′;TIMP-1-上游引物:5′-CAGATATCCGGTCGCCTAC-3′,下游引物:5′-GGGAAACACTGTGCACACC-3′;以β-Tubulin為內參:β-Tubulin-上游引物:5′-GGAAAGCTGCGACTGTCTCC-3′,下游引物:5′-CATCAGTGTTCTCCACCAGC-3′。以cDNA為RT-PCR的模板,配置反應體系,設置RT-PCR反應程序:95℃預變性5 min;95℃變性、58℃退火、72℃延伸各30 s,40個循環;72℃延伸5 min。采用ABI 7500 RT-PCR軟件進行數據分析。
1.6Western印跡檢測Caspase-3、p53的蛋白表達 收集0、100、200、300 ng/ml NGF孵育24 h后的細胞2×106個,加入200 μl 含苯甲基磺酰氟(PMSF)的放射免疫沉淀法(RIPA)裂解液充分裂解細胞,14 000 r/min離心10 min,收集上清,加入50 μl 5×十二烷基硫酸鈉(SDS)上樣緩沖液,沸水浴中煮10 min,上樣,SDS-聚丙烯酰胺凝膠電泳(PAGE),轉膜。5%脫脂牛奶室溫孵育1 h,分別加入1∶1 000稀釋的抗p53兔多克隆抗體、1∶500稀釋的抗Caspase-3兔多克隆抗體和1∶500稀釋的抗β-Tubulin兔多克隆抗體,4℃孵育過夜。含吐溫-20的磷酸鹽緩沖液(PBST)洗滌3次,每次8 min,然后分別加入1∶2 000稀釋的辣根過氧化物酶(HRP)標記羊抗兔IgG二抗,室溫孵育2 h,PBST洗滌3次,每次8 min,電化學發光顯色液顯色。
1.7統計學方法 采用SPSS20.0軟件進行方差分析、t檢驗、χ2檢驗。
2 結 果
2.1NGF對HSC-T6細胞增殖的影響 不同濃度的NGF作用HSC-T6細胞后,與對照組〔(96.01±7.47)%〕比較,NGF低、中、高劑量組的細胞生長速度明顯減緩,細胞活力均受到顯著的抑制〔(65.10±6.11)%、(50.73±6.02)%、(42.29±4.45)%,P<0.05〕。此外,隨著NGF劑量的增加,細胞活力也逐漸下降,差異有統計學意義(P<0.05)。
2.2NGF對HSC-T6細胞凋亡的影響 NGF低劑量組〔(26.61±3.40)%〕、NGF中劑量組〔(35.96±4.63)%〕、NGF高劑量組〔(43.08±4.32)%〕細胞凋亡率均顯著高于對照組〔(7.17±0.82)%〕,且隨著NGF劑量的增加,細胞凋亡率呈明顯的劑量依賴效應,差異有統計學意義(P<0.05),見圖1。
2.3NGF對HSC-T6細胞中α-SMA、Ⅰ型膠原、TIMP-1表達的影響 與對照組相比,NGF低、中、高劑量組細胞中α-SMA、Ⅰ型膠原及TIMP-1的mRNA相對表達水平均顯著下調,且隨著NGF作用濃度的增加,這種變化趨勢愈加明顯,差異有統計學意義(P<0.05)。見表1。
2.4NGF處理后HSC-T6細胞中Caspase-3、p53表達變化 對照組、NGF低、中、高劑量組細胞中Caspase-3蛋白的相對表達水平分別為0.31±0.03、0.67±0.04、1.05±0.07、1.85±0.13;p53蛋白的相對表達水平分別為0.28±0.03、0.57±0.05、0.98±0.08、1.57±0.12。與對照組相比,NGF低、中、高劑量組細胞中Caspase-3、p53的蛋白表達水平均明顯增強,并且隨著NGF劑量的增加,Caspase-3、p53蛋白水平增加更顯著,見圖2。
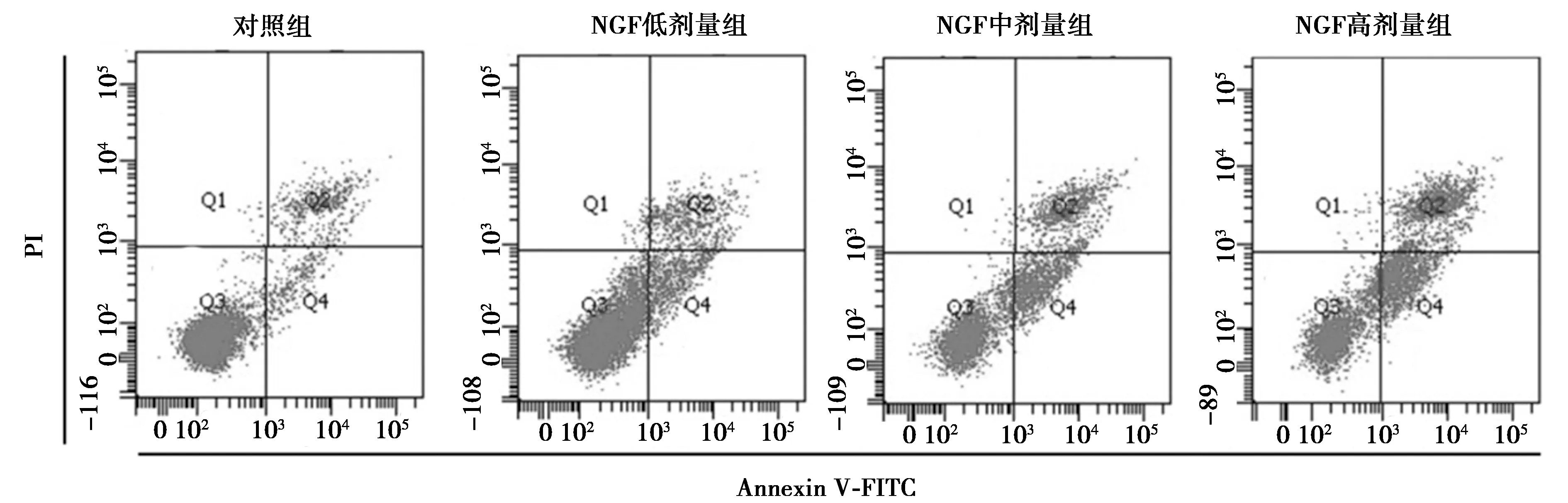
圖1 各組HSC-T6細胞的凋亡流式圖

表1 各組細胞α-SMA、Ⅰ型膠原、TIMP-1 mRNA相對表達水平
與對照組相比:1)P<0.05;與NGF低劑量組相比:2)P<0.05;與NGF中劑量組相比:3)P<0.05
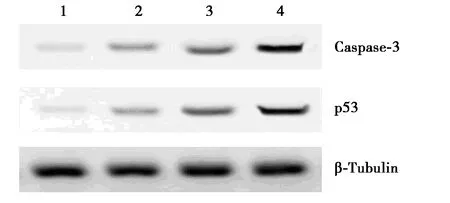
1~4:對照組,NGF低、中、高劑量組圖2 各組HSC-T6細胞凋亡相關蛋白表達
3 討 論
肝纖維化是肝臟對各種致病因素刺激造成的慢性損傷的一種損傷修復反應,主要病理表現為膠原等細胞外基質(ECM)的過度增生及過度沉積。肝纖維化是一個可逆的病理過程,致病因素的祛除可減輕肝纖維化程度甚至逆轉至正常,但在致病因素的長期作用下肝纖維化晚期也可發展為肝硬化甚至肝癌〔6〕。因此,深入闡明肝纖維化的發病機制對其臨床診斷和治療具有重要的價值。
正常肝臟中靜息狀態的HSCs具有儲存維生素A和脂肪,合成并分泌膠原、糖蛋白及蛋白多糖等基質,合成基質金屬蛋白酶及其抑制劑,表達細胞因子及受體等眾多生物學功能〔7〕。當肝臟受到各種致病因素的持續刺激時,活化的肝細胞、Kuffer細胞等釋放多種細胞因子通過多種途徑激活HSCs〔8〕。活化的HSCs在自分泌和旁分泌的共同作用下大量增殖,形態趨向于肌纖維母細胞,并伴隨諸多生物學功能的改變,包括維生素A、脂滴的減少或消失,Ⅰ、Ⅲ型膠原等ECM的增加,α-SMA、波形蛋白的表達增多,TIMP-1和TIMP-2分泌的增加,收縮性和趨化性的產生等,共同參與肝纖維化的發生與發展〔9,10〕。
NGF是神經生長因子家族中的一員,可通過與兩種不同的細胞表面受體(高親和力受體-TrkA和低親和力受體p75NTR)結合而發揮不同的生物學效應。NGF和TrkA結合可促進細胞神經細胞的存活和生長,研究顯示神經損傷后NGF的表達顯著上調〔11〕。當p75NTR和TrkA同時存在時,p75NTR可加強TrkA對NGF的應答,并且這種效應程度取決于p75NTR和TrkA的比例〔11〕。當p75NTR單獨存在時,p75NTR和NGF的結合可誘導細胞凋亡的產生〔12〕。研究顯示,NGF作為一種重要的組織修復因子,在多種神經系統及非神經系統腫瘤中發揮關鍵作用,廣泛參與腫瘤細胞的增殖、分化和轉移等過程〔13,14〕。Passino等〔15〕研究證明受損肝臟中肝細胞可表達大量的NGF;正常大鼠HSCs中p75NTR不表達,而在活化的HSCs中p75NTR高表達,表明p75NTR介導的信號通路在NGF促凋亡機制中起著重要作用〔16〕。
本研究表明TIMP-1表達的下降緩解了對基質金屬蛋白酶的抑制,從而加快了ECM的降解,進而改善肝纖維化的進程。Asai等〔17〕研究顯示,肝切除術后再生HSCs中產生的NGF可通過上調p75NTR和SMA的表達誘導活化HSCs的凋亡。
HSCs凋亡涉及Caspase12/Caspase3、死亡受體(Fas)CD95/Fas配體(FasL)、B細胞淋巴瘤(Bcl)-2/Bcl-2相關X蛋白(Bax)及PPAR等多條信號通路,來源于不同上游通路的激活信號可促進p53和Caspase3的活化并作用于相應的底物,從而促進細胞凋亡的發生〔18,19〕。本研究提示相關凋亡信號通路被明顯激活,NGF可能通過調控Caspase-3、p53的表達誘導HSC-T6的凋亡。Oakley等〔20〕研究也表明NGF可通過降低NF-κB的活性,上調Caspase-3的表達并誘導HSCs的凋亡。
綜上,NGF可能通過調控TIMP-1、Ⅰ型膠原、Caspase-3和p53等基因的表達抑制HSCs的增殖并促進其凋亡,從而發揮其抗肝纖維化的作用。但其促凋亡效應的相關上游調控機制仍需探索。

