KNDC1功能的研究進展
孫靖玉 林雅軍 (北京醫(yī)院國家老年醫(yī)學中心 衛(wèi)生部老年醫(yī)學重點實驗室,北京 100730)
激酶非催化C-葉結構域蛋白(KNDC)1又稱V-KNDC1(KIND)、RASGEF2、C10orf23、Very-KIND、bB439H18.3,是近年來發(fā)現(xiàn)的新基因,在腦的不同區(qū)域表達水平不同,尤其在小腦顆粒細胞中表達最高〔1〕。其在許多信號傳導通路的蛋白間分子識別和功能調控中扮演重要角色〔2〕。研究表明,KNDC1與神經元樹突的生長、人臍靜脈內皮細胞(HUVEC)的衰老及纖維核心蛋白的修飾有關,有望成為新的研究熱點。本文將 KNDC1 這一新調控因子的結構特點與其功能作用及其機制進行綜述。
1 KNDC1概況
1.1KNDC1的發(fā)現(xiàn) KIND從催化蛋白激酶折疊進化成用于信號蛋白的潛在蛋白質相互作用模塊。 Spir家族肌動蛋白和13型非受體磷酸酶(PTP 13型)在蛋白質的very-N-末端部分編碼KIND結構域。Mees等〔3〕報道了KIND蛋白家族第三個成員的表征和克隆,由于其含有兩個KIND結構域,將其命名為very-KIND(V-KIND)。其后,Huang等〔4〕也報道了KNDC1對神經元樹突生長調節(jié)的機制。
1.2KNDC1的分布 哺乳動物基因組中只有一個V-KIND基因,到目前為止只在脊椎動物中發(fā)現(xiàn)了該基因。為確定所有編碼蛋白質基因的組織特異性,對代表27種不同組織的95個人類個體的組織樣本進行RNA-seq檢測〔5〕,結果顯示KNDC1在腦、卵巢、腎上腺、子宮內膜、睪丸、甲狀腺等均有表達。Mees等〔3〕發(fā)現(xiàn),在小鼠胚胎發(fā)生過程中,V-KIND基因在發(fā)育中的神經系統(tǒng)中特異性表達。在成年小鼠中,V-KIND僅在腦中高表達,在卵巢中可以檢測到低表達。V-KIND主要在小腦顆粒和浦肯野細胞層的神經元細胞中特異性表達。李開濟等〔2〕在人臍血管內皮細胞中也檢測到KNDC1的表達。
1.3KNDC1的結構特點 人KNDC1基因位于10q26.3,長約65 959 bp,共有4個轉錄變異體,其中變異體1最長,翻譯后的蛋白質分子量約為54 191 kD,在239個有機體中具有人類基因KNDC1,其在恒河猴、小鼠、大鼠、雞和青蛙中保守性很強。KIND是公認的蛋白質-蛋白質相互作用模塊。迄今為止,發(fā)現(xiàn)的含KIND的蛋白質有4種,肌動蛋白 -核因子(Spir-2),蛋白酪氨酸磷酸酶(PTPN13),支架蛋白(FRMPD2)和V-KIND(腦特異性Ras鳥嘌呤核苷酸交換因子)。 其中V-KIND有2個KIND域(KIND1和KIND2),而其他3個蛋白只有一個〔6〕。與蛋白質家族的其他成員一樣,V-KIND在N末端具有KIND結構域。第2個KIND結構域位于蛋白質的中心部分。 C-末端半編碼Ras樣GTP酶(RasGEF)和RasGEF N-末端模塊(RasGEFN)的鳥嘌呤核苷酸交換因子結構示意圖如圖1。

圖1 KNDC1結構
2 KNDC1與神經元樹突的生長
大腦特異性RasGEF V-KIND 是小腦顆粒細胞正常樹突生長和適當?shù)倪\動協(xié)調所必須的。
2.1KNDC1負調控神經元樹突的生長 V-KIND過表達和RNAi敲低實驗表明,V-KIND在控制樹突生長中有重要作用,盡管潛在的分子機制仍然難以闡明〔1,6〕。前期研究表明,V-KIND的 RasGEF活性通過c-JUN氨基末端激酶(JNK)1和(或)細胞外信號調控激酶(ERK),經由 Ras-Raf-MAPK通路誘導微管關聯(lián)蛋白(MAP)2的磷酸化,MAP2磷酸化后與微管結合的活性增加,可以促進神經細胞樹突的長度增加,研究還發(fā)現(xiàn)抑制或敲低V-KIND的表達可以促進培養(yǎng)中的小腦顆粒細胞和海馬神經元的樹突生長,這表明其作為一種信號分子在發(fā)育過程中調控或抑制神經元樹突生長〔7〕。同時,KNDC1基因敲除小鼠運動功能沒有顯著變化,但年輕的基因敲除小鼠的握力有明顯增加,且在平衡相關試驗中運動操作性能展現(xiàn)出更好的趨勢。
2.2KNDC1調控樹突的生長的機制 最初研究假設KNDC1調控樹突的生長機制可能是V-KIND和MAP2之間的物理和功能關聯(lián),即V-KIND-MAP2相互作用和V-KIND誘導的MAP2 Thr磷酸化。MAP2是一種樹突狀微管相關蛋白,在神經元樹突生長中起負調控作用。在樹突發(fā)展過程中,早期的樹枝狀伸長和后期的樹枝狀成熟都需要正常的MT結構。 MAP2磷酸化水平在發(fā)育上受到樹突生長的控制〔8,9〕。 MAP2的磷酸化增加造成MAP2從MT分離,從而導致MT穩(wěn)定性降低和肌動蛋白束活性減弱〔10~14〕。Huang等〔4〕研究顯示V-KIND過表達促進MAP2 Thr磷酸化并導致樹突生長受損,而V-KIND RNAi敲低降低MAP2 Thr磷酸化并誘導樹突生長增加。此外,MAP2結合結構域KIND2單獨作為顯著的負調控因子,其過表達最終增加樹突長度和復雜性。以上表明V-KIND可能通過在樹突發(fā)育過程中控制MAP2磷酸化水平起作用。見圖2。
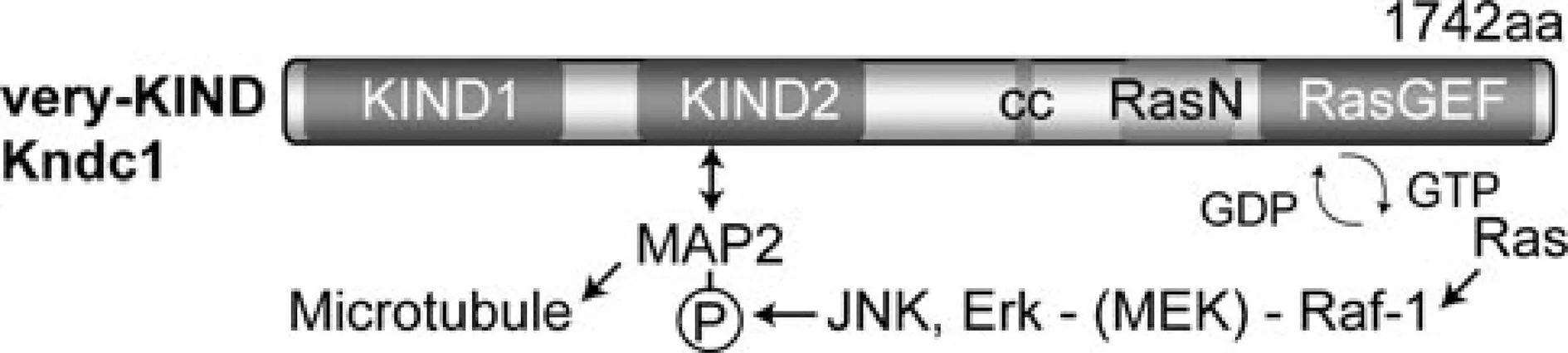
圖2 KNDC1調控樹突生長的機制
Huang等〔4〕通過生成一系列突變構建體來分析v-KIND-MAP2相互作用的結構-功能關系。在4種含KIND的蛋白質(Spir-2,PTPN13,F(xiàn)RMPD2和V-KIND)中的KIND結構域中,只有V-KIND的KIND2結構域特異性結合MAP2。 值得注意的是,在海馬神經元中表達的32個殘基的V-KIND MAP2結合核心多肽在促進樹突分支方面非常有效,這與V-KIND過表達的效果相反,但類似于V-KIND的敲低效應〔14〕,表明32個氨基酸核心多肽通過與內源性V-KIND競爭MAP2結合位點而充當顯性負調節(jié)分子。先前的體外研究表明,V-KIND的RasGEF活性通過激活Ras-Raf-MAP激酶途徑誘導JNK1和(或)ERK促進 MAP2 磷酸化〔7〕。JNK1對MAP2的磷酸化作用(如V-KIND過表達的下游〔14〕)增強了MAP2與微管的結合并促進其組裝的活性〔15〕,并且對JNK1的抑制(如V-KIND 敲低下游〔14〕)增加了樹突分支的數(shù)量,但縮短了樹突的平均長度〔16〕。對V-KIND-MAP2相互作用關鍵的結合核心模塊定義在小鼠V-KIND KIND2的32個殘基內和小鼠MAP2中心結構域的43個殘基內。 KIND2的MAP2結合核心模塊中氨基酸461、474和477處的3個Leu殘基促成了相互作用。 MAP2結合核心模塊本身作為海馬神經元中V-KIND的顯性負調節(jié)因子促進樹突分支。綜上,KIND2結構域通過V-KIND RasGEF(Ras途徑的激活劑)靶向與樹突微管細胞骨架相關的MAP2結合來調節(jié)樹突復雜性。
總之,V-KIND和MAP2相互作用核心模塊在調節(jié)海馬神經元和小腦顆粒細胞樹突生長和分支的結構和功能上起重要作用。對這些新鑒定的蛋白質-蛋白質相互作用核心模塊的進一步研究,包括三級結構分析,將進一步闡明V-KIND-MAP2相互作用調節(jié)樹突樹枝狀模式的分子機制,這對于塑造神經元通路至關重要,同時也可能是為理解某些MAP2相關的神經退行性疾病和精神疾病提供線索〔2,17〕。
3 KNDC1對HUVEC衰老作用的影響
KNDC1作為一種新型RasGEF蛋白,已被認為 是一個與細胞衰老相關蛋白〔3〕。研究發(fā)現(xiàn),KNDC1過表達會加速HUVEC衰老〔7〕,而敲低則會延緩其衰老〔18〕。
3.1KNDC1過表達促進HUVEC衰老的作用機制 李開濟等〔2〕通過構建人KNDC1腺病毒表達載體,觀察其在HUVEC中的表達及功能,證明了KNDC1過表達能夠誘導HUVEC衰老,且表現(xiàn)出明顯量效關系。姬勁銳等〔7〕在載體構建成功的基礎上,進一步對KNDC1促細胞凋亡的機制進行了研究,研究表明,KNDC1過表達通過啟動p53信號通路增加活性氧簇(ROS)表達。p53-ROS 正反饋環(huán)在調控KNDC1介導的細胞衰老中發(fā)揮重要作用,通過增加磷酸化p53蛋白的表達,KNDC1促進p53表達并放大p53-ROS反饋環(huán)的作用,進而加速細胞衰老的進程。因此,KNDC1在介導細胞衰老過程中的完整信號通路應該繼續(xù)研究,這將為衰老相關疾病提供新的治療方向。
3.2敲低KNDC1能預防HUVEC衰老的作用機制 Zhang等〔18〕研究表明,敲低KNDC1促進HUVEC的增殖并延緩衰老。 其作用機制為:KNDC1的敲低通過抑制p53-p21-p16信號傳導途徑增加了S和G2/ M期細胞的百分比。 此外,KNDC1的敲低增加了內皮型一氧化氮合酶(eNOS)的表達并改善了毛細管網絡的形成。 因此,敲低KNDC1有助于延遲內皮細胞衰老,表明KNDC1有可能成為藥物開發(fā)中的新靶點,延緩衰老過程,延長人類壽命。
4 KNDC1對禽蛋殼超微結構的影響
Duan等〔19〕發(fā)現(xiàn)KNDC1與乳頭密度(MD)顯著相關,認為KNDC1可能參與纖維核心蛋白質修飾,這決定了纖維核心是否是成核位點。 KNDC1對MD的確切功能作用仍有待闡明。對此提出了兩種方法來說明KNDC1的功能:直接方式,KNDC1直接與纖維核心蛋白相互作用;間接方式,KNDC1通過參與信號轉導來修飾纖維核心蛋白。MD可以通過KNDC1介導的在成核位點直接或間接修飾纖維核心蛋白來調節(jié)。研究KNDC1對蛋殼超微結構的遺傳影響,有助于提高蛋殼質量,有助于對雞蛋殼及其他生物礦化材料的超微結構和生物礦化的理解。
綜上所述,KNDC1功能與神經元樹突生長、HUVEC衰老、禽蛋殼超微結構密切相關,深入研究其功能和作用機制有可能為治療神經退行性疾病、抗衰老藥物研發(fā)、生物礦化材料提供更多信息。

