Cl-促進CuCl2在水中選擇性合成木糖醇二縮醛
湯瓊,李旭,董晉湘,2
(1.太原理工大學 化學化工學院,山西 太原 030024;2.廣東工業大學 輕工化工學院,廣東 廣州 510006)
生物質基多元糖醇縮醛可以作為綠色表面活性劑而備受關注[1-4]。但是多元醇和醛直接反應面臨產物選擇性問題[5-7]。木糖醇和醛反應會生成兩種產物,單縮醛和二縮醛。縮醛反應中,Lewis酸催化劑[8-10]比Br?nsted酸催化劑[11-13]具有更好的選擇性和更溫和的反應條件。但是,縮醛反應是脫水反應,水的存在會使Lewis酸催化效果減弱[14],在生成二縮醛的過程中伴隨有單縮醛的生成[4]。所以,穩定Lewis酸催化劑在水中的催化效果非常重要。本文報道了水為溶劑體系下,CuCl2作為催化劑,通過引入無機鹽NaCl,實現木糖醇和辛醛高選擇性地獲得木糖醇二縮醛。
1 實驗部分
1.1 試劑與儀器
木糖醇(99%)、辛醛(99%)、氯化銅(CuCl2·2H2O)、氯化鋰(LiCl)、氯化銨(NH4Cl)、氯化鉀(KCl)、氯化鈉(NaCl)均為分析純;實驗室用水為自制蒸餾水。
GC-2014C氣相色譜儀;GCMS-QP2010 ultra 氣質聯用儀;IRSpirit傅里葉變換紅外光譜儀;UV765紫外可見分光光度計。
1.2 木糖醇二縮醛的合成
向50 mL的反應管中依次加入木糖醇(27 mmol,4.2 g)、水(10 g,與木糖醇質量比例為2.4)、CuCl2(0.59 mmol,0.1 g)、NaCl(3.3 g,20%,相對于體系總質量)、辛醛(18 mmol,2.4 g),通入氮氣除去反應管內的空氣。在100 ℃下反應4 h。反應結束后冷卻,用高速離心機對反應后的混合物進行離心,隨后取上層有機相進行氣相分析。色譜條件:采用Rxi-5 HT色譜柱,FID檢測器(330 ℃),進樣口溫度(300 ℃),升溫程序為:起始溫度120 ℃平衡2 min,以10 ℃/min升溫至320 ℃,最后停留 8 min。
2 結果與討論
2.1 結構表征
2.1.1 GC和MS分析 反應后的氣相譜見圖1。

圖1 反應后獲得產物的氣相譜圖
通過氣質分析(圖1、圖2),在16.85~17.7 min出現的6個峰是木糖醇單縮醛,在22.1~22.8 min出現的5個峰是木糖醇二縮醛。木糖醇二縮醛的質譜圖出現了m/z為273的峰,對應的是[M (372)-C7H15]+的物種。通過質譜分析,可以獲得兩種斷裂方式,同時這兩種斷裂方式所對應的五元環狀結構如下所示。
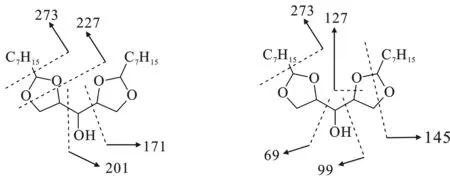
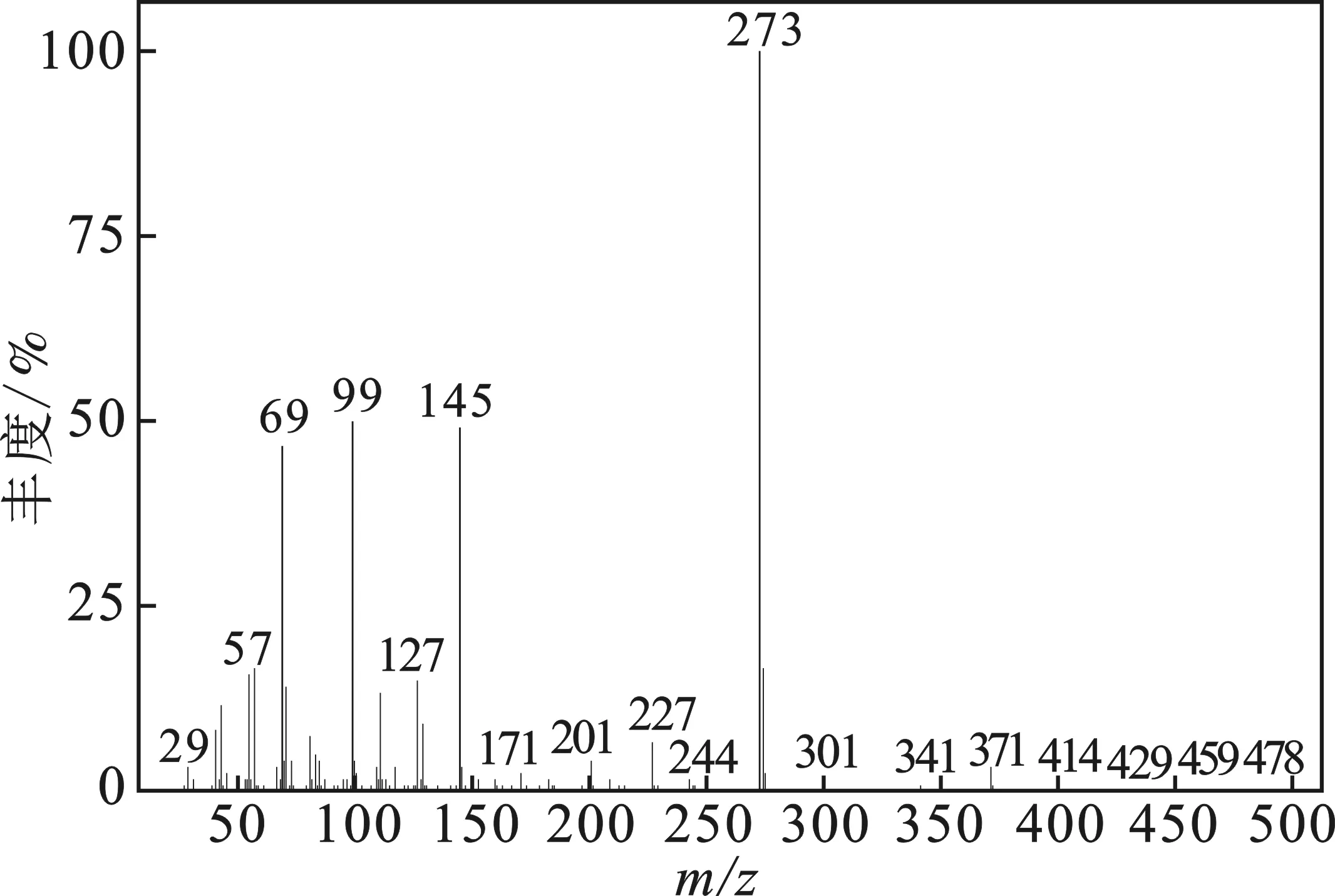
圖2 二縮醛質譜圖和碎片斷裂方式
2.1.2 IR分析 通過柱層析純化后,對獲得的產物進行IR分析,結果見圖3。

圖3 二縮醛產物的紅外譜圖
由圖3可知,在3 471 cm-1處為 —OH的特征吸收峰,在2 496,2 485,1 454,1 412,725 cm-1是C—H的特征吸收峰。而在1 129,1 039 cm-1則是C—O—C縮醛結構的特征吸收峰。通過高分辨質譜分析得到了[M-H]+的分子量是371.278 6,計算獲得的數值為371.279 2。所以可以確定獲得的產物是二縮醛。
2.2 不同含水量對CuCl2催化效果的影響
由圖4可知,不同水量加入到體系以后,水量越多轉化率越低,同時二縮醛的選擇性和產率也逐漸降低。這是因為CuCl2在水中發生了水解,使得催化效果減弱。由圖4a可知,當水和木糖醇的比例>1.2 時,二縮醛的選擇性低于50%,主要生成產物是單縮醛。但是當水和木糖醇的比例為0.6時,與無水條件相比,辛醛的轉化率只下降了5.2%,二縮醛的產率下降了11.7%。同時觀察到了反應后溶液顏色的變化。在水和木糖醇比例<1 時,反應后溶液的顏色呈黃綠色;當比例>1時,溶液的顏色為藍色。通過紫外-可見分光光度計分析了反應后溶液的吸光度,由圖4b可知,比例在<1時,在325 nm處出現了一個明顯向右擴展的峰。水和木糖醇的比例在>1時,在325 nm處向右擴展的峰逐漸消失。
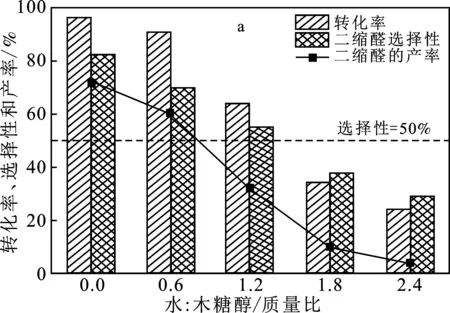

圖4 CuCl2不同含水量下的催化結果(a)和反應后水溶液的紫外吸收圖(b)
CuCl2在水中溶解以后,除了銅離子發生水解以外,還可以形成多種CuClx的配合物,[Cu]2+、[CuCl]+、[CuCl2]0、[CuCl3]-和[CuCl4]2-。根據文獻[15-16]推測,在325 nm處向外擴展峰是[CuCl3]-或[CuCl4]2-。這兩種物質很難在紫外上進行分辨,因為二者出峰位置非常接近,可能會發生相互的重疊。所以這兩者物質統稱為[CuClx]2-x(x>2)。[CuClx]2-x(x>2)在水中傾向于形成四配位的形式,水量的減少有利于穩定[CuClx]2-x(x>2)的結構,減少了Cl-和水分子的交換。但是在水量少的情況下,CuCl2也可以作為Lewis 酸進行催化,所以[CuClx]2-x(x>2)的作用還需要在大量水存在下進行驗證。
2.3 Cl-濃度的影響
為了證明[CuClx]2-x(x>2)在水溶液中的作用,通過增加Cl-的濃度促進配合物的形成。由于水和木糖醇的比例為2.4的條件下的紫外譜圖在325 nm處沒有顯示出明顯向右擴展的峰,選擇這個條件作為對比實驗。之后在體系中加入不同質量的NaCl以增加在水溶液中的Cl-的濃度,促進平衡向形成[CuClx]2-x(x>2)配合物的方向進行,結果見圖5。

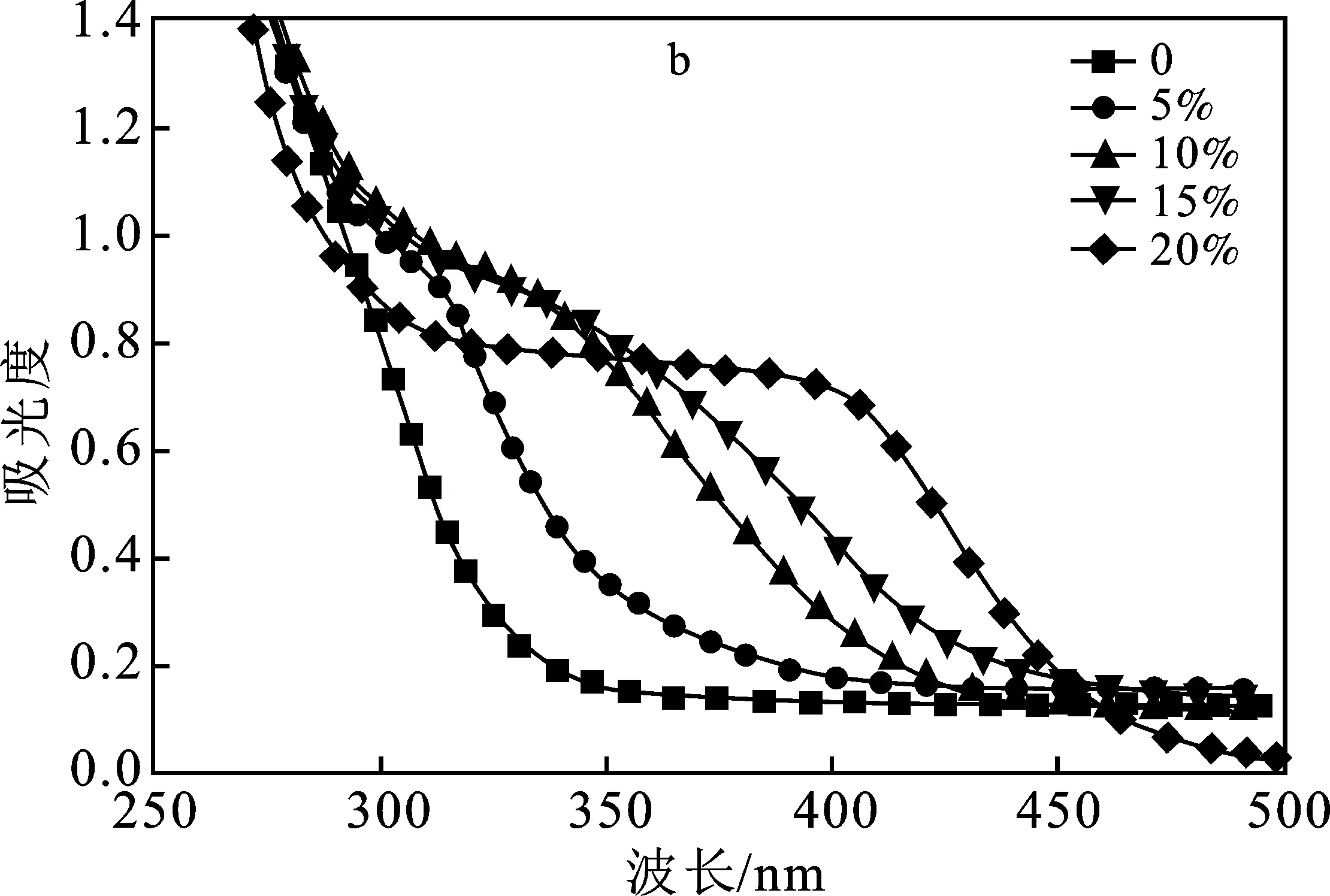
圖5 不同NaCl用量下的催化結果(a)和反應后水溶液的紫外吸收圖(b)
由圖5a可知,在沒有加入NaCl時,二縮醛的選擇性為29.2%,主要產物為單縮醛。當體系中NaCl的加入量為5% 時,選擇性迅速上升到58.6%。隨著NaCl加入量的增加,二縮醛選擇性逐漸增加,產率也逐漸增加。在NaCl的加入量為20% 時,即接近氯化鈉在水中的溶解度時,辛醛的轉化率為72.4%,二縮醛選擇性為95.3%,二縮醛的產率為65.8%。
反應后的溶液依然觀察到了顏色的變化,沒有加入NaCl時反應后的水溶液呈藍色,而在加入NaCl以后,溶液呈現了黃綠色,隨著NaCl濃度的增加,顏色越偏向黃色。同樣通過紫外-可見分光光度計分析了反應后溶液的吸光度,由圖5b可知,隨著Cl-濃度的增加,使得在325 nm處出現的峰向右擴展程度逐漸增加,溶液中[CuClx]2-x(x>2)配合物的濃度逐漸增加。由此可知,隨著體系中NaCl濃度的增加,[CuClx]2-x(x>2)配合物的濃度增加,使得反應轉化率和二縮醛選擇性增加。
2.4 不同氯化物的影響
為了排除陽離子的作用,選擇不同的陽離子的氯化物(LiCl、NaCl、KCl和NH4Cl)均在20%的濃度下進行催化反應。在相同條件下,不加入CuCl2作為催化劑進行反應時,這些鹽都無法催化反應的發生,而且轉化率都低于10%。這一結果排除了這些鹽作為催化劑的可能性。在CuCl2存在的條件下,由圖6可知,上述無機氯鹽的加入對于反應都有促進作用。在僅有CuCl2作為催化劑的條件下,辛醛的轉化率為24.0%,二縮醛的選擇性為29.2%。而加入氯化物后,二縮醛的選擇性明顯增加,并且4種鹽的選擇性均>90%。所以,由此可知促進選擇性的是Cl-的作用。
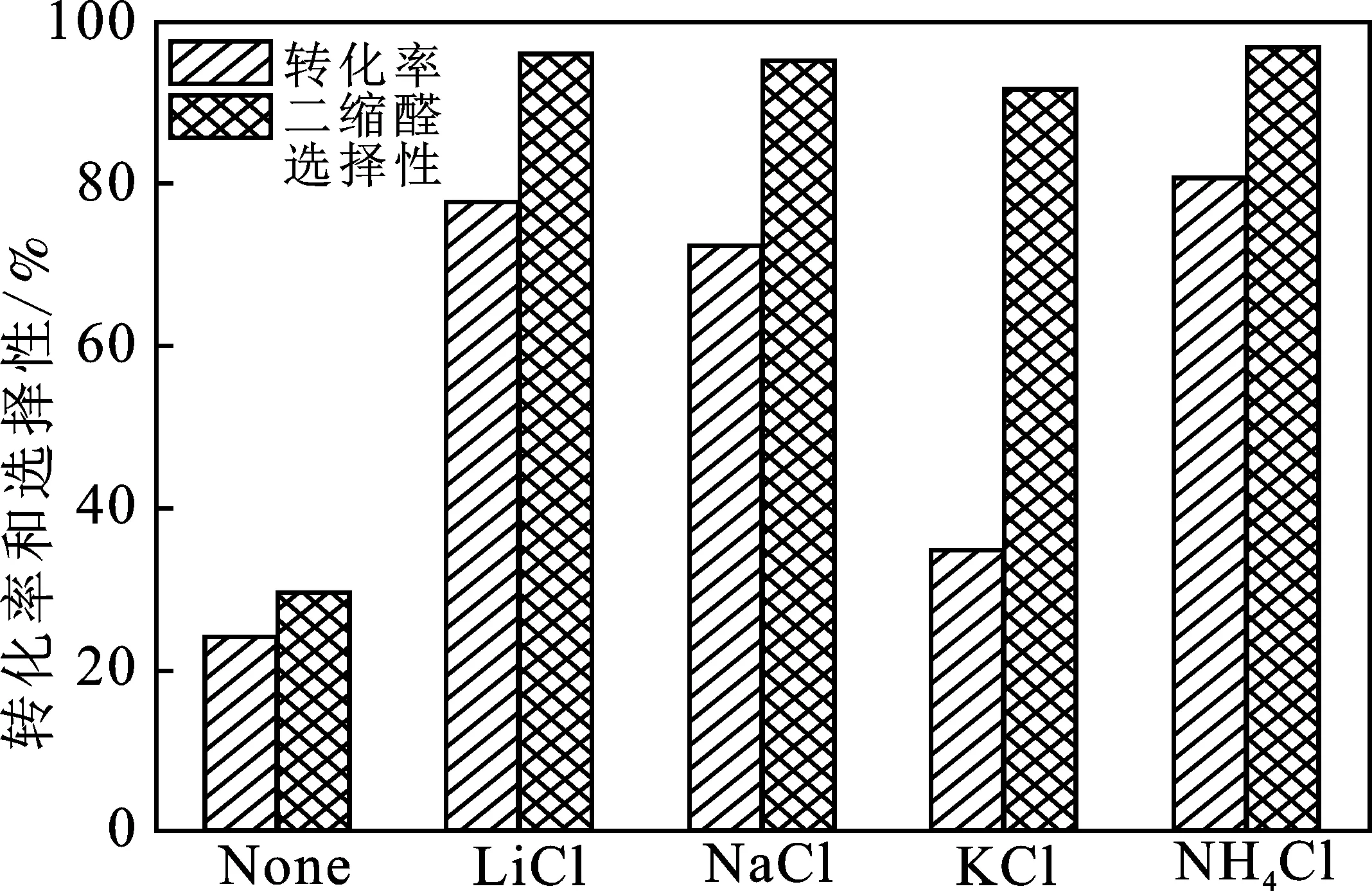
圖6 不同氯化物對反應辛醛轉化率和二縮醛選擇性的影響
2.5 溫度的影響
根據Collings等[17]報道,在高氯離子的濃度下(5 mol/L)下的CuCl2溶液,當溫度高于水沸點后,[CuCl3]-和[CuCl4]2-是溶液中的主要組成。那么,高溫也會促進二縮醛的生成。所以,在20%的NaCl濃度(≈ 5 mol/L)下考察了溫度對反應的影響,結果見圖7。
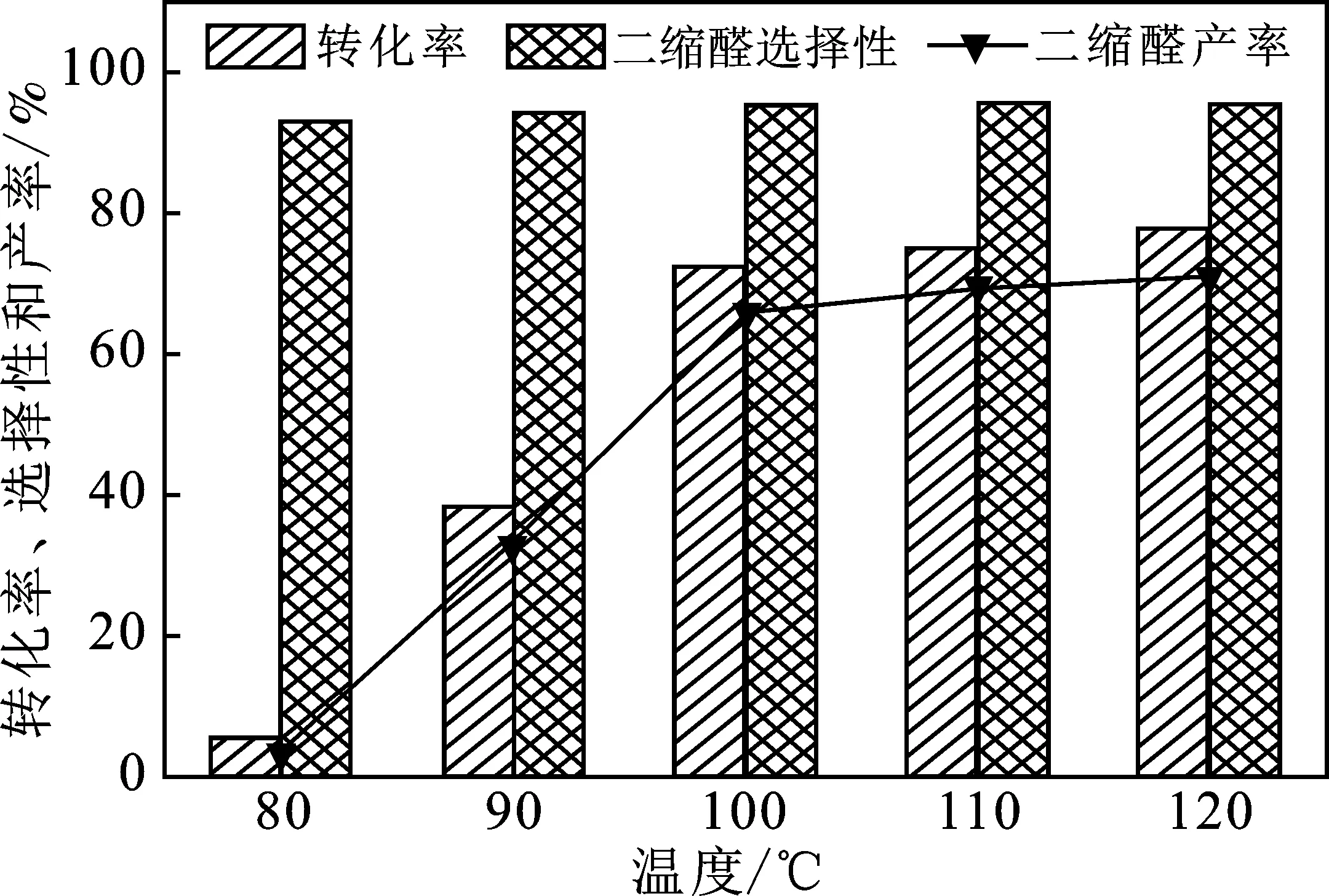
圖7 溫度對辛醛轉化率、二縮醛選擇性和產率的影響
由圖7可知,在溫度從80 ℃上升到120 ℃的過程中,反應的選擇性變化緩慢,只是從93.1%增加到95.6%。在80~100 ℃時,轉化率迅速從5.3%上升到了72.4%。而再升高溫度,轉化率的增加變緩。所以,[CuCl3]-和[CuCl4]2-的存在促進了二縮醛的生成。
2.6 時間的影響
為了理解催化劑在水中的變化,對反應時間進行了考察,結果見圖8。

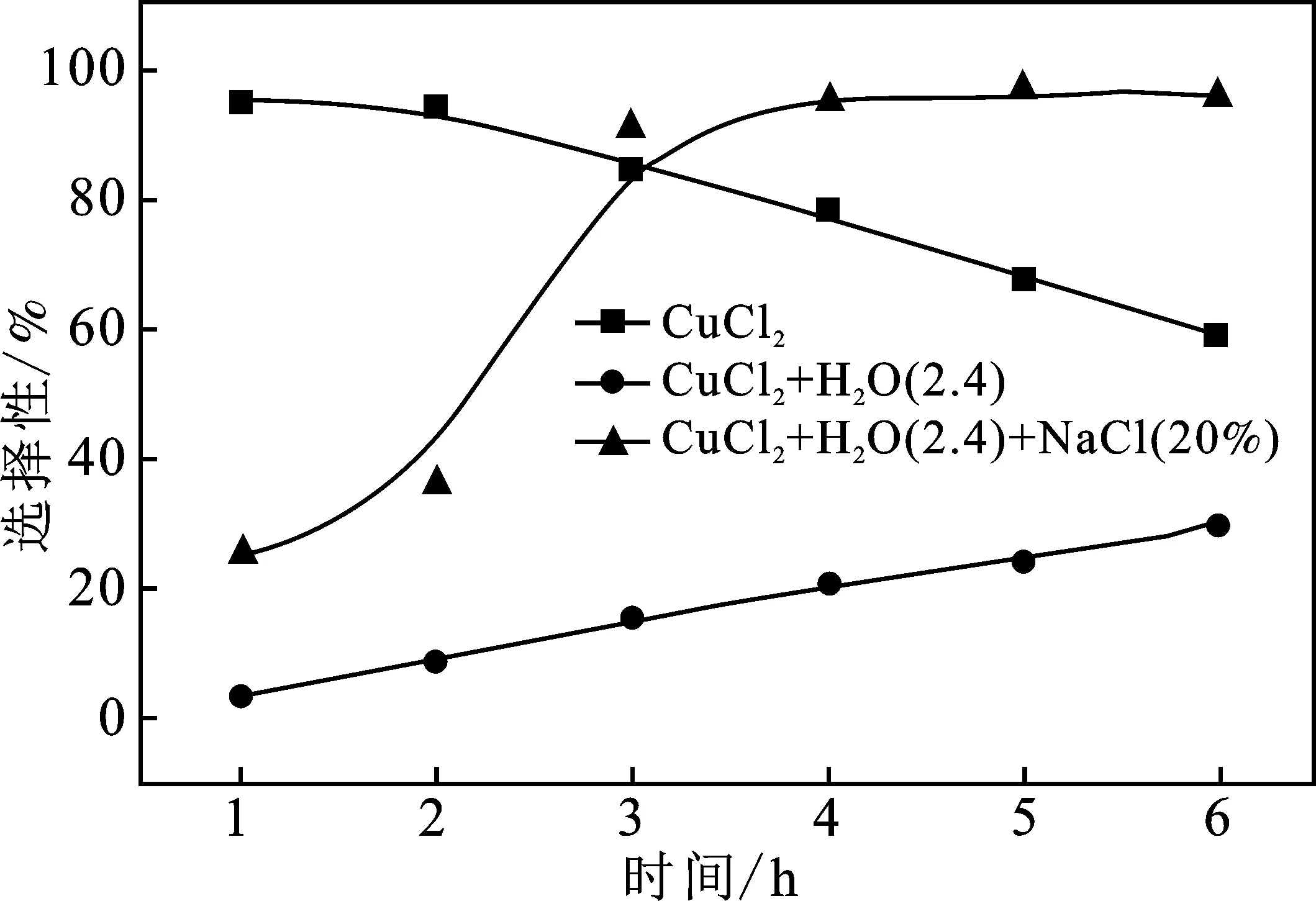
圖8 時間對辛醛轉化率和二縮醛選擇性的影響
由圖8可知,在無溶劑條件下,隨著反應的進行,選擇性逐漸降低,這是由于前期反應生成水使得催化劑失活,催化效果減弱。當在大量水存在下(水和木糖醇比例為2.4)的條件下,盡管隨著時間的進行二縮醛的選擇性逐漸增加,但是也只是從3.6%上升到了30.0%,低于50%的選擇性,所以主要產物仍然是單縮醛而不是二縮醛。當在體系中加入20% 的NaCl后,反應前2 h,顯示出與大量水存在下相接近的催化效果。轉化率和選擇性都很低,而在2 h以后,轉化率迅速上升,同時二縮醛的選擇性也迅速上升。這與無溶劑條件下起始2 h的變化趨勢相一致。而且氯化鈉存在下的二縮醛選擇性的數值與無溶劑條件下催化所獲得的最高選擇性接近。在2 h無溶劑條件下的二縮醛選擇性為94.8%,而在加入NaCl的條件下4 h的選擇性為95.3%。
3 結論
以CuCl2作為催化劑催化辛醛和木糖醇在水中反應得到以下結論。
(1)水的加入使得CuCl2的催化效果減弱,二縮醛選擇性和產率降低。
(2)當在體系中增加Cl-濃度,促使催化劑發生轉變,形成了[CuClx]2-x(x>2),能夠促進辛醛的轉化率和增加二縮醛的選擇性,氯化物陽離子對選擇性無影響。
(3)在水和木糖醇的比例為2.4,NaCl為20%,反應4 h,顯示出具有與無溶劑條件下所能獲得最高的二縮醛選擇性相接近的效果。

