miR-301b-3p通過靶向SATB2抑制肝癌細胞增殖
林輝 周懿 周燚 李慧芬 楊遠 侯克柱△
(1.上海市楊浦區市東醫院普外一科,上海 200438; 2.第二軍醫大學東方肝膽外科醫院肝外三科,上海 200433)
肝細胞癌(hepatocellular carcinoma,HCC)被認為是最常見的惡性腫瘤之一[1-2]。盡管臨床上肝癌治療取得了一定的進展,但肝癌患者5年生存率仍低于30%[3]。因此,迫切需要闡明肝癌發生和進展的潛在分子機制,為肝癌的治療提供有效的治療策略。MiRNA(miR)長度一般為18~25個核苷酸,通過與靶基因的3’-未翻譯區域結合,參與基因的轉錄后調控,具有癌基因和抑癌基因的作用,直接或間接參與腫瘤的發生、發展[4-5]。其中,miR-301b-3p被證實介導了多種腫瘤增殖,但miR-301b-3p在肝細胞癌中的作用尚未見報道。本研究通過體內和體外實驗,旨在探索miR-301b-3p過表達對肝細胞癌生物學行為的影響。
1 資料和方法
1.1研究對象 選取2012年12月至2014年12月在第二軍醫大學東方肝膽外科醫院進行根治手術的肝細胞癌組織和癌旁組織,共計61例。患者在手術前均未接受過藥物及放療化療處理。手術標本切下后,迅速將組織分離,無菌生理鹽水沖洗2遍后,用4%多聚甲醛固定,另外取部分組織標本裝于凍存管中置于液氮中速凍,置入-80 ℃冰箱冷凍保存備用。本實驗中標本的病理診斷由我院擁有5年以上經驗的病理醫師檢查每個組織樣本確認組織類型。本研究經第二軍醫大學東方肝膽外科醫院倫理委員會批準,所有樣本采集均獲得患者本人及其家屬的同意并均簽署了知情同意書。
1.2實驗方法
1.2.1細胞培養和轉染正常肝細胞系HL7702、人肝癌細胞株(HepG2﹑Hep3B﹑和 Huh7)購自中國科學院上海生命科學研究院生物化學與細胞生物學研究所細胞庫。細胞株使用DMEM高糖培養基進行培養,置于5% CO2、37 ℃的培養箱中培養。根據細胞倍增時間決定傳代時間,當細胞長滿瓶底的80%時,用0.25%胰酶(含0.02% EDTA)進行消化傳代。miR-301b-3p mimics和相應的對照組均購自上海吉瑪制藥技術有限公司。SATB2基因過表達慢病毒和對照物購自上海吉瑪制藥技術有限公司。具體轉染步驟依照參考文獻進行[6]。
1.2.2qRT-PCR檢測 采用Trizol提取組織和細胞總RNA,后續實驗依照參考文獻進行[6]。以U6為miR-497-5p的內參基因;β-actin為SATB2的內參基因。使用 2-ΔΔCt方法計算miR-497-5p和SATB2的相對表達水平。引物序列如下:
SATB2:上游5’-CCTGGCCCTGGGGTATTCT-3’下游5’-GTGCATCTGTCACATAACTGAGG-3’GAPDH:上游 5’-ACCACAGTCCATGCCATCAC-3’下游 5’-TCCACCACCCTGTTGCTGTA-3’
1.2.3CCK-8檢測細胞增殖能力 將經過轉染處理的各組HepG2細胞接種于96孔板中,置于37 ℃培養箱中培養12,24,36 h后,向每孔加入10 μL CCK-8溶液(上海東仁化學科技公司),注意避免產生氣泡,后置于37 ℃培養箱中孵育2 h后,用酶標儀測定450 nm處的吸光度,重復3次。分析兩組細胞的活力。
1.2.4雙熒光素酶報告實驗 用胰蛋白酶消化HepG2細胞,離心后重懸于含有10%胎牛血清的細胞培養基中并按1×104個細胞/孔的密度接種于48孔板上,培養24 h后(此時細胞密度為約50%),后續實驗依照參考文獻進行[6]。轉染48 h后,用Dual-Luciferase Reporter Assay裂解細胞并用多功能酶標儀測定熒光素酶活性。
1.2.5蛋白免疫印跡 具體實驗步驟依照參考文獻進行[6]。即,取對數生長期細胞,胰蛋白酶消化,離心收集沉淀,細胞裂解液裂解細胞,BCA蛋白定量試劑盒測定總蛋白濃度,聚丙烯酰胺凝膠電泳,轉膜,室溫封閉,一抗二抗溫育后,采用ECL顯影液曝光。一抗(濃度1∶500),二抗(濃度1∶2 000),本研究所用抗體SATB2和GAPDH均為兔抗人多抗,購自英國Abcam公司。
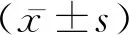
2 結 果
2.1miR-301b-3p在HCC組織和細胞系中的下調表達 為了確定miR-301b-3p在HCC中的表達情況,采用qRT-PCR技術檢測miR-301b-3p在HCC組織及對應癌旁組織、肝癌細胞、和肝細胞中的表達水平。如圖1A所示,與對應的癌旁組織(0.515±0.036)相比,miR-301b-3p在HCC組織(0.286±0.022)中表達顯著下調,差異有統計學意義(P<0.001)。此外,我們還檢測了miR-301b-3p在HCC細胞系(HepG2、Hep3B、Huh7)和肝細胞(HL7702)中的表達水平。結果顯示,與正常肝細胞HL7702(1.000±0.092)相比,miR-301b-3p在各HCC細胞HepG2(0.271±0.027)、Hep3B(0.231±0.166)、和Huh7(0.282±0.147)中表達下調表達,差異有統計學意義(P<0.05)(圖1B)。以上數據提示miR-301b-3p在HCC中能下調表達。

注:A.miR-301b-3p在肝癌組織及癌旁組織中的表達;B.miR-301b-3p在肝癌細胞株HepG2、Hep3B、Huh7和HL7702中的表達水平。*P<0.05;*P<0.001;*P<0.001。圖1 miR-301b-3p在HCC組織和細胞系中的下調表達
2.2過表達miR-301b-3p抑制HCC細胞增殖 為了研究miR-301b-3p在HCC的生物學功能,將miR-301b-3p mimic轉染至HepG2細胞中。qRT-PCR結果顯示,與對照組(1.000±0.110)相比,miR-301b-3p在miR-301b-3p mimic組(4.015±0.464)表達明顯升高,差異有統計學意義(P=0.003),證實HepG2細胞轉染效率較高(圖2A)。此外,我們還檢測了轉染后的細胞增殖情況。如圖2B所示,與對照組相比,miR-301b-3p mimic組細胞的增殖能力在24 h后顯著被抑制,差距有統計學意義(P<0.05)。 以上數據表明,過表達miR-301b-3p過有效抑制HePG2細胞的增殖能力。

注:A.模擬mir-301b-3p 轉染后,應用 qrt-pcr 定量檢測 mir-301b-3p 的表達水平;B. 模擬 mir-301b-3p 轉染 hepg2細胞12、24、36 h后,用 cck-8法測定細胞增殖率。*P<0.05;*P<0.001;*P<0.001。圖2 miR-301b-3p過度表達對細胞增殖的影響
2.3SATB2是miR-301b-3p在HCC細胞中的直接作用靶點 通過生物信息學分析,提示SATB23’-UTR含有miR-301b-3p的潛在結合靶點(圖3A)。為了驗證miR-301b-3p與SATB2之間的關系,將miR-301b-3p mimic轉染至HepG2細胞,隨后通過熒光素酶活性、qRT-PCR和Western Blot驗證miR-301b-3p與SATB2的作用關系。如圖3B所示,雙熒光素酶報告試驗證實在HepG2中,miR-301b-3p mimic組細胞的SATB2 wt 3’UTR熒光素酶活性(0.460±0.089)比對照組細胞的SATB2 wt 3’UTR熒光素酶活性(1.000 ±0.098)降低,具有統計學意義(P=0.015);miR-301b-3p mimic組細胞的SATB2 mut 3’UTR熒光素酶活性(0.967±0.083)與對照組細胞的SATB2 mut 3’UTR熒光素酶活性(1.013±0.021)相比無差別(P>0.05)。如圖3C結果提示miR-301b-3p mimic組細胞的SATB2的mRNA水平(0.299±0.035)顯著比對照組細胞的SATB2的mRNA水平(1.000±0.098)降低,具有統計學意義(P=0.003)。蛋白免疫印跡結果提示,轉染miR-301b-3p mimic可顯著降低HepG2中SATB2蛋白的表達(圖3D)。以上數據表明,miR-301b-3p靶向SATB2 3’-UTR并抑制其在HCC細胞中的表達。

注:A.在STAB2的3’UTR中預測miR-301b-3p靶位點;B.STAB2 wt的相對熒光素酶活性,轉染miR-301b-3p模擬物后,用雙熒光素酶報告試劑盒測定STAB2 mut;C.用qRT-PCR檢測SATB2 mRNA的表達;D.用Western Blot檢測SATB2蛋白的表達。*P<0.05、*P<0.01;*P<0.001。圖3 miR-301b-3p靶向肝癌細胞中的SATB2
2.4過表達SATB2可抵消miR-301b-3p對肝癌細胞增殖的抑制作用 為了確定SATB2是否參與miR-301b-3p調控的細胞增殖,首先將過表達miR-301b-3p慢病毒轉染至HepG2細胞系中過表達SATB2蛋白。轉染后,Western blot檢測IGF-1R蛋白水平驗證轉染效率。如圖4A所示,miR-301b-3p+SATB2組的SATB2蛋白表達明顯高于miR-301b-3p組。然后進行CCK8法檢測細胞增殖情況。研究數據顯示,miR-301b-3p+SATB2組HepG2細胞的增殖能力明顯高于miR-301b-3p組(圖4B)。以上數據說明,過表達SATB2蛋白抵消了miR-301b-3p對肝癌細胞增殖的抑制作用。

注:A.Western Blot檢測轉染過表達SATB2后HepG2細胞中SATB2蛋白的表達;B.轉染miR-301b-3p模擬和過表達SATB2后12、24、36 h,用CCK-8法檢測HepG2細胞增殖率。*P<0.05、*P<0.01;*P<0.001。圖4 miR-301b-3p通過抑制SATB2調節細胞增殖
3 討 論
越來越多的研究證實異常表達的miRNA在多種癌癥中發揮著重要的生物學作用,miRNA通過負調控基因的表達,在腫瘤的進展中扮演雙重角色,發揮癌基因或抑癌基因的作用[7]。本研究顯示miR-301b-3p在HCC 細胞系和組織中下調表達。為了闡明miR-301b-3p在HCC中的生物學作用,將miR-301b-3p mimic轉染至HepG2細胞。細胞功能學實驗證實,過表達miR-301b-3p可明顯抑制hepg2細胞的增殖能力。這些結果表明miR-301b-3p可能作為一種抑癌基因,其肝癌的進展中發揮抑制作用。
眾所周知,miRNA通過與下游靶基因結合發揮重要的生物學作用。SATB2是核基質相關的轉錄因子和表觀遺傳學調控因子,參與轉錄調控和染色質重構[8-9]。大量研究證實SATB2在多種惡性腫瘤中異常表達[10-11]。研究報道證實[12],SATB2在HCC中上調表達,過表達SATB2可以促進HCC細胞增殖和轉移。另有報道[13]證實MiR-34a通過下調SATB2抑制口腔鱗狀細胞癌的增殖、遷移和侵襲。然而,miR-301b-3p與SATB2在HCC中的關系尚不清楚。通過生物信息學分析,我們發現SATB2的3’-UTR中含有一個miR-301b-3p結合的靶點。通過熒光素酶報告試驗進一步證實了生物信息學的預測的準確性。此外,研究發現轉染miR-301b-3p mimic后,HepG2細胞中SATB2的mRNA和蛋白水平均下降,說明SATB2是miR-301b-3p的下游靶基因,且miR-301b-3p不僅可以在轉錄后水平調控SATB2的表達,而且也可以在轉錄水平調控SATB2的表達。為進一步確定miR-301b-3p是否通過調控SATB2表達介導肝癌細胞的增殖,將HepG2細胞轉染SATB2過表達慢病毒。在研究中發現,過表達SATB2可以抵消miR-301b-3p mimic對HepG2細胞增殖的抑制影響,表明miR-301b-3p通過抑制SATB2來調控HCC細胞的增殖能力。
綜上所述,本研究表明miR-301b-3p通過抑制細胞增殖在HCC中發揮抑癌作用。此外,我們首先發現miR-301b-3p通過抑制SATB2抑制HCC進展。這些發現是令人鼓舞的,并提示miR-301b-3p可能作為一種新的和有效的HCCin治療靶點。但miR-301b-3p調控HCC進展的機制仍有待進一步研究。

