貴州產燈盞細辛組織培養快速繁殖體系的建立*
張潔,毛春燕,劉利利,曾麗娜,劉紅美
(貴州醫科大學 醫藥生物技術工程研究中心 &生物與醫學工程重點實驗室,貴州 貴陽 550025;貴州醫科大學 生物與工程學院 生物技術教研室,貴州 貴陽 550025)
燈盞細辛[Erigeronbreviscapus(Vant.)Hand.-Mazz.]又名燈盞花,菊科飛蓬屬,屬多年生草本植物,主要分布于云南、貴州和四川等省[1]。燈盞細辛亦是貴州民間及少數民族地區常用藥材[2],被收載于2015年版《中國藥典》[3]、《貴州中藥資源》[4]和《貴州省中藥材、民族藥質量標準》[5],具有活血通絡止痛、祛風散寒功能,臨床上主要用于缺血性心腦血管病的治療[6-8],同時還可用于風濕、老年性癡呆、腎衰和糖尿病等疾病的治療[9-11],因此藥材市場需求量大。由于過度采集挖掘,野生燈盞細辛已逐漸枯竭。植物組織培養技術具有繁殖快、周期短、不受外界因素限制和易管理等優勢,是保護野生資源和解決藥材供求矛盾的有效措施[12]。目前,在燈盞細辛組織培養研究方面,學者們對不同外植體誘導效果、愈傷誘導影響因素以及快繁體系建立等方面進行了研究[13-18],但這些研究報道均為云南產區燈盞細辛,且在培養基和激素配比的種類、濃度都有所差異,貴州產區燈盞細辛組織培養快速繁殖的相關研究還未見報道。貴州省亦是燈盞細辛的重要核心產區之一[1,19],且燈盞細辛藥材的有效藥用成分含量高,質量優良[20-23]。因此,本研究通過對貴州產區的燈盞細辛種子進行無菌播種、獲取無菌苗后,采用不同激素配比的培養基對燈盞細辛離體培養過程中愈傷組織誘導、不定芽形成與增殖、壯苗生根移栽等的影響進行了系統研究,以期為貴州優質燈盞細辛種苗的快速繁殖提供技術支撐。
1 材料與方法
1.1材料
1.1.1種子 從貴州省六盤水地區野外采集的燈盞細辛種子,由貴州醫科大學生物技術教研室劉紅美教授鑒定。
1.1.2主要試劑和儀器 配制 Murashige&Skoog (MS)或1/2 MS培養基的化學試劑:瓊脂、6-芐基腺嘌呤(6-benzyladenine,6-BA)、奈乙酸(α-naphthalene acetic acid,NAA)、吲哚丁酸(indole-3-butyric acid,IBA)、甘氨基、肌醇、煙酸、維生素B1、維生素B6及蔗糖均購于北京索萊寶科技有限公司,硝酸銨、硝酸鉀、氯化鈣、硫酸錳、磷酸二氫鉀、硫酸鋅、硼酸、碘化鉀、鉬酸鈉、硫酸銅、氯化鈷、乙二胺四乙酸二鈉及硫酸亞鐵均購于天津市致遠化學試劑有限公司;LDZM-60L立式壓力蒸汽滅菌器購自上海申安醫療器械廠,SW-CJ-1FD 型超凈工作臺購自蘇州安泰空氣技術公司。
1.2方法
1.2.1培養基及培養條件 以MS和1/2MS為基本培養基,添加不同濃度的激素(6-BA、NAA、IBA),具體濃度及培養基配方見表1,所有培養基添加3%蔗糖和0.9%瓊脂,pH 6.0~6.1,高壓滅菌條件121 ℃、25 min。培養條件為(25±2)℃、光照時間13 h/d,光照強度1 200 lx。
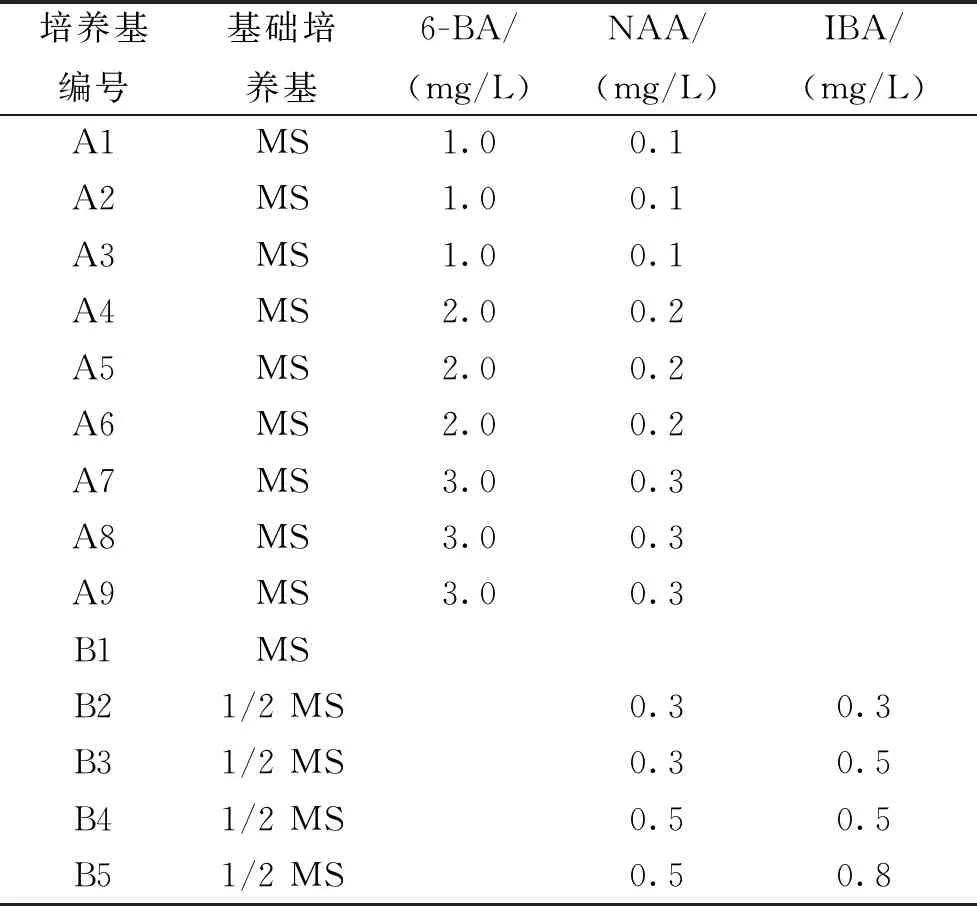
表1 培養基編號和配方Tab.1 Medium number and formulations
注:空格表示沒有加該材料。
1.2.2初代培養 將燈盞花種子用紗布包裹后扎好口,按常規沖洗干凈后滅菌處理;用75%乙醇浸泡0.5 min,無菌水沖洗2次,3%次氯酸鈉浸泡2 min,無菌水沖洗3次,3%次氯酸鈉浸泡3 min,將種子接種到不含激素的1/2 MS培養基上進行初代培養以獲取無菌苗。
1.2.3葉片和葉柄愈傷組織的誘導 將獲得的生長健壯的無菌苗葉片切割成0.5 cm×0.5 cm,葉柄切成長1 cm的小段,分別平放接種到添加不同濃度的6-BA和NAA的A1~A9培養基中;每種培養基接種5瓶,每瓶接種3~5個外植體,重復3次;培養10 d后觀察愈傷組織的誘導生長情況,用“+”表示出現愈傷組織的體積,“+”越多表示愈傷體積越大。
1.2.4不定芽的分化與增殖 將愈傷組織誘導分化的叢生芽切成單株接種于添加不同濃度的6-BA和NAA的A1-A9培養基中,接種要求同1.2.3,培養20 d后對不定芽的分化增殖與生長情況進行觀察統計。
1.2.5生根移栽 將培養后高1.5~2.0 cm的無根小苗轉接到添加不同濃度的NAA和IBA的B1~B5培養基中誘導生根,接種要求同1.2.3,待組織培養苗根系生成、并長至合適長度后后進行煉苗移栽,室內放置2 d,去封口膜,輕輕洗凈苗根部培養基,移栽到高溫滅菌后的泥土與珍珠巖1 ∶1混合的基質中。
1.3統計學分析
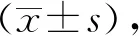
2 結果
2.1初代培養獲取無菌苗
采用2次3%次氯酸鈉的滅菌方法對種子進行滅菌,污染率為10%;接種6 d左右,種子開始萌發,萌發率可達65%。
2.2葉柄愈傷組織的誘導與分化
葉柄誘導愈傷組織結果表明A3培養基愈傷誘導時間較短,10~15 d就出現愈傷組織,20 d后愈傷組織的體積較大,且新增芽點多,有利于下一步芽的誘導分化,故選擇A3培養基(MS+1.0 mg/L 6-BA+0.3 mg/L NAA)為最適宜葉柄愈傷誘導的培養基。見表2。
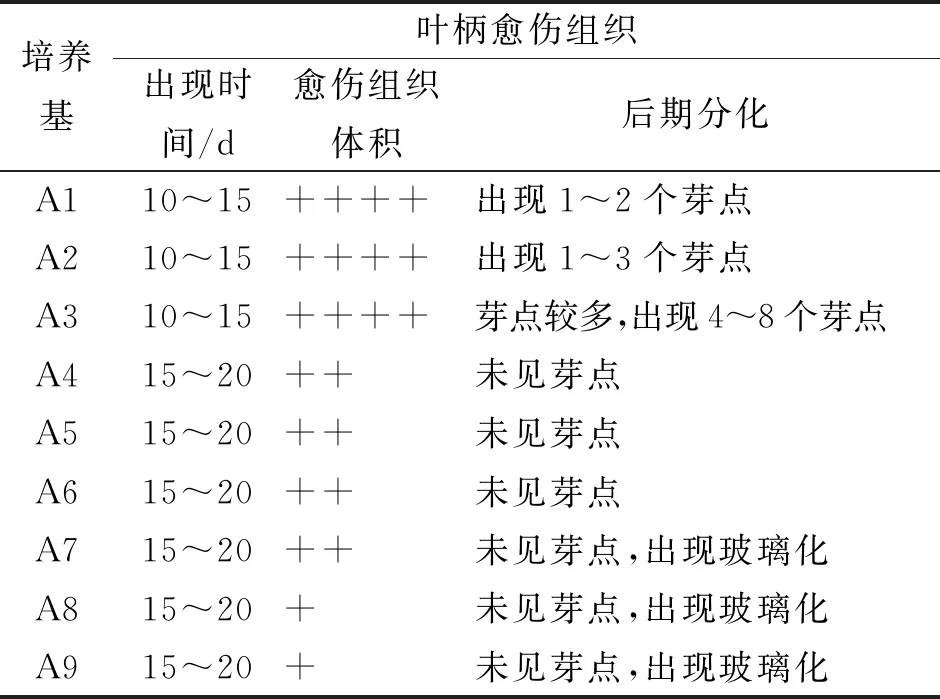
表2 不同培養基對葉柄愈傷組織誘導的影響Tab.2 Effect of different medium on callus inducement of E.breviscapus petiole
注:+表示出現愈傷組織的體積,越多表示愈傷體積越大。

10 d 20 d圖1 3號培養基中不同時間葉柄愈傷組織誘導Fig.1 The effect of No.3 medium on callus induction
2.3葉片愈傷組織的誘導與分化
葉片接種于培養基后,早期均出現膨大、卷曲,顏色由深綠變成淺綠;培養至第15天時僅A7培養基中葉片上出現較小的突起;培養至第20天時所有培養基中的葉片均逐漸發黃,A3、A4、A7、A8及A9培養基中出現較為少量的愈傷組織,結構較為致密;隨著培養時間延長,愈傷組織增殖均不明顯,無芽點出現,愈傷組織和葉片逐漸出現黃化、褐化。因此,葉片不適合作為外植體。
2.4不定芽的增殖
將A3號培養基中葉柄誘導的帶叢生芽的愈傷切成小塊或單株接種到A1~A9培養基中培養,20 d后不定芽的增殖結果表明A6培養基的增殖倍數相對較高,可達12倍,分化出的不定芽多,且無菌苗的生長狀況也較好,不定芽較粗壯,葉片大,顏色深綠,無玻璃化現象。故 選擇A6培養基(MS+2.0 mg/L 6-BA+0.3 mg/L NAA)為最佳分化增殖培養基。見表3、圖2。
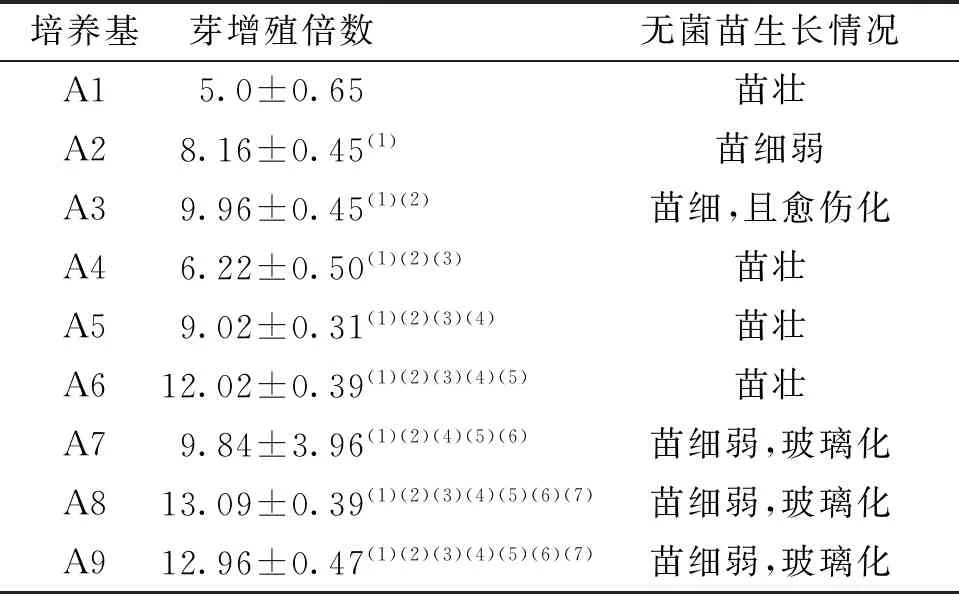
表3 不同培養基對組培苗增殖的影響Tab.3 The effects on the proliferation of tissue culture seedlings in the different mediums
注:(1)與A1比較,P<0.05;(2)與A2比較,P<0.05;(3)與A3比較,P<0.05;(4)與A4比較,P<0.05;(5)與A5比較,P<0.05;(6)與A6比較,P<0.05;(7)與A7比較,P<0.05。

圖2 6號培養基中增殖的燈盞細辛組培苗Fig.2 Seedlings of E.breviscapus in the sixth medium
2.5生根培養
將增殖培養20 d無根小苗轉接到B1~B5培養基中,10 d后觀察生根情況。結果表明,燈盞細辛接種在不添加激素的MS培養基中時生根率可達74.44%,但生根數目較少,根較細長;降低培養基無機鹽濃度,并添加生長素0.3 mg/L NAA和0.3mg/L IBA后生根率提高到89.58%,根生長較為粗壯;當NAA濃度增加到0.5 mg/L和IBA增加至0.8 mg/L時,不僅生根率達到至100%,且生根數目最多,根粗苗壯,故B5培養基(MS+2.0 mg/L 6-BA+0.3 mg/L NAA)生根效果最佳,為適宜生根的培養基;待燈盞細辛的根生長至3 cm左右時,即可進行煉苗移栽,成活率可在85%以上。見表4。
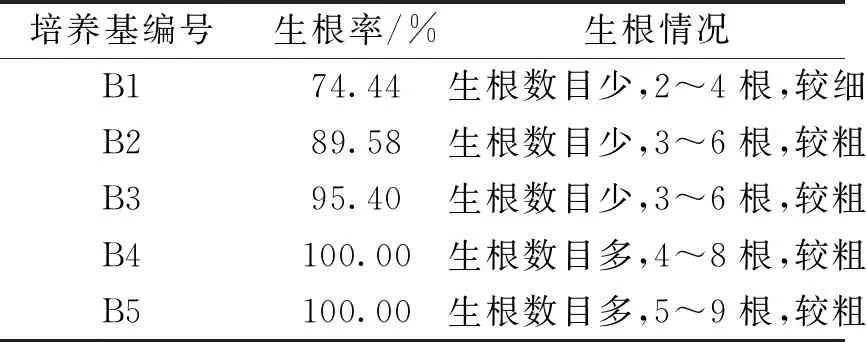
表4 不同培養基對燈盞細辛無菌苗生根的影響Tab.4 The effects on the rooting of aseptic seedlings in the different mediums
3 討論
為了對保證野外采集種子的滅菌效果,同時增強種子對滅菌劑的耐受性,本研究采用了分開2次2%次氯酸鈉的滅菌方法,滅菌效果較好,污染率低,同時60%的種子能夠萌發,從而有效建立無菌體系,獲取無菌苗。在植物組織培養快繁體系建立的過程中,激素的種類與配比對于愈傷組織誘導、器官分化、增殖、生根起著關鍵性作用[24]。在愈傷誘導實驗中,本研究中選用了最常用的6-BA和NAA激素,采用不同的濃度配比,對葉柄進行愈傷誘導,結果表明的細胞分裂素6-BA為1.0 mg/L時,出現愈傷時間較早,體積也較大,其中又以與0.3 mg/L的生長素NAA的搭配效果最好,出現的芽點較多,非常有利于后期的分化增殖和植株再生。故篩選出的最適愈傷誘導培養基為MS+1.0 mg/L 6-BA+0.3 mg/L NAA。另一方面,不同外植體在植物組織培養中誘導愈傷的反應能力是有差異的[25]。實驗中以燈盞細辛的葉片作為外植體時,愈傷誘導反應不佳,并出現褐化、黃化現象,故在該試驗條件下,葉柄比葉片更適合做為誘導愈傷組織的外植體,這與劉成洪等[16]研究結果一致。
細胞分裂素6-BA對不定芽的增殖和分化有著較強的促進作用,但濃度過高時往往會增加再生芽畸形、玻璃化的概率[26-27]。本實驗中NAA濃度一定時,隨著6-BA濃度的升高,芽的增殖倍數明顯增高,當6-BA升至3.0 mg/L時,分化的芽增多,增殖倍數最高可達13倍,但苗較細弱、容易出現玻璃化。因此,6-BA的適宜濃度為2.0 mg/L。同時,適量的生長素配合6-BA使用,不僅能夠促進植株的生長也能提高芽的增殖與分化能力[28]。實驗中6-BA為2.0 mg/L時,搭配0.3 mg/L的NAA,增殖倍數可達到12倍,無菌苗生長狀態也良好,故此為分化增殖最適宜的濃度搭配。
生根實驗結果表明,燈盞細辛組培苗的生根較為容易,在不添加激素的情況下,生根率就可達74.44%,只是根數目較少,根不夠粗壯,不利于移栽。實驗中,采用降低培養基無機鹽濃度的1/2 MS培養基和添加生長素NAA和IBA,均有利于提高生根率和生根質量。隨著NAA和IBA的濃度升高,都能夠使生根率和生根數目隨之增高,NAA濃度為0.5 mg/L、IBA為0.8 mg/L時,獲得最佳生根效果,這與吳毅歆等[17]采用的激素配比結果一致。生根效果好的組培苗非常有利于提高后期的煉苗移栽的存活率,同時移栽初期也要注意蓋塑料薄膜保濕,移栽后成活率在85%以上,可用于種植推廣。
綜上所述,本研究建立了適宜于貴州產區的燈盞細辛的組培快繁體系,從葉柄外植體誘到再生苗移栽大約只需要50~60 d,和常規人工栽培育苗需要80~90 d的周期相比,大大縮短了育苗周期,有利于快速、高效、低成本的為人工栽培提供大量品質優良的種苗,對于發展和推廣貴州燈盞細辛中藥材的規模化種植具有重要意義。

