FoxO1過表達對甲狀腺乳頭狀癌細胞增殖、凋亡和細胞周期的影響及其機制
魯莉,潘虹,石朋飛
武漢市中心醫院,武漢430014
甲狀腺癌是一種內分泌惡性腫瘤,可分為甲狀腺乳頭狀癌(PTC)、濾泡性甲狀腺癌、髓樣甲狀腺癌和未分化間變性甲狀腺癌[1]。其中PTC占所有甲狀腺惡性腫瘤的80%[2,3]。PTC的病因和發病機制尚不清楚,探索PTC發生發展的潛在分子機制可能為臨床治療提供新的思路。轉錄因子叉頭盒蛋白O1(FoxO1)是FOXO家族的重要成員之一,參與細胞增殖、細胞周期控制、細胞凋亡、細胞分化、代謝和DNA損傷修復等多種功能調控[4]。研究顯示,FoxO1在許多人類惡性腫瘤中表達下調,包括乳腺癌、前列腺癌、淋巴瘤等[5~7]。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信號通路已被證明在PTC的進展過程中發揮重要作用[8,9]。FoxO1的活性受PI3K/Akt通路調控。PI3K/Akt在多個位點磷酸化FoxO1,使FoxO1進入細胞質,從而降低其轉錄活性[10]。Bim是PI3K/Akt信號通路的下游靶點,Bim是Bcl-2家族中僅含一個BH3結構域的蛋白,具有促凋亡活性,參與多種不同類型細胞的凋亡調控。2018年7月~2019年3月,本研究觀察了過表達FoxO1對甲狀腺乳頭狀癌細胞KTC-1增殖、凋亡和細胞周期的影響,并初步探討了相關機制。
1 材料與方法
1.1 細胞、試劑及儀器 甲狀腺乳頭狀癌細胞株KTC-1(上海中科院細胞庫);RPMI-1640培養基、胎牛血清、青霉素-鏈霉素(美國Gibco公司);FoxO1過表達慢病毒載體pLV-FoxO1、空載體pLV-control(上海吉瑪制藥技術有限公司);MTT細胞增殖及細胞毒性檢測試劑盒、Annexin V-FITC/PI雙染細胞凋亡檢測試劑盒(上海碧云天公司);PI單染細胞周期檢測試劑盒(上海凱基公司);全蛋白提取試劑盒、二喹啉甲酸(BCA)法蛋白定量測定試劑盒(南京建成生物工程研究所);兔抗人FoxO1、PI3K、Akt、p-Akt(ser473)、Bim及GAPDH一抗、辣根過氧化物酶(HRP)標記的山羊抗兔免疫球蛋白G(IgG)二抗(英國Abcam公司);CO2細胞培養箱(美國Thermo公司);熒光顯微鏡(日本Olympus公司);流式細胞儀(美國BD公司);酶標儀(美國Bio-Tek公司);全自動化學發光分析儀(上海天能公司)。
1.2 細胞分組及慢病毒轉染 取處于對數生長期的KTC-1細胞并用胰酶消化處理,離心收集后,以1.0×105/mL將細胞重懸于培養液中并接種于6孔板中,于37 ℃、5% CO2條件培養箱中培養至細胞融合度達40%。隨機將6孔細胞分成對照組和過表達組,每組3個平行復孔。對照組感染pLV-Control慢病毒,過表達組感染pLV-FoxO1慢病毒(感染復數值均為100)。感染72 h后,顯微鏡下觀察細胞熒光表達情況,當熒光表達率大于90%時,提取兩組細胞總蛋白,Western blotting法檢測FoxO1蛋白。過表達組FoxO1蛋白相對表達量高于對照組(分別為0.67±0.08、0.24±0.05,P<0.05),提示FoxO1基因在KTC-1細胞成功過表達。
1.3 細胞增殖能力觀察 采用MTT法和克隆形成實驗觀察細胞增殖能力。①MTT法:將兩組細胞以1.0×104/孔接種于6孔板中,每組設置3個平行復孔,記錄0 h時細胞在490 nm處的光密度值(OD值);在37 ℃、5% CO2、飽和濕度的培養箱中培養48 h,按MTT試劑盒說明操作,測量各孔細胞在490 nm處的OD值。細胞增殖率=(OD48 h-OD0 h)/OD0 h×100%。②克隆形成實驗:將兩組細胞以胰酶消化后重懸于含10%胎牛血清的RPMI-1640培養基中,以100/皿分別接種于含37 ℃預溫培養液(10 mL)的培養皿中,輕輕轉動,使細胞分散均勻;置于37 ℃、5% CO2、飽和濕度的細胞培養箱中培養2周,期間每3 d觀察一次細胞生長狀況并換液;當培養皿中出現肉眼可見的克隆時終止培養;棄去上清液,用PBS浸洗2次,加5 mL的4%多聚甲醛固定細胞15 min,去固定液,結晶紫染液染色10~30 min,流水緩慢洗去染色液,干燥后觀察拍照,計算克隆形成數。
1.4 細胞凋亡情況觀察 采用Annexin Ⅴ-FITC/PI雙染檢測細胞凋亡。取兩組細胞以1.0×104/孔接種于6孔板中,每組設置3個平行復孔,共培養48 h。按照Annexin Ⅴ-FITC/PI雙染試劑盒說明操作:1 000 g離心5 min,棄上清,收集細胞;加入1 mL預冷的PBS,輕輕震蕩使細胞懸浮,1 000 g、4 ℃離心5 min,棄上清,重復2次;將細胞重懸于200 μL的Binding buffer;加入10 μL的Annexin V-FITC和10 μL的PI,輕輕混勻,4 ℃避光孵育30 min;加入300 μL的Binding Buffer,隨即進行流式細胞儀檢測,使用CXP軟件分析并記錄結果。凋亡率=第二象限B2細胞占比+第四象限B4細胞占比。
1.5 細胞周期分布觀察 PI單染檢測細胞周期。取兩組細胞以1.0×104/孔接種于6孔板中,每組設置3個平行復孔,共培養48 h。按照PI細胞周期流式檢測試劑盒說明書進行操作:收集細胞,胰蛋白酶消化;用1×PBS溶液浸洗2次,移至1.5 mL離心管中;加入冰冷70%乙醇3 mL固定細胞,4 ℃放置24 h;用冷PBS清洗細胞2次,1 000 g離心5 min,棄上清;加入1 mL的PI染液(含RNase),輕輕震蕩混勻,室溫下避光放置30 min;用流式細胞儀上機檢測;CXP軟件分析并記錄結果。
1.6 PI3K/Akt/Bim信號通路相關蛋白表達檢測 采用Western blotting法。收集培養48 h后的各組細胞,采用全蛋白提取試劑盒提取蛋白。用BCA蛋白濃度檢測試劑盒檢測蛋白濃度。取20 μg蛋白和4 μL的2×SDS上樣緩沖液混合均勻,100 ℃變性10 min。上樣,SDS-PAGE凝膠電泳分離后轉至PVDF膜上,5%脫脂牛奶封閉1 h。PBS洗膜后,分別加入一抗(PI3K、p-Akt、Akt、Bim和內參GAPDH,稀釋比均為1∶1 000)4 ℃孵育過夜。PBS洗膜,加入HRP標記的二抗羊抗兔IgG(1∶5 000)室溫孵育0.5 h。PBS洗膜,ECL試劑顯色。采用Quantity One圖像分析軟件進行灰度值分析,以目的蛋白灰度值與內參蛋白灰度值的比值作為目的蛋白相對表達量。
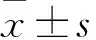
2 結果
2.1 兩組細胞增殖能力比較 過表達組、對照組細胞增殖率分別為33.21%±6.78%、79.37%±8.49%,克隆形成數分別為(28.67±4.50)、(66.33±7.36)個/皿。過表達組細胞增殖率、克隆形成數均低于對照組(P均<0.05)。
2.2 兩組細胞凋亡率比較 過表達組、對照組細胞總凋亡率分別為69.47%±12.35%、27.22%±6.49%,過表達組細胞凋亡率高于對照組(P<0.05)。
2.3 兩組細胞周期分布比較 過表達組、對照組G0/G1期細胞比例分別為79.57%±10.34%、51.26%±8.41%,過表達組G0/G1期細胞比例高于對照組(P<0.05)。
2.4 兩組細胞中PI3K/Akt/Bim信號通路相關蛋白表達比較 過表達組PI3K蛋白表達及p-Akt/Akt水平低于對照組,Bim蛋白表達高于對照組(P均<0.05)。見表1。

表1 兩組細胞中PI3K/Akt/Bim信號通路相關蛋白表達比較
3 討論
PTC是臨床甲狀腺癌最常見的類型,目前臨床治療PTC的主要方法是手術切除[11]。遺傳學改變是PTC發生、發展的主要驅動力之一,如RAS、B-Raf原癌基因突變被認為與PTC的臨床參數(進展、侵襲和復發)之間存在重要關聯[12]。更多參與PTC進展的新靶點需要被發現,這些靶點可作為診斷和預后的生物標志物,并為治療PTC提供依據。先前證據表明,FoxO1在包括PTC在內的許多人類正常組織和腫瘤組織中均有差異表達[5,6]。在宮頸癌中,FoxO1被證明通過誘導腫瘤細胞周期阻滯和凋亡抑制腫瘤的發生、發展[13]。然而,FoxO1在人PTC發生中的作用機制尚不清楚。
為了觀察FoxO1過表達對PTC的影響,我們在PTC細胞株KTC-1中感染了FoxO1過表達的慢病毒,結果發現FoxO1蛋白的表達量顯著提升;且FoxO1表達上調可抑制細胞增殖,促進細胞周期阻滯,誘導細胞凋亡。同時,經典霍奇金淋巴瘤相關研究發現,持續活躍的FoxO1異位表達能誘導細胞凋亡、阻止其增殖,并伴隨著顯著的G0/G1期細胞阻滯[14]。此外,FoxO1在人非小細胞肺癌中顯著低表達,FoxO1過表達增加了腫瘤細胞表面微絨毛的長度,進而抑制其遷移;FoxO1沉默則顯著縮短了微絨毛的長度,促進細胞遷移。這提示FoxO1同樣參與人肺癌的發生。在人骨肉瘤細胞中,研究者發現FoxO1通過MALAT1的負調控抑制腫瘤細胞增殖和遷移,上調FoxO1表達可作為骨肉瘤患者的一種替代治療策略[15]。同樣,人肝癌相關研究發現,FoxO1在肝癌組織中顯著低表達,FoxO1相關信號通路激活劑甲哌氟丙嗪能促進SMMC-7721、Bel-7402細胞株凋亡,抑制細胞的遷移和侵襲能力,其機制與增加細胞核中FoxO1的表達及調節Bax/Bcl-2比例有關[16]。以上研究提示,FoxO1是包括PTC在內的多種惡性腫瘤的抑癌基因,其表達調控可作為腫瘤分子治療的重要途徑。
現已證實,PI3K/Akt信號通路參與惡性腫瘤發生發展的相關調控。研究表明,FoxO1的活性受PI3K/Akt信號通路的負調節。研究者使用Akt抑制劑處理甲狀腺癌細胞24 h后,發現FoxO1蛋白的表達水平顯著升高,提示PI3K的激活下調FoxO1蛋白的表達水平。鼻咽癌相關體內體外實驗結果顯示,FoxO1通過PI3K/AKT/C-JUN信號通路誘導miR-3188的表達并抑制鼻咽癌細胞的增殖[17]。宮頸癌相關研究發現,PI3K抑制劑LY294002顯著降低了PI3K磷酸化水平,但激活了FoxO1轉錄因子,而FoxO1的激活誘導了腫瘤細胞凋亡并抑制細胞增殖[13]。本研究結果顯示,過表達組PI3K蛋白表達及p-Akt/Akt水平低于對照組,表明上調FoxO1表達對PI3K/Akt信號通路具有負調節作用,主要表現在Akt磷酸化水平的降低。細胞凋亡與腫瘤的發生、發展密切相關,這一生物學過程受到多種基因的影響。Bcl-2家族是研究最多的一類凋亡相關蛋白[18]。Bim不僅是PI3K/Akt信號通路的下游靶點,也是Bcl-2家族的成員之一。Bim轉錄水平調控十分復雜,可受到多種信號途徑的調節,其中包括PI3K/Akt信號通路。細胞實驗表明,p-Akt活性抑制劑LY294002能促進Bim蛋白表達,提示Bim蛋白表達可能通過PI3K/AKT信號通路來調控[19]。低溫致乳鼠心肌細胞損傷的相關研究表明,低溫能夠通過促進Bim表達誘導心肌細胞凋亡,而PI3K/AKT信號通路同樣可能參與了Bim的誘導表達[20]。本實驗結果顯示,過表達組Bim蛋白表達高于對照組,表明外源性的FoxO1上調同樣增加了Bim蛋白的表達水平。FoxO1過表達可能通過調控PI3K/Akt/Bim信號通路影響PTC細胞的增殖、凋亡。
綜上所述,FoxO1過表達后PTC細胞增殖能力降低、凋亡水平升高、G0/G1期阻滯細胞明顯增多,其作用機制可能涉及PI3K/Akt/Bim信號通路的活性調控。更加詳細的分子生物學機制尚有待進一步深入探討。

