熬糖工藝條件對糖膏中5-羥甲基糠醛和糠醛含量的影響
鄭奕光 ,顧正彪 ,陳平安 ,陳尚衛 ,朱 松,洪 雁,戴 軍*
(1. 廣東好心情食品集團有限公司,廣東 汕頭 515000;2. 江南大學 食品學院,江蘇 無錫 214122;3.食品科學與技術國家重點實驗室,江南大學,江蘇 無錫 214122)
熬糖是糖果生產中決定產品質量的重要環節。該環節同其他食品的熱加工過程類似,糖組分因受高溫加熱會發生脫水降解反應,導致產品中生成一定量的 5-羥甲基糠醛(5-HMF)和糠醛(FFA)[1-4]。 兩者均會使糖果產生不良風味和褐變,且5-HMF 是一種能誘導細胞和基因突變的毒素,具有潛在的致癌性[5];FFA 則具有較大的潛在遺傳及生殖毒性[6]。 關于由目前普遍使用的真空熬糖工藝生產的糖果或半成品糖膏中的5-HMF 和FFA 的含量及其與工藝條件的相關性的分析研究尚未見報道。為了嚴格控制糖果質量,盡量減少有害物質的產生,通過研究不同工藝條件下熬制的硬質糖果半成品糖膏中5-HMF和FFA 的含量變化及其規律,為進一步優化真空熬糖工藝、制定新的產品質量標準提供依據。
1 材料與方法
1.1 材料與試劑
5-羥甲基糠醛(純度 99%,色譜純):Sigma 公司產品;糠醛(純度 99%,GC 級):Aldrich 公司產品;乙腈(HPLC 級):美國 Tedia 公司產品;磷酸(純度≥85%):國藥集團化學試劑有限公司產品;實驗用水:均為超純水,用Millipore 純化系統(符合GB/T6682規定的一級水標準)產品;蔗糖:韓國TS 公司產品;淀粉糖漿(商品名:麥芽糖飴):76.5%(質量分數),上海好成食品發展有限公司產品。
1.2 主要儀器設備
低溫真空連續薄膜煮糖機:廣東好心情食品集團有限公司產品;Waters 1525 高效液相色譜儀:配2998 二極管陣列檢測器和2707 自動進樣器,美國Waters 公司產品。
1.3 5-羥甲基糠醛和糠醛測定
1.3.1 樣品制備 準確稱取碾碎的硬質糖果1.0 g左右,用水溶解定容至10 mL,用0.45 μm 的微孔濾膜過濾后進樣分析。
1.3.2 色譜條件 參考文獻方法[7],并作改進,即:色譜柱為 symmetry C18,4.6 mm×250 mm;流動相:A(乙腈-水-磷酸,體積比為5:95:0.05)與 B(乙腈-水-磷酸,體積比為 50∶50∶0.05)二元梯度洗脫,梯度洗脫程序為 0~30 min,100%A~100%B;30 min~35 min,100%B;35 ~40 min,100%B ~100%A;40 ~45 min,100%A,流量:0.8 mL/min;柱溫:30 ℃;檢測波長:208 nm;進樣體積:20 μL。
1.4 糖組成測定
參照文獻方法[8],即:色譜柱為Sugarpak1,6.5 mm×300 mm;流動相:超純水;流量:0.4 mL/min;柱溫:85℃;檢測:示差折光檢測器;進樣體積:10 μL。
1.5 熬糖試驗工藝參數
熬糖工藝流程參照本公司專利說明書[7]進行。熬糖試驗溫度分別為120、125、132、138、145、153 ℃;熬糖時間:9~33 min。
2 結果與分析
2.1 熬糖溫度及時間對5-HMF 和FFA 的影響
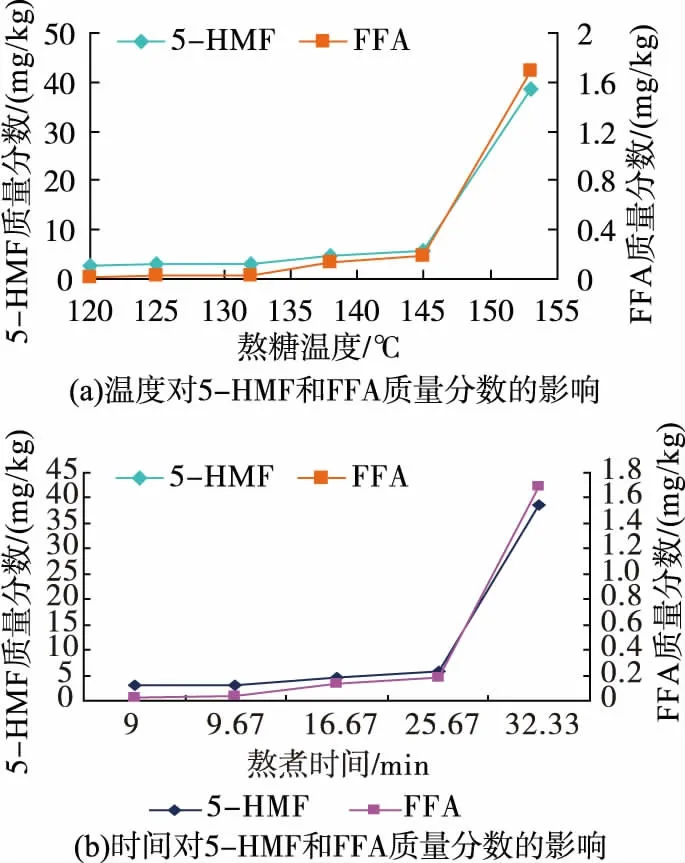
圖1 熬煮溫度及時間對糖膏中5-HMF 和FFA 質量分數的影響Fig. 1 Effect of boiling temperature and boiling time on content of 5-HMF and FFA
圖1 為使用上述蔗糖和淀粉糖漿為原料,蔗糖與淀粉糖漿及水的比例按照質量比55∶45∶15 混合化糖時,不同熬糖溫度及熬糖時間對糖膏中5-HMF和FFA 質量分數的影響,圖 2 是 5-HMF 和 FFA 混合標樣與 145 ℃熬制的糖膏樣品的HPLC 圖譜。 如圖 1(a)所示,溫度低于 132 ℃時,糖膏中 5-HMF 和FFA 的生成量較低,且差異不大。 當熬糖溫度高于132 ℃后,兩者生成量明顯增多,特別是當熬糖溫度高于 145 ℃時,5-HMF 生成量急劇地增大。 因此,從減少有害物質生成角度考慮,熬糖溫度應盡量不高于132 ℃。
根據糖膏樣品中水分質量分數測定的結果,上述溫度范圍內熬制的糖膏樣品中水分質量分數欲達到行業標準SB/T 10018-2017 的要求(小于4%),熬溫必須125 ℃以上。 在滿足該條件下的熬糖時間(即混合溶化后的糖液從輸入勻化熬煮糖漿罐內開始,經持續蒸汽加熱熬煮從糖漿輸送夾層的出口端輸出并達到125 ℃以上溫度后進入到糖漿水分去除裝置時所需的時間) 與相應糖膏中5-HMF 和FFA 的含量之間的關系曲線如圖1(b)所示。其變化與上述溫度影響趨勢一致。 為盡量降低5-HMF 和FFA 生成量,同時使熬煮的糖膏中水分質量分數達到行標規定的質量要求,熬糖時間應控制在9~10 min為宜。
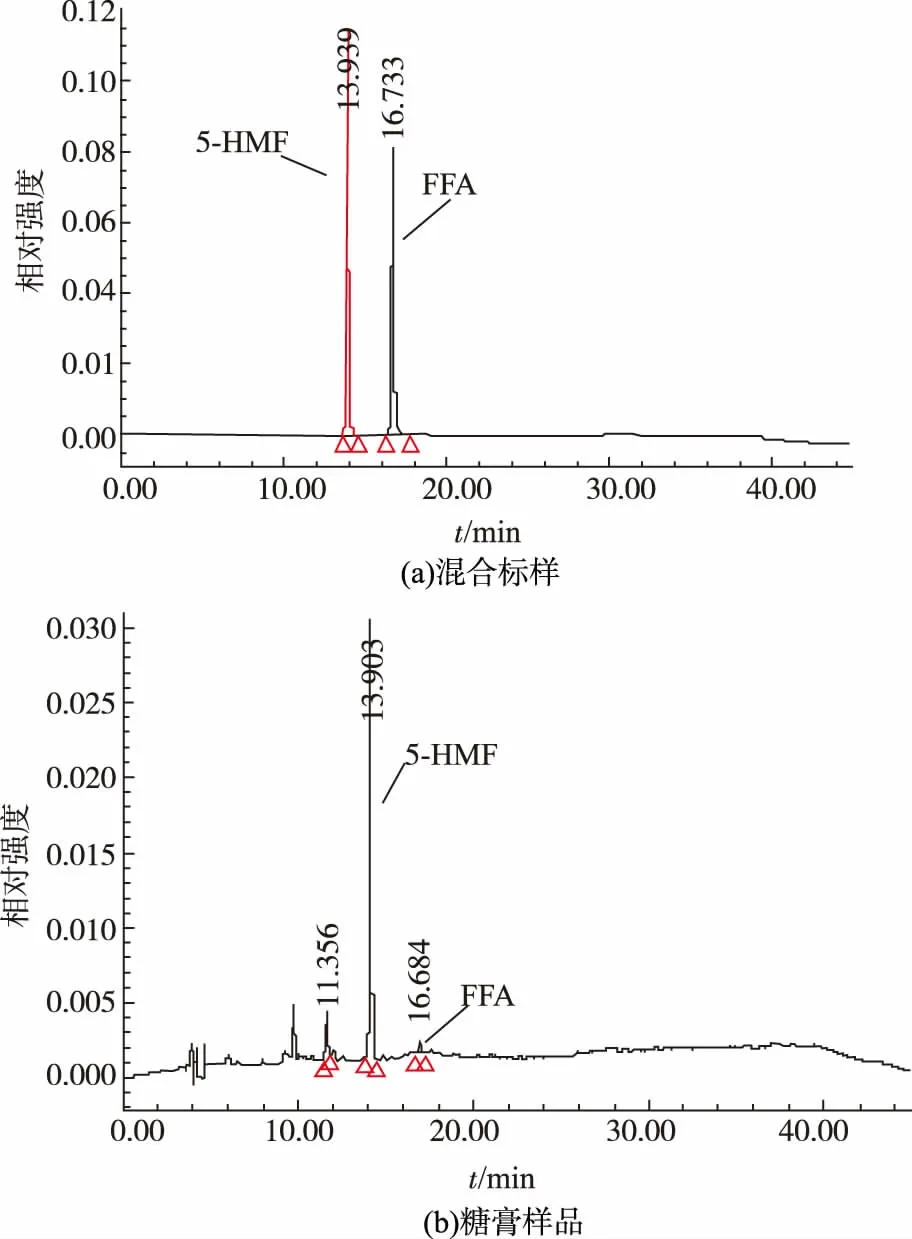
圖2 5-HMF 和FFA 混合標樣與 145 ℃熬制的糖膏樣品的HPLC 分析圖譜Fig. 2 Chromatograms of 5-HMF and FFA mixture standard and massecuite sample by boiling under 145℃
2.2 抗壞血酸和海藻糖的作用
在糖果行業,熬糖配方中常添加少量的抗壞血酸和海藻糖,目的分別是抗氧化與補充人體Vc、保鮮抗濕及改善甜味。 但表1 結果顯示,在高、低溫兩種條件下,抗壞血酸都會顯著地促進5-HMF 和FFA的生成,其原因可能是抗壞血酸褐變反應所致[9]。 故若改用其衍生物即較穩定的抗壞血酸磷酸酯鎂或抗壞血酸棕櫚酸酯,可能會避免或降低此褐變作用。 由表1 可見,海藻糖也有少許的促進5-HMF 和FFA 生成作用,其原因有待進一步研究探討。 為生產高質量糖果,防止還原糖的降解,可進一步探索研究水質控制、化糖熬糖全程真空脫氧等其他抗氧化工藝或部分使用淀粉糖醇取代淀粉糖等措施。
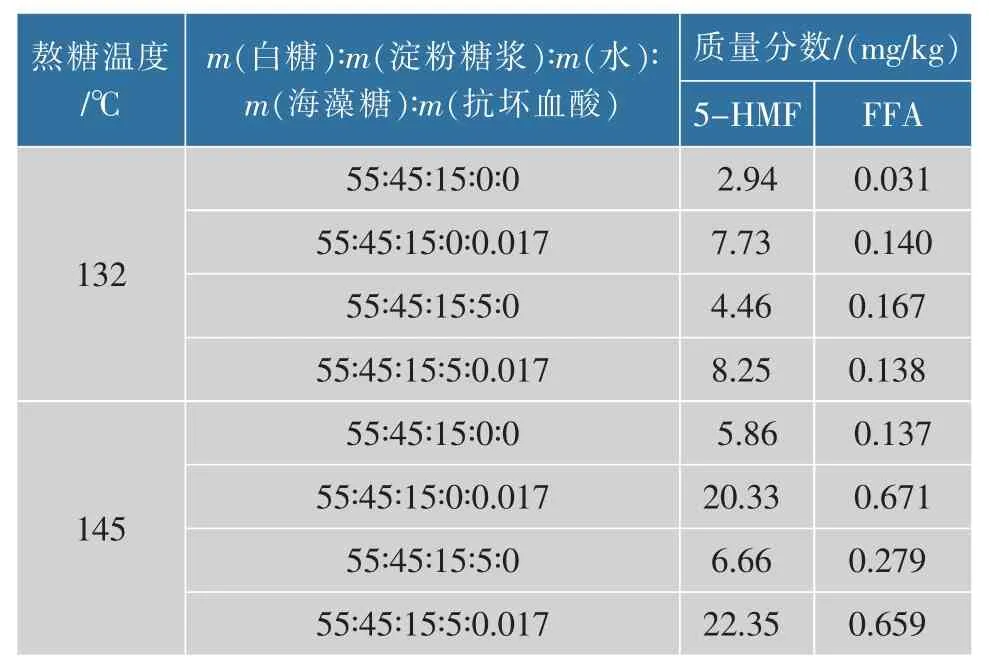
表1 抗壞血酸和海藻糖對5-HMF 和FFA 生成量的影響Table 1 Effect of ascorbic acid and trehalose on content of 5-HMF and FFA in massecuites
2.3 蔗糖和淀粉糖漿原料純度及其配比的影響
為降低成本,改善糖果風味,降低甜度,提高抗結晶性,一般均使用淀粉糖漿部分代替白砂糖,即使用白砂糖、淀粉糖漿和水按一定比例進行糖膏的熬制。 本研究所用原料白砂糖純度較高,如圖3 所示,幾乎完全是蔗糖,不含單糖。 但淀粉糖漿中除有麥芽糖(10.369 min)、麥芽三糖(9.217 min)和麥芽四糖(8.500 min)等低聚麥芽糖外,還含一定量的葡萄糖(12.555 min),HPLC 測得峰面積歸一化百分比為4.08%,這部分葡萄糖高溫加熱后易脫水降解生成5-HMF[10]。
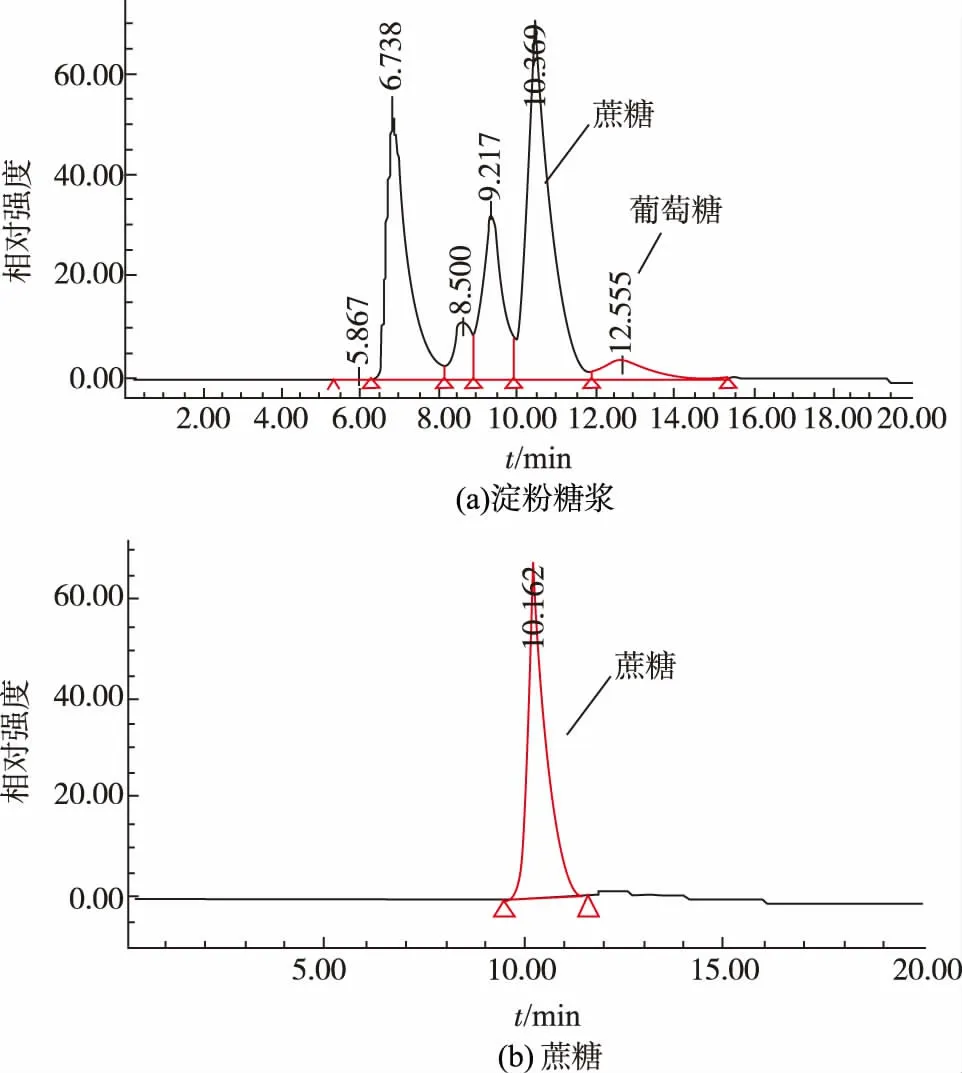
圖3 熬糖原料淀粉糖漿和蔗糖的HPLC 分析圖譜Fig. 3 Chromatograms of starch syrup and white sugar as boiling materials
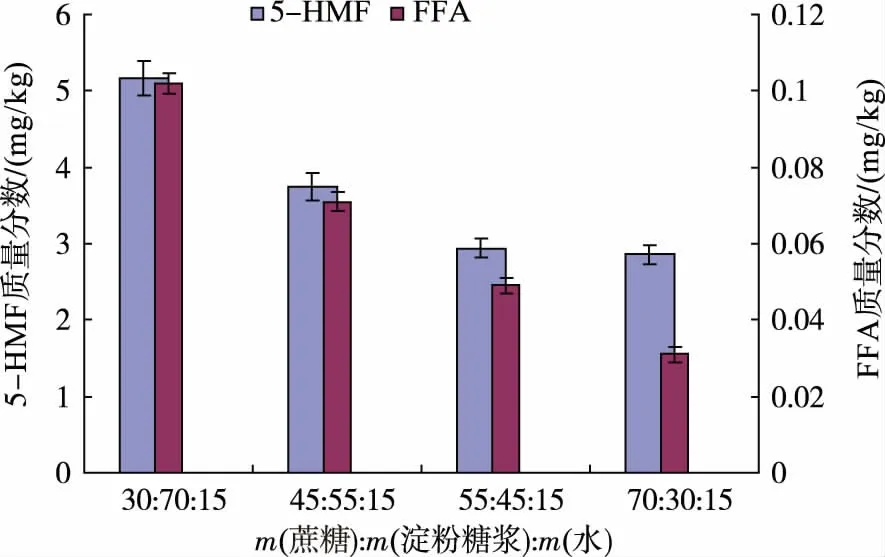
圖4 蔗糖和淀粉糖漿配比對5-HMF 和FFA 質量分數的影響(熬溫為132 ℃)Fig. 4 Effect of proportion of white sugar and starch syrup on content of 5-HMF and FFA in massecuites(boiling temperature:132 ℃)
圖4 顯示,在熬溫為132 ℃條件下,當熬糖原料中蔗糖和淀粉糖漿的質量比例由55∶45 提高到70∶30時,熬制的糖膏中5-HMF 和FFA 的生成總量稍有減少,而當蔗糖和淀粉糖漿的質量比例分別減小到45∶55 和 30∶70 時即淀粉糖含量較大量增加時,5-HMF 和FFA 的生成總量均較大幅增加。 這是由于該淀粉糖漿中含有較高質量分數的葡萄糖(4.08%),葡萄糖在高溫受熱情況下可直接脫水降解為5-HMF,而蔗糖和麥芽糖等低聚糖則需降解為單糖后方可進一步脫水降解,即單糖比蔗糖和麥芽糖等低聚糖容易產生5-HMF 和FFA[11]。因此,為使5-HMF和FFA 的總含量盡量降低,同時淀粉糖比例較高,成本相對較低,則蔗糖與淀粉糖漿的質量比例為55∶45 左右較合適。 此外,若將上述淀粉糖漿中葡萄糖含量盡量降低,即換用葡萄糖質量分數低于1%的麥芽糖漿(目前淀粉糖行業中生產的麥芽糖漿產品的葡萄糖質量分數最低可達到1%以下),則5-HMF 的生成量也將顯著減少。
此外,如圖5 所示,在熬糖過程中產生5-HMF和FFA 的同時,糖膏中糖的組成也相應發生了變化,且高、低溫熬煮后糖膏樣品中單糖組分變化有明顯差異。低溫熬煮(125 ℃)時葡萄糖和果糖(果糖由少量蔗糖水解產生; 葡萄糖主要來自于淀粉糖漿,也有少量來自蔗糖水解)均較少脫水降解,較高溫度(145 ℃)熬煮后果糖幾乎完全降解,葡萄糖大部分被降解。 這也說明單糖是糖膏中產生5-HMF和FFA 的主要來源,熬糖原料(蔗糖和淀粉糖漿)中單糖含量越低越好(FFA 主要是由淀粉糖中極微量的五碳單糖或戊聚糖熱解產生)。
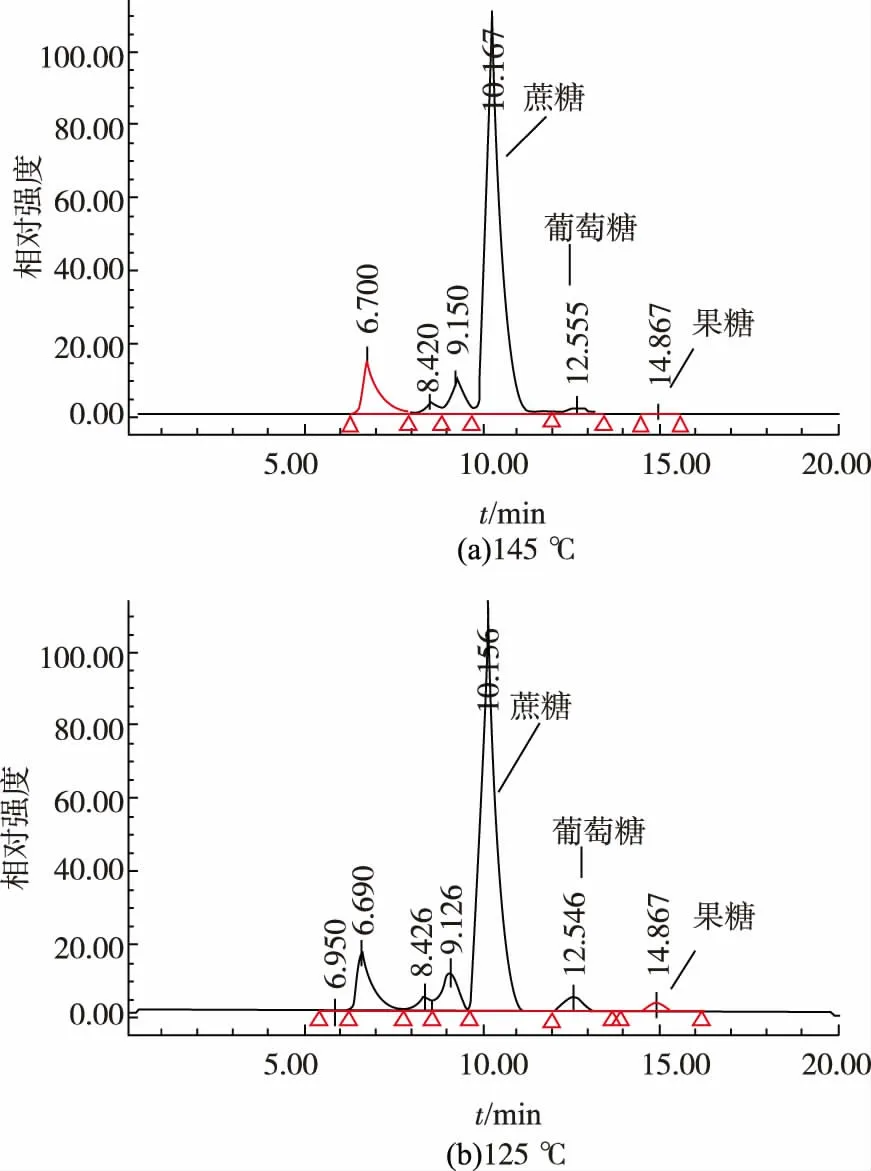
圖5 145 ℃和125 ℃熬煮的糖膏樣品的糖組成分析色譜圖Fig. 5 HPLC profiles of sugar composition of massecuite samples by boiling under 145 ℃ and 125 ℃
3 結 語
研究表明,為盡量降低有害物質5-HMF 和FFA 的產生,提高糖果產品質量,需在一定的真空加熱條件下,嚴格控制熬糖溫度和時間、原料質量及其配比。 在所用熬糖設備及所用原料條件下,合適的熬糖溫度應控制在120~132 ℃之間,熬糖時間控制在9~10 min 為宜,蔗糖與淀粉糖漿的質量比為55∶45 左右較合適。 熬糖原料應盡量選用高純度的蔗糖和低葡萄糖含量的淀粉糖漿。 抗壞血酸不宜作為熬糖抗氧化劑使用。

