補骨脂及其主要成分對人正常肝細胞L02的損傷作用研究*
王曉艷,李偉霞,張 輝,張書琦,宋少華,王 炎,唐進法
(1.河南中醫藥大學第一附屬醫院中藥臨床評價技術河南省工程實驗室,河南 鄭州 450000; 2.河南中醫藥大學藥學院,河南 鄭州 450008)
補骨脂為豆科植物補骨脂PsoraleacorylifoliaL.的干燥成熟果實[1],其性溫,味苦、辛,具有溫腎助陽、納氣平喘、溫脾止瀉的功效,為臨床常用補益類中藥,目前已開發形成220種中成藥制劑。近年來,補骨脂相關制劑致肝損傷現象屢見報道[2-3],國家藥品不良反應監測中心多次通報警示補骨脂相關制劑(壯骨關節丸和仙靈骨葆膠囊)臨床應用致肝損傷,此外,還有單味補骨脂引發肝損害的臨床病例報道[4-5],給臨床用藥帶來風險。隨著對補骨脂的深入研究,已從中分離出香豆素類、黃酮類及單萜酚類三大類主要化合物成分近百種。研究發現,各類主要成分中均具有肝細胞毒性物質[6-7],但缺乏各類成分對肝細胞毒性作用差異的比較研究。本實驗以人正常肝細胞系(L02肝細胞)為評價模型,對比研究補骨脂及其主要香豆素類成分(補骨脂素、異補骨脂素、補骨脂定)、查爾酮類成分(補骨脂甲素、補骨脂乙素)和單帖酚類成分(補骨脂酚)對人正常肝細胞系L02的毒性差異,為闡明補骨脂致肝損傷的物質基礎提供實驗依據。
1 材料與方法
1.1 細胞與細胞培養
人正常肝細胞系L02,由河南中醫藥大學科研實驗中心惠贈。常規培養在含有體積分數100 mL/L胎牛血清、100 U/ mL青霉素和100 U/ mL鏈霉素的DMEM完全培養液中,放置于37 ℃、體積分數50 mL/L的CO2的飽和濕度培養箱中進行培養,隔天換液,后續實驗均在狀態良好的細胞生長對數期進行。
1.2 藥品、試劑與儀器
生補骨脂購自亳州廣源堂中藥飲片有限公司,批號180601,經河南中醫藥大學第一附屬醫院李學林主任藥師鑒定,確認為豆科植物補骨脂的干燥成熟果實。補骨脂以體積分數為950 mL/ L乙醇回流提取,浸泡0.5 h后,加10倍量溶劑,回流提取2次(分別為2 h、1.5 h),紗布過濾收集濾液,合并2次乙醇提取液,經旋轉蒸發儀減壓濃縮后真空干燥,制得干膏,備用。補骨脂素(批號16062808)、異補骨脂素(批號16062807)、補骨脂甲素(批號16110701)、補骨脂乙素(批號17022701)、補骨脂定(批號16042601)和補骨脂酚(批號160331),均購自成都普菲德生物技術有限公司,HPLC純度均≥98%;磷酸緩沖液(PBS),購自博斯特生物技術有限公司,批號PYGOO21;四唑鹽(MTT,批號911L051)、二甲基亞砜(DMSO,批號1213C0330)和青鏈霉素混合液(批號20190320),均購自北京索萊寶科技有限公司;胎牛血清(批號NYMI1035)、胰酶(批號J170003)和DMEM(批號AL209346),均購自HyClone公司;乳酸脫氫酶(LDH)檢測試劑盒(批號20190312)、丙氨酸氨基轉移酶(ALT)檢測試劑盒(批號20190408)和天門冬氨酸氨基轉移酶(AST)檢測試劑盒(批號20190407),均購自南京建成生物工程研究所。CO2恒溫培養箱、酶標儀、-80 ℃超低溫冰箱、離心機,均為Thermo賽默飛世爾科技(中國)有限公司產品;超凈工作臺,蘇州凈化設備有限公司產品;倒置相差顯微鏡,Motic麥克奧迪實業集團有限公司產品;細胞培養瓶、細胞培養板均為美國康寧公司產品;加樣槽,BIOFIL廣州潔特生物過濾股份有限公司產品;電熱恒溫水浴鍋,上海森信實驗儀器有限公司產品。
1.3 檢測指標
1.3.1 給藥質量分數和時間確定
配制適量補骨脂母液(按生藥量換算,下同),分別稀釋至2,1,0.5,0.25,0.125,0.06,0.03,0.015 g/L備用。取對數生長期的L02,經質量分數2.5 g/L的胰酶消化,用完全培養液制成細胞懸液,取10 μL置顯微鏡下計數,調整細胞濃度為5×104個/mL,接種于96孔培養板中,每孔100 μL,每組設置6個復孔。待12 h細胞貼壁后,吸棄96孔板中舊的培養液,對照組用含體積分數1 mL/L DMSO的培養液,給藥組用含補骨脂提取物質量分數為2,1,0.5,0.25,0.125,0.06,0.03,0.015 g/L的培養基分別培養24,48,72 h。每孔加入20 μL的MTT溶液(5 g/L),37 ℃孵育箱孵育4 h,細胞內形成藍紫色結晶,吸棄孔內含MTT的培養液,每孔分別加入100 μL的DMSO,輕微震搖5 min,使結晶完全溶解,采用酶標儀檢測吸光度(波長為570 nm),并計算細胞抑制率。
1.3.2 細胞抑制率
取補骨脂素、異補骨脂素、補骨脂甲素、補骨脂乙素、補骨脂酚和補骨脂定樣品適量,每種成分以DMSO分別配制成6.25,12.5,25,50,100,150和200 mg/L藥液,對照組為含體積分數1 mL/L的DMSO。調整細胞密度,接種在96孔培養板中,放置于37 ℃、體積分數為50 mL/L 的CO2培養箱中培養12 h;吸棄各孔中培養液,分別加入各質量分數樣品培養液200 μL,每個質量分數設置6個復孔,放置于37 ℃、體積分數為50 mL/L的CO2培養箱中分別孵育24,48,72 h;各孔均加入預先配制好的MTT溶液20 μL,繼續培養4 h;吸棄含MTT的培養液,每孔加入100 μL的DMSO,輕微震搖5 min,使結晶完全溶解;于酶標儀570 nm波長處讀取吸光度(A),計算細胞抑制率,并計算IC50值。
1.3.3 AST、ALT活性及LDH釋放率
取補骨脂素、異補骨脂素、補骨脂甲素、補骨脂乙素、補骨脂酚和補骨脂定樣品適量,每種單體均以DMSO分別配制成25,50和100 mg/L藥液,對照組用體積分數為1 mL/L的DMSO。以每孔5 000個細胞的密度接種于96孔培養板中,放置于37 ℃、體積分數為50 mL/L的CO2培養箱中培養24 h,收集細胞上清液,采用生化試劑盒檢測AST、ALT活性及LDH釋放率。
1.4 統計學方法
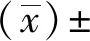
2 結 果
2.1 不同質量分數的補骨脂對L02肝細胞的抑制作用
補骨脂醇提物藥液作用于L02肝細胞24 h,補骨脂質量分數從15 mg/L以2倍速增至60 mg/L的過程中,其對L02肝細胞增殖的抑制作用并不明顯(P>0.05),均低于10%;而補骨脂質量分數增至125 mg/L時,抑制作用顯著增加(P<0.05),當質量分數增加至2 g/L時,細胞抑制率高達60%左右。對比相同質量分數補骨脂作用不同時間,發現24和48 h之間差異無統計學意義(P>0.05),而與72 h相比,個別質量分數對L02肝細胞的抑制率變化明顯(P<0.05)。見圖1。因此本研究選擇24,48和72 h為給藥時間,進一步考察補骨脂及其主要成分對L02肝細胞的毒性。

圖1 不同作用時間及不同質量分數補骨脂對L02肝細胞的抑制作用
2.2 補骨脂主要成分對L02肝細胞的抑制作用
分別給藥培養24,48和72 h后檢測,發現補骨脂素、異補骨脂素、補骨脂甲素、補骨脂乙素、補骨脂酚及補骨脂定對L02肝細胞抑制率均較高(P<0.05)。24 h的IC50值排序為補骨脂定<補骨脂甲素<補骨脂酚<補骨脂乙素<補骨脂素<異補骨脂素。補骨脂定25 mg/L給藥時對肝細胞的抑制率已達到49%,50 mg/L時抑制率高達77%,但持續增加質量分數至200 mg/L其對肝細胞的抑制率保持不變;而補骨脂甲素50 mg/L時抑制率為67.29%,100 mg/L時抑制率高達81.95%,但持續增加質量分數至200 mg/L其對肝細胞的抑制率保持不變。結果顯示:質量分數50 mg/L以下時,相同給藥質量分數條件下比較,補骨脂定對L02肝細胞抑制率較其他成分大;50 mg/ L以上時,補骨脂甲素對L02肝細胞抑制率較其他成分大。結果見圖2。

圖2 補骨脂主要成分補骨脂素(A)、異補骨脂素(B)、補骨脂甲素(C)、補骨脂乙素(D)、補骨脂酚(E)及補骨脂定(F)對L02肝細胞的抑制作用
2.3 補骨脂及其主要成分對AST、ALT活性及LDH釋放率的影響
因24,48,72 h補骨脂主要成分對L02肝細胞增殖抑制率差異不大,故選擇給藥培養24 h對補骨脂素、異補骨脂素、補骨脂甲素、補骨脂乙素、補骨脂酚及補骨脂定對L02肝細胞的毒性進行評價。當以質量分數50 mg/ L給藥時,補骨脂定對LDH的影響(升高15%)大于其他5個成分,而對ALT和AST的變化影響則小于異補骨脂素、補骨脂酚及補骨脂乙素;給藥100 mg/ L時,補骨脂定對LDH的影響大于補骨脂甲素,但小于補骨脂乙素(升高42%),而對ALT和AST無明顯影響。見圖3。
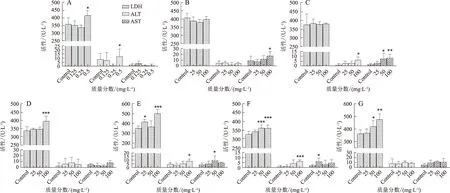
注:與對照組相比*P<0.05,**P<0.01,***P<0.001
3 討 論
補骨脂作為傳統補益類中藥,臨床運用廣泛,歷代醫家用于治療腎虛、冷瀉、遺精滑精、小便頻數、腰膝冷痛等,外用治療皮膚病、白癜風等。現代藥理學研究表明,補骨脂具有擴張冠狀動脈、抗氧化、抗腫瘤、抗菌、抗炎、抗抑郁、促進骨生長、神經保護、雌激素樣等多種作用[8-9]。據統計,含補骨脂的常用中成藥多達30余種。近年來補骨脂及其制劑的肝毒性引起了國內外學者的廣泛關注[10]。在動物實驗中,大劑量補骨脂水提物[11]、鹽補骨脂生粉、補骨脂生粉[12]、補骨脂醇提物[13]均表現出肝毒性,但補骨脂誘發肝損傷的毒性物質基礎及確切機制尚不明了。
L02肝細胞對外源化合物具有較強的代謝能力,且該細胞株成熟、穩定,易于培養,被廣泛用于藥物的細胞毒性篩選[14]。MTT法是一種檢測細胞存活和生長常用的簡便且準確方法,其檢測原理為活細胞線粒體中的琥珀酸脫氫酶能使外源性MTT還原水不溶性的藍紫色結晶物甲臜,并沉積在細胞中,而死細胞無此功能。異丙醇、二甲亞礬、SDS等有機溶劑能溶解細胞中的甲臜,在570 nm處有較強吸收[15],可間接反映活細胞數量。
本實驗采用能夠最接近模擬藥物誘發人正常肝細胞毒性作用的L02作為研究對象,根據補骨脂產生肝損傷作用的藥理特征,通過檢測補骨脂及其不同類成分對L02細胞增殖的影響,以細胞抑制率作為檢測指標,通過對細胞密度、藥物質量分數、藥物作用時間等一系列影響因素的篩選,建立了補骨脂肝毒性的細胞檢測方法。此方法操作簡單快捷,靈敏度較高,可作為評價補骨脂體外肝毒性的有效方法。通過對補骨脂及其主要成分的肝損傷評價,可初步認為異補骨脂素、補骨脂素、補骨脂甲素、補骨脂乙素、補骨脂酚和補骨脂定可能是補骨脂致肝細胞損傷的潛在成分。同等質量分數條件比較,補骨脂定和補骨脂甲素對肝細胞抑制率高于補骨脂素、異補骨脂素、補骨脂乙素、補骨脂酚。對生化指標的影響顯示:25 mg/L時,補骨脂定對LDH的影響大于其他5個成分;100 mg/ L時,補骨脂定對LDH的影響大于補骨脂甲素,但小于補骨脂乙素,但對ALT和AST無明顯影響。抑制率與生化指標檢測結果基本一致。
綜上所述,異補骨脂素、補骨脂素、補骨脂甲素、補骨脂乙素、補骨脂酚和補骨脂定是補骨脂導致肝細胞損傷的潛在成分,且補骨脂甲素和補骨脂定毒性強于其他4個成分。本研究還存在一些局限性,采用肝臟實質細胞進行體外實驗并不能完全模擬機體對藥物的吸收、分布、代謝及排泄等各過程,并且肝臟組織中還存在其他類似肝竇內皮細胞和枯否細胞等非實質細胞;因此,后續實驗將基于以上結果,一方面研究補骨脂及其主要成分對非實質細胞的影響及作用機制,另一方面對其進行體內實驗的研究,為深入研究補骨脂致肝損傷的物質基礎及作用機制提供實驗依據。

