TACE聯合微波消融對原發性肝癌患者腫瘤組織灌注、免疫功能及預后的影響
余守江 王國興 馬蘭芳
目前臨床上針對原發性肝癌仍以手術切除為主,但因肝癌發病較為隱匿,只有部分患者具備手術指征,且術后復發率較高[1]。肝動脈化療栓塞術(TACE)已被廣泛應用于原發性肝癌治療,但相關研究發現單行TACE治療原發性肝癌存在較高復發率,同時重復多次操作易造成肝功能損傷[2]。另一方面,MWA可以熱效應局部根除腫瘤,且文獻報道MWA與TACE聯合應用可發揮互補作用,進而提高療效[3]。故本文擬分析TACE聯合MWA治療對原發性肝癌患者腫瘤組織灌注、免疫功能及預后的影響,旨在為該疾病臨床治療方案優化提供臨床參考。
資料與方法
一、臨床資料
選擇2016年1月至2018年2月我科收治的原發性肝癌患者86例,根據治療的不同,分為兩組(各43例),其中對照組采用MWA治療,研究組聯合TACE和MWA治療,研究組男26例、女17例,平均年齡為(54.8+9.2)歲,腫瘤直徑:≥5 cm者35例、<5 cm者8例,肝Child分級:A級24例、B級19例,AFP水平:≥400 μg/L者29例、<400 μg/L者14例。對照組男25例、女18例,平均年齡為(56.3+8.6)歲,腫瘤直徑:≥5 cm者33例、<5 cm者10例,肝Child分級:A級26例、B級17例,AFP水平:≥400 μg/L者28例、<400 μg/L者15例。上述兩組患者基本資料比較差異無統計學意義(P>0.05),具有可比性。
二、納入標準
患者術前均經相關檢查確診;均為初發;Child-Pugh分級為A或B級;無免疫、內分泌或其他重要臟器嚴重疾病;均無近期手術史且無門靜脈高壓癥。
三、治療方法
全部患者均行仰臥,對照組行穿刺插管股動脈(改良Seldinger法),置入動脈鞘(5F),隨后置入RH導管(5F),數字減影血管造影(DSA)透視下對腹腔動脈干及腸系膜上動脈進行造影,在病灶供血動脈中置入2.7F超選微導管,同時查看患者肝功能及腫瘤狀況,而后用碘化油和表柔比星(1∶1)混懸液,栓塞腫瘤血管,確認腫瘤血供已被阻斷,隨后拔出包括股動脈鞘管等各導管,并壓迫穿刺點10 min,然后加壓包扎并送回病房。
研究組在對照組基礎上,2周內完成MWA治療,術前禁食水,取仰臥位,消融靶灶定位,通過腫瘤位置等確定穿刺點及穿刺路徑,這時調整消融針功率至40~70W,并按患者腫瘤大小調整消融時間,盡量完全消融腫瘤,結束前20 s,邊退針邊做針道消融,結束后給予止血、抗感染等對癥處理。
四、評估指標
(1)根據療效判定依據RECIST1.1療效評價標準5對兩組患者治療后的臨床療效進行比較[4];(2)比較兩組患者治療前后腫瘤組織灌注的差異情況(運用64排螺旋CT機(美國GE公司),經肘靜脈注入非離子型碘造影劑);(3)對兩組患者治療后的并發癥發生率進行比較;(4)治療前后兩組患者的體液免疫指標水平(IgA、IgM、IgG)的差異情況比較;(5)治療前后兩組患者中性粒細胞數與淋巴細胞比率(NLR)的差異情況比較;(6)全部患者空腹采靜脈血3 mL,低溫離心取血清后,利用酶聯免疫吸附法使用相對應試劑盒測定血清相關體液免疫指標水平。
五、統計學方法
數據先導入SPSS 20.0中,住院病例的一般特征采用統計指標(例數、比率、平均數、標準差、中位數、變異系數等)進行描述,采用t檢驗比較差異,等級資料在經過半定量化處理后以及基于率和構成比的比較均采用χ2檢驗。以P<0.05為差異有統計學意義。
結 果
一、兩組臨床療效比較
研究組患者的ORR為88.4%,顯著高于對照組的65.1%(P<0.05),見表1。
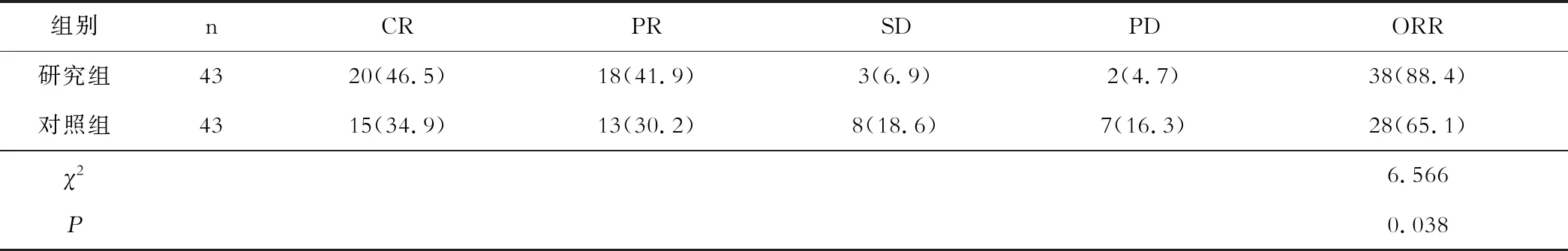
表1 兩組臨床療效比較
二、 兩組治療前后腫瘤組織灌注情況比較
治療后,兩組血容量(BV)、血流量(BF)和對比劑平均通過時間(MTT)均明顯變化(P<0.05),而研究組腫瘤組織灌注較對照組改善明顯(P<0.05),見表2。

表2 兩組治療前后腫瘤組織灌注情況比較
注:與同組治療前比較,*P<0.05;與同時間段研究組比較,#P<0.05
三、 兩組并發癥比較
研究組和對照組并發癥總發生率分別為20.9%和25.6%,無明顯差異(P>0.05),見表3。
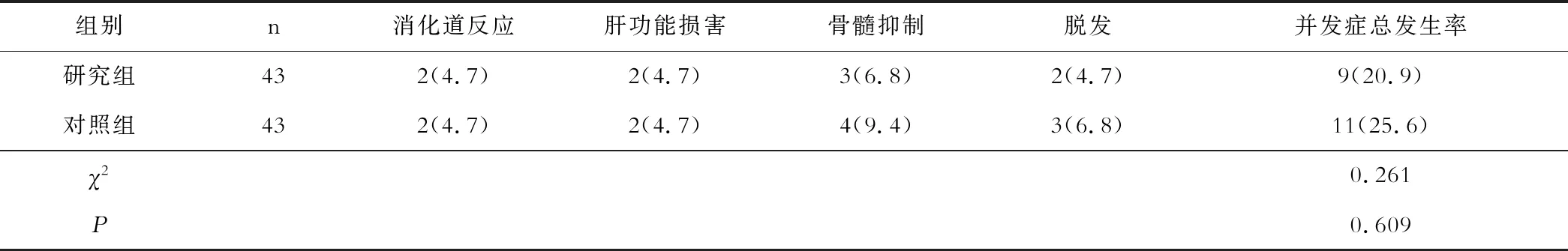
表3 兩組患者治療后并發癥發生率的差異情況比較
四、 兩組患者治療前后相關體液免疫指標和NLR水平比較
兩組患者治療后IgA、IgM、IgG和NLR水平較同組治療前均存在明顯差異(P<0.05),其中研究組上述指標水平更趨于正常參考值且其變化較對照組更明顯(P<0.05)。
討 論
原發性肝癌因其早期癥狀多不顯著,因此確診時多為晚期,同時還具有高復發性和死亡率[5]。本研究為了減少臨床常用TACE等方法造成的術后短期內擴散和轉移,擬加用MWA以局部根除腫瘤[6,7]。本研究結果顯示,治療后兩組患者總并發癥發生率比較無差異,表明TACE聯合MWA治療的不增加術后并發癥發生幾率。治療后,雖兩組腫瘤組織灌注情況均有所改善,但研究組改善更為明顯,說明TACE聯合MWA治療能更有效降低腫瘤組織血流灌注,以達到更好的治療效果。另外,我們還觀察到治療后研究組患者IgA、IgM和IgG水平較對照組改善明顯,我們推測可能是因為腫瘤細胞在微波消融后可釋放抗原并激發免疫應答,從而增強免疫反應;也可能是因為微波消融可解除免疫系統受抑制因子控制的抑制作用,進而使機體免疫應答趨于正常[8-9]。相關研究表明,NLR是原發性肝癌轉移和復發早期預測的潛在標志物,且當其值升高時,患者預后越差[10]。治療前后水平檢測結果顯示,研究組患者的NLR水平變化較對照組更為明顯,表明聯合治療后,患者中性粒細胞數與淋巴細胞更趨于正常參考值,預后也有一定程度的改善。
綜上所述,TACE和MWA聯合治療原發性肝癌療效顯著,這種治療方案不僅可降低腫瘤組織灌注,同時還可以解除免疫功能的抑制作用并改善預后,并且不增加并發癥幾率,安全有效值得臨床治療選擇。

