枸杞多糖的提取方式、結構及生物活性研究進展
葉興乾,周聲怡,姚舒婷,吳文艷,陳士國
(浙江大學 生物系統工程與食品科學學院, 馥莉食品研究院浙江省農產品加工技術研究重點實驗室, 浙江 杭州, 310058)
枸杞(LyciumbarbarumL.)屬茄科落葉灌木,花紫、果紅,全球共有70種枸杞屬植物,產于中國西北部、南北美、南非以及歐洲東南部地區[1],我國是主要產地。枸杞在中國有2 300年的歷史,其果實是我國傳統的名貴滋補中藥材,《本草綱目》記載其具有滋陰補氣、養肝明目、調節免疫力等藥理作用[2]。如今,枸杞作為食品補充劑也已廣泛應用于西方國家。
枸杞果實的生物活性成分復雜,主要包括枸杞多糖(Lyciumbarbarumpolysaccharides,LBP)、玉米黃質、β-胡蘿卜素、甜菜堿、類黃酮、腦苷和部分微量元素[3]。LBP是從枸杞果實中提取得到的一種水溶性多糖,因其具有許多生物學功效,被認為是枸杞果實中最主要的活性成分之一。研究表明,枸杞多糖除了能改善氧化及炎癥導致的糖尿病并發癥外,還能影響血糖水平的穩態、體重以及脂質代謝[4]。枸杞多糖由高度支化和僅部分表征的多糖和糖蛋白的復雜混合物組成。
提取枸杞多糖所用的方法較局限,現所用的方法主要有熱水提取、冷水提取、酶提取、堿醇提取以及基于水提取的新型輔助提取方法,如微波輔助以及超聲輔助提取。不同的提取方法將會釋放植物細胞壁中不同的部分并導致多糖化學結構的差異[5],而多糖的生物活性與其化學結構緊密相關。迄今為止,共有數10種枸杞多糖被文獻報道。本文基于此背景,總結了枸杞多糖的提取純化方法及其對應的化學特性,并對枸杞多糖主要的生物活性進行綜述。如何控制提取條件以獲得目標枸杞多糖是今后的研究重點。
1 枸杞多糖的提取和純化
多糖的化學結構與提取方法密切相關,因此,如何從枸杞果實中定向提取枸杞多糖是研究其化學結構的關鍵。目前,研究中多采用水提取、酶提取及基于水提取的新型輔助技術等進行枸杞多糖的制備(表1)。
在提取枸杞多糖之前,通常將枸杞曬干后磨成粉末,加入V(氯仿)∶V(甲醇)=2∶1以回流脫脂,并用80%(體積分數)乙醇浸泡攪拌,以除去低聚糖和色素等小分子雜質[6]。也有研究將磨成粉的枸杞和石油醚在80 ℃下混合回流[7],將脂類、低聚糖和小分子色素一并除去。過濾并烘干后,得到的枸杞殘渣用于提取水溶性枸杞多糖。由于枸杞果實的采后期會影響其內源酶代謝,進而影響枸杞多糖的化學結構,故未有研究從新鮮采摘的枸杞果實中直接進行提取。
水提醇沉是提取水溶性枸杞多糖的傳統方法,被大多數研究采用。水提取過程中,料液比控制在1∶10~1 ∶35,提取時間為2~7 h,提取溫度為70~90 ℃。ZHU[8]將枸杞干果在索氏提取器中用氯仿-甲醇溶液在80 ℃下脫脂2次,并用80%乙醇處理,以除去一些有色小分子物質,預處理后的枸杞渣置于80℃的熱水中提取枸杞多糖,重復3次,得到1種分子質量為1.92 × 106Da的酸性多糖LBP-s-1,由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸以1.00 ∶8.34 ∶1.25 ∶1.26 ∶1.91 ∶7.05 ∶15.28的摩爾比組成。HUANG等[9]將枸杞果實置于100 ℃的蒸餾水中提取30 min,將提取液過截留分子質量為3 500 Da的濾膜以除去小分子物質,將提取液濃縮并凍干后,得到枸杞多糖XLBP。通過陰離子交換色譜法及凝膠色譜法分離粗多糖,收集得到1種分子質量為4.196×105Da的果膠類多糖XLBP-I-I,由阿拉伯糖,鼠李糖,半乳糖和半乳糖醛酸以26.5 ∶12.9 ∶16.8 ∶40.8的摩爾比組成。
除了傳統的熱水提取外,近年來許多研究都采用基于熱水提取的新型輔助提取技術,如超聲輔助提取、微波輔助提取。與傳統水提取法相比,超聲及微波輔助提取具有提取率高、耗時短等優點。MUATASIM等[10]證實雙頻超聲提取枸杞多糖的提取率比傳統水提取提高了73.41%。YANG等[11]比較了熱水(100 ℃),超聲水(30~40 ℃ ),亞臨界水(110 ℃)以及超聲增強亞臨界水(110 ℃)對枸杞多糖提取率的影響,研究發現超聲增強亞臨界水的提取率最高14%(質量比),熱水提取率最低7.6%(質量比)。
酶提取具有反應迅速、條件溫和等優點。ZHOU等[12]采用纖維素酶,木瓜蛋白酶和淀粉酶在55 ℃下提取枸杞粗多糖LBP1,通過陰離子交換色譜法及凝膠色譜法分離粗多糖,分別收集0.1 mol/L NaCl及0.2 mol/L NaCl洗脫的級分,得到一種分子量為80 kDa的酸性多糖LBP1B-S-2,由阿拉伯糖、鼠李糖、半乳糖和半乳糖醛酸組成,摩爾比為53.55 ∶3.13 ∶39.37 ∶3.95。ZHANG等[13]通過正交試驗和響應面試驗設計發現,采用2.0%(質量分數)纖維素酶和1.0%木瓜蛋白酶在97 ℃,pH 5.0的條件下提取91 min,能夠得到枸杞多糖的相對最大得率(6.81±0.10)%。
在BUCHELI[14]的研究中提到,冷水提取枸杞多糖的得率可達到2%~3%。在枸杞多糖粗提物中加入Yariv試劑,得到的沉淀被鑒定為阿拉伯半乳糖蛋白;其余可溶性多糖主要由果膠組成;而不溶于冷水的多糖組分約占枸杞干果的20%,由纖維素和半纖維素組成;這些多糖共同組成了枸杞的細胞壁。
提取完成后,通常在提取液中加入3~4倍體積的95%乙醇以沉淀多糖,在4 ℃下靜置過夜。隨后收集沉淀,用無水乙醇和丙酮輪流洗滌,風干后冷凍干燥并儲存,以用于進一步分析。
枸杞粗多糖由不同的組分組成,可以采用離子交換色譜、凝膠滲透色譜、反相高效液相色譜及分級沉淀進行分離純化[1]。
然而,目前大多數關于LBP提取的研究都集中在提高提取率上,未曾有研究系統地比較LBP的提取方法與理化性質之間的關系。基于不同的提取條件,已經發現了具有多種復雜結構的LBP,但是關于LBP的所有研究都難以聯系到一起,之后應著重探究多糖的提取方法與化學結構之間的關系。

表1 枸杞多糖的前處理、提取及純化方法
2 枸杞多糖的結構鑒定
枸杞多糖因具有良好的生物活性,其組分的化學結構自20世紀以來一直廣為研究。根據現有文獻可知,枸杞粗多糖是一種由高度支化和僅部分表征的多糖及蛋白多糖共同組成的復雜混合物。這些糖綴合物的分子質量高達10~2 250 kDa。糖苷部分由阿拉伯糖、葡萄糖、半乳糖、甘露糖、鼠李糖、木糖組成。同時,枸杞多糖還含有半乳糖醛酸,葡糖醛酸和氨基酸[20]。Yariv試劑可沉淀出枸杞多糖溶液中的阿拉伯半乳糖蛋白,其與枸杞多糖的化學結構與生物活性功能之間的關系為枸杞多糖的研究重點之一。
多糖由于其單糖組成、鏈構形、環構象和分子量等方面的多樣性,使其分析具有一定的挑戰性。聚糖的化學特性可借助相關化學技術進行表征,包括氣相色譜(gas chromatography,GC)、高效液相色譜(high performance liquid chromatography,HPLC)、核磁共振(nuclear magnetic resonance,NMR)、紅外光譜(infrared spectroscopy,IR)、高效凝膠排阻層析(high performance size exclusion chromatogaraphy,HPSEC) 及氣相色譜-質譜聯用儀(gas chromatogtaphy-mass spectrometry,GC-MS)等。迄今為止,不同的文獻數據在枸杞多糖綴合物的單糖、氨基酸殘基的組成以及聚糖的主鏈、分支位點的分析方面呈現出不同的結果(表2)。
LIU[21]用80 ℃的熱水從枸杞中提取出酸性多糖p-LBP,脫色后,過離子交換色譜和凝膠色譜進行純化。根據配有脈沖電流檢測器的高效陰離子交換色譜(high performance anion exchange chromatography-pulsed amperometric detertor,HPAEC-PAD)、HPSEC、FT-IR、GC-MS和NMR的一級結構分析得知,p-LBP的平均分子質量為64 kDa,是一種果膠類均相雜多糖。
ZOU等[22]和ZHU等[8]采用相同的溫度從寧夏產的枸杞中分別提取得到LBP-1和LBP-S-1。然而,ZOU[22]提取的雜多糖LBP-1主要由阿拉伯糖,甘露糖和半乳糖醛酸組成,平均分子質量為2 250 kDa。而根據ZHU等[8]的研究,半乳糖醛酸(42%)在LBP-S-1中占比最大。LBP-s-1的平均分子質量為1 920 kDa。
ZHOU等[12]通過纖維素酶、木瓜蛋白酶和淀粉酶在55 ℃下提取出了平均分子質量為80 kDa的枸杞多糖,命名為LBP1B-S-2。LBP1B-S-2由鼠李糖、阿拉伯糖、半乳糖和葡糖醛酸以3.13 ∶53.55 ∶39.37 ∶3.95的摩爾比組成,為一種酸性阿拉伯半乳聚糖。
BUCHELI等[14]從枸杞中提取出的可溶性大分子為一種糖綴合物,被鑒定為阿拉伯半乳聚糖蛋白,但其在大多數文獻中被統稱為“枸杞多糖”。目前,已有部分枸杞糖綴合物的化學結構被表征。HUANG等[23]通過提取得3種糖綴合物:LbGp3、LbGp4和LbGp5。糖綴合物LbGp3的平均分子質量為925 kDa,糖苷部分由阿拉伯糖和半乳糖組成。LbGp4的平均分子質量為215 kDa,糖苷部分由阿拉伯糖,半乳糖,鼠李糖和葡萄糖以1.5 ∶2.5 ∶0.43 ∶0.23的摩爾比組成。LbGp5的平均分子質量為24 kDa,糖苷部分由鼠李糖、阿拉伯糖、木糖、半乳糖、甘露糖和葡萄糖以0.33 ∶0.52 ∶0.42 ∶0.94 ∶0.85 ∶1.0的摩爾比組成。接著LIN等[24]對LbGp3進行了結構分析。阿拉伯糖和半乳糖的摩爾比為1 ∶1,半乳糖殘基構成其主鏈。PENG等[25]以類似的方式對LbGp4進行了結構分析,發現聚糖部分(LbGp4-OL)通過β-消除反應釋放,由阿拉伯糖,半乳糖,鼠李糖以1.33 ∶1.0 ∶0.05的摩爾比組成。LbGp3和LbGp4-OL均為阿拉伯半乳聚糖。WANG等[26]與HUANG等[9]采用相同的提取條件,WANG從枸杞中提取得到LbGp1,平均分子質量為49.1 kDa,蛋白含量為3.75%(質量分數)。用氣相色譜法分析得知糖苷部分由阿拉伯糖和半乳糖組成,摩爾比為5.6 ∶1。部分水解后通過甲基化和電噴霧質譜分析得知LbGp1的主鏈是由半乳聚糖構成。
目前大多研究均采用寧夏枸杞為原料對枸杞多糖進行結構及生物活性研究。在最近HUANG等[9]的研究中,以新疆枸杞為原料,用沸水提取枸杞多糖XLBP,并經離子交換色譜和凝膠層析柱,分離純化出XLBP-I-I組分。甲基化、紅外光譜及核磁分析結果表明,XLBP-I-I主鏈為重復的1, 4-GalA結構,這提示XLBP-I-I為一種果膠類多糖,且分子質量為419.6 kDa,高于約40種從寧夏枸杞(L.barbarum)、中華枸杞(L.chinense)和黑果枸杞(L.ruthenicum)分離得到的多糖分子質量。然而,同作為果膠類多糖,XLBP-I-I的分子質量小于從寧夏枸杞中提取得到的LBP-S-1 (1 920 kDa)[8]和 LBP-1 (2 250 kDa)[22]。李越鯤等[27]以枸杞的“寧杞1號”品種為材料, 對新疆、青海、寧夏、甘肅、內蒙等共10個產區3批次“寧杞1號”的主要化學成分進行了測定分析。結果表明,寧夏產區“寧杞1號”的總糖和還原糖含量最低,但枸杞多糖(3.61%)含量居首位。李重[28]選定寧夏枸杞的3個栽培品種“寧杞4號”、“寧杞7號”、“中科綠川1號”為研究對象,評價包括總多糖含量在內的活性成分指標,結果表明3個枸杞栽培品種均表現出夏果品質優于秋果,且寧夏中寧枸杞產區的枸杞總多糖大于內蒙沙海及青海都蘭產區。綜上可知,不同產地及品種的枸杞因具有不同的化學成分或采用了不同的預處理方式,導致即使采用相同的提取溫度,枸杞多糖也會表征出不同的結構特征[9]。
3 枸杞多糖的生物活性
枸杞多糖具有多種重要的生物活性,例如抗氧化,保護神經,免疫調節,抗腫瘤,輻射防護,抗糖尿病,護肝,抗骨質疏松[33]等。
根據被研究的廣泛性,將討論4種主要的生物活性。
3.1 抗氧化活性
LBP的抗氧化活性已經在體外進行了廣泛的研究可能的抗氧化活性機制如圖1所示。CAO等[34]證實LBP通過上調Nrf2/HO-1信號傳導,起到對神經毒性的保護作用。YANG等[36]發現LBP通過增強抗氧化酶的效力和減弱環玲酰胺注射后氧化產物的水平降低氧化應激。但是,以上研究均未提及LBP的精細結構,因此無法進一步研究核心活性成分。
LBP的抗氧化作用也已在體內進行了研究。AMAGASE等[36]通過30 d的隨機、雙盲、對照臨床實驗,研究了枸杞多糖對50名55~72歲健康成年人的抗氧化作用。結果表明,食用LBP可使血清超氧化物歧化酶(superoxide dismutase,SOD)顯著提高8.4%,谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)提高9.9%,并顯著降低血清丙二醛(malondialdehyde,MDA)含量8.7%。這表明LBP可以通過刺激內源性因子使細胞免受氧自由基介導的損傷。BOKANG等[37]研究了LBP對高脂飲食小鼠的血脂代謝、血糖和氧化應激的影響,實驗結果顯示食用LBP可以顯著降低低密度脂蛋白、總膽固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、血糖和硫代巴比妥酸反應性物質的水平,并提高抗氧化酶的活性。這表明LBP對高脂飲食引起的脂質氧化具有明顯的抑制作用。
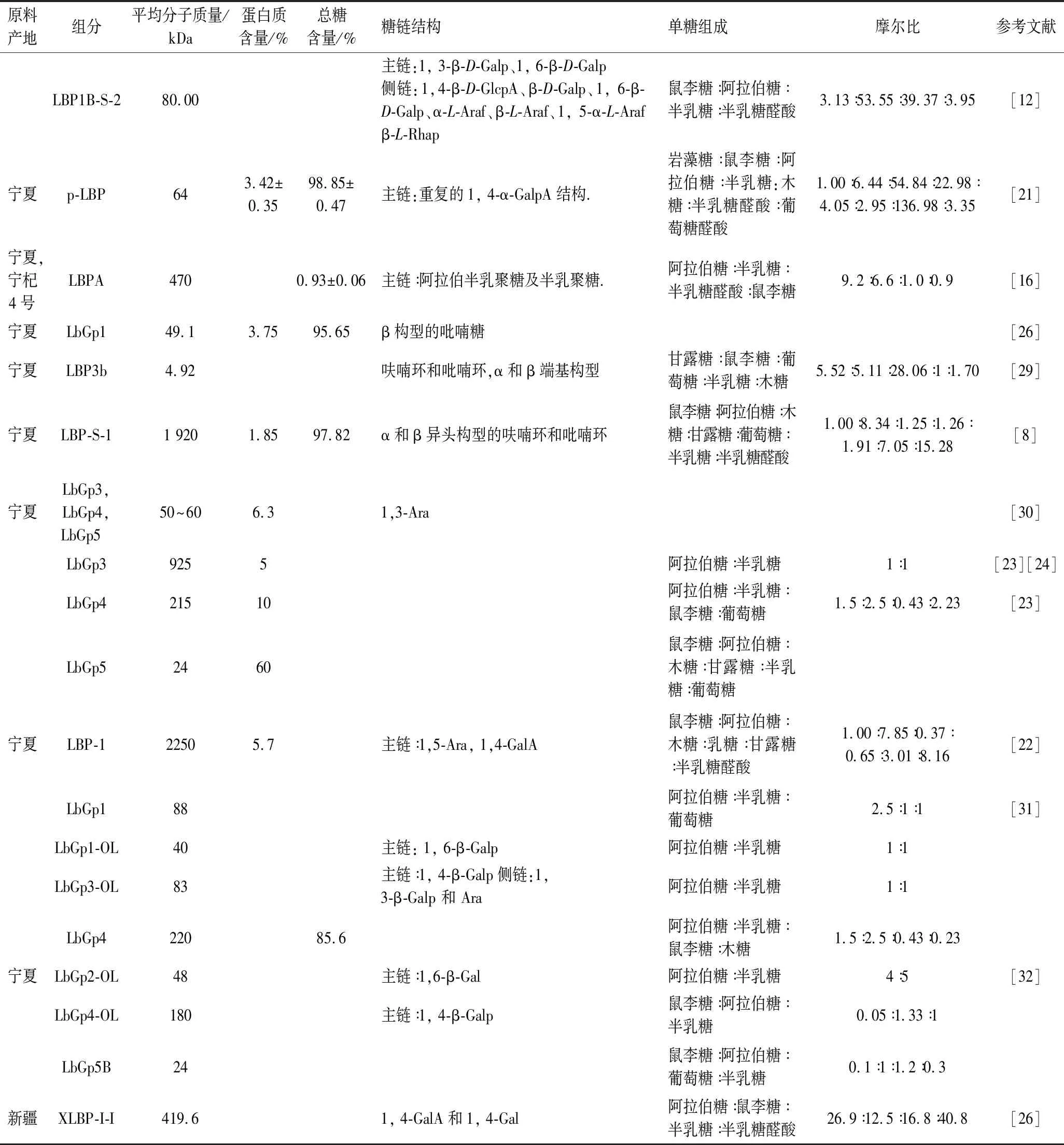
表2 枸杞多糖組分的結構研究
綜上,LBP的抗氧化活性主要歸因于抗氧化酶活性的提高。此外,有報道稱,由于O—H鍵的解離能較弱,多糖可能具有向超氧陰離子提供氫的能力[38]。
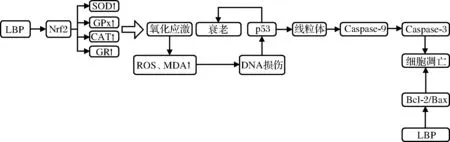
圖1 LBP可能的抗氧化活性機制
3.2 免疫調節活性
多糖能夠通過與巨噬細胞、T細胞、單核細胞和多形核淋巴細胞的相互作用來影響先天免疫和細胞介導免疫。LBP作為被研究最多的多糖之一,已被發現具有多種體內外免疫調節活性。可能的免疫調節機制如圖2所示。
LBP可通過活化巨噬細胞增強機體的先天免疫功能,其機制可能是通過影響腫瘤壞死因子α(tumour necrosis factor-α,TNF-α)和上調主要組織相容性復合體II(major histocompatibility Complex-II,MHC-II)的共刺激分子來實現的。活化細胞核因子蛋白(nuclear factor of activated T cells 1-5,NFAT 1-5)在免疫系統的發育和功能活動中起關鍵作用。CHEN等[39]的研究表明,將枸杞在4 ℃的蒸餾水中浸泡過夜得到的LBP能夠顯著促進小鼠脾細胞的增殖。細胞周期分析表明,LBP激活了T細胞表達NFAT蛋白,并干擾了介導炎癥反應的IL -2和(IFN)-γ的表達。
樹突狀細胞(dendritic cell,DC)是免疫系統中功能最強的抗原提呈細胞。JING等[40]的研究證實LBP可以增加DCs表型的表達,混合淋巴細胞反應中白細胞介素和γ干擾素的分泌,并增強NF-κB的表達。這表明LBP在病毒相關的情況下起到了更強的抗腫瘤作用,并且這種活性作用與NF-κB信號通路有關。

圖2 LBP可能的免疫調節機制
3.3 抗腫瘤活性
癌癥治療方式主要包括手術、放射療法、激素療法、化學療法和免疫療法。其中,放射療法、化學療法、免疫療法和激素療法的效果通常會有嚴重副作用,且機體易產生耐藥性。所以急需從自然資源中找到安全有效的抗癌化合物。可能的抗腫瘤活性機制如圖3所示。
KE等[41]用蒸餾水在室溫下提取3 h得到的水溶性枸杞多糖LBPF5,流式細胞儀分析結果表明,其劑量依賴性地抑制人膀胱癌細胞株BIU87的生長,并能誘導BIU87凋亡。MAO等[42]證明LBP能夠抑制2種結腸癌細胞系SW480和Caco-2的生長,并呈劑量依賴性。LI等[43]首次報道LBP通過改變雌二醇的代謝途徑來抑制乳腺癌細胞MCF-7的生長,且LBP在第3天對MCF-7細胞表現出劑量依賴性的生長抑制作用。ZHANG等[44]從枸杞粗多糖中分離出5個組分:LBP-a8、LBP-p8、LBP-a3、LBP-a1、LBP-a4。LBP-a8、LBP-a3、LBP-a1和LBP-a4,均對肝癌細胞SMMC-7721的增殖具有劑量依賴性和時間依賴性。此外,LBP-a4 (10.2 kDa)由糖醛酸(11.5%)、蛋白質(0.34%)和中性糖(39.02%)組成,可以在G0/G1期阻滯SMMC-7721細胞分裂,顯著提高細胞內Ca2+濃度。
綜上所述,LBP在體內可通過誘導細胞凋亡和阻滯細胞周期,從而表現出對多種類型癌細胞的抑制活性。

圖3 LBP可能的抗腫瘤活性機制
3.4 神經保護活性
LBP在多種動物模型中均有神經保護作用,但其作用機制尚未完全闡明(圖4)。在神經系統中,LBP可以防止由缺血/再灌注損傷、β淀粉樣蛋白、谷氨酸引起的神經元損傷。
谷氨酸興奮性毒性是缺血后神經元死亡的主要原因之一。SHI等[45]的研究表明LBP通過抗氧化作用來保護神經元免受缺血性損傷。他們證實了LBP具有調節含有NMDA受體信號通路的NR2B和NR2A作用。除此之外,谷氨酸興奮性毒性還與許多神經退行性疾病有關,包括阿爾茨海默病,降低谷氨酸神經毒性是該病的治療策略之一。HO等[46]的研究結果表明,LBPs可降低乳酸脫氫酶(lactate dehydrogenase,LDH)的活性,抑制應激活化蛋白激酶(c-Jun N-terminal kinase,JNK)的磷酸化和caspase-3的表達,從而減少細胞凋亡。

圖4 LBP對谷氨酸誘導神經毒性可能的神經保護機制
右美沙芬(dextromethorphan,DXM)是止咳藥中的有效成分,也是青少年濫用的常見毒品之一。高劑量的DXM會導致快感甚至產生幻覺。長期食用DXM也可能導致抑郁癥相關疾病。PO等[47]用70 ℃的熱水提取得到的LBP減輕了DXM誘導的抑郁和社交焦慮相關行為和神經抑制現象。
視網膜缺血是許多眼病的共同癥狀,缺血性損傷會導致視網膜功能障礙和神經元死亡。在YANG等[49]的研究中,C57BL/6N雄性小鼠先用PBS或LBP(1 mg/kg或10 mg/kg)給藥7 d,隨后對小鼠進行2 h的腦動脈(middle cerebral artery occlusion,MCAO)閉塞處理,對神經功能缺陷進行評估,結果表明,LBP處理顯著改善了腦動脈閉塞誘導的神經功能缺損,減少了梗死面積、腦半球腫脹和含水量。這提示LBP可作為缺血性卒中高危患者的預防性神經保護藥。此研究組進一步探究發現[49],在LBP處理的視網膜中觀察到活細胞數量增加,以及蛋白質激酶C-α的增加和膠質纖維酸性蛋白的減少。研究結果表明每天攝入LBP可以有效減輕因局部缺血引起的視網膜功能障礙以及相關的神經元死亡和神經膠質細胞活化的減少。

圖5 LBP對MCAO誘導的腦損傷可能的神經保護機制
4 展望
綜上所述,由于具有多種生物活性,LBP作為保健食品具有廣闊的開發前景。考慮到多糖的生物活性與其化學結構密切相關,而多糖的理化性質又很大程度取決于提取方式,枸杞多糖在生物活性方面的精準應用將是基于對某些特定結構組分的定向提取。然而,大多數對制備枸杞多糖的研究僅專注于提高得率,提取方法對枸杞多糖結構影響的研究甚少。此外,LBP中活性成分的精細結構未得到研究,構效關系尚不明確。
因此,日后的研究應著重建立枸杞多糖的提取方式、化學結構及生物活性三者之間的對應關系,讓活性組分的提取具有可控性,可為高效利用枸杞多糖提供理論依據與實踐參考。

