不同時期干旱脅迫對甘薯生長和抗氧化能力的影響
張海燕,解備濤,汪寶卿,董順旭,段文學,張立明
不同時期干旱脅迫對甘薯生長和抗氧化能力的影響
張海燕1,解備濤1,汪寶卿1,董順旭1,段文學1,張立明2
(1山東省農業科學院作物研究所/農業農村部黃淮海薯類科學觀測實驗站/特色作物山東省工程實驗室,濟南 250100;2山東省農業科學院,濟南 250100)
【目的】研究不同時期干旱脅迫導致甘薯減產的機理,為旱作地區甘薯生產提供理論依據和技術支撐。【方法】在人工控水條件下,以抗旱品種濟薯21和不抗旱品種濟紫薯1號為試驗材料,每個品種設4個水分處理,分別為WW(全生育期正常灌水,對照)、DS1(發根分枝期干旱脅迫)、DS2(蔓薯并長期干旱脅迫)和DS3(快速膨大期干旱脅迫),研究不同時期干旱脅迫對甘薯生長和抗氧化能力的影響。【結果】干旱脅迫導致甘薯薯干產量顯著下降,早期干旱脅迫薯干產量下降幅度最大,濟薯21(抗旱品種)的DS1、DS2和DS3處理產量分別比對照減產32.24%、30.68%和13.76%,濟紫薯1號(不抗旱品種)分別比對照減產44.02%、39.54%和17.87%。功能葉、纖維根和塊根抗氧化酶活性均在干旱脅迫后升高,且干旱脅迫時間越早,抗氧化酶活性升高的幅度越大;各生育時期纖維根的酶活性均高于塊根和功能葉,說明甘薯纖維根對干旱脅迫的敏感性最強。干旱脅迫可導致甘薯功能葉相對電導率升高,功能葉、纖維根和塊根的MDA含量升高,且脅迫時間越早,升高的幅度越大。【結論】干旱脅迫時間越早,功能葉、纖維根和塊根的抗氧化酶系統受破壞程度越大,從而抑制了甘薯葉片和根系的正常生長,限制了塊根的形成和膨大,發根分枝期是甘薯塊根產量對水分最敏感的時期。
甘薯;干旱脅迫;產量;抗氧化能力
0 引言
【研究意義】甘薯作為耐瘠薄作物,多數種植在丘陵旱薄地,干旱限制了塊根的形成和膨大,導致產量難以提高。近年來,我國北方薯區干旱經常發生,尤其是在4月中下旬至7月上旬,正值甘薯田間栽插和根系發育的關鍵時期,干旱成為甘薯發根緩苗和塊根形成的主要限制因素。通過研究干旱脅迫導致甘薯減產的生理機制,提出關鍵時期補充水分的技術措施,可為干旱年份甘薯生產提供理論依據和技術支撐。【前人研究進展】前人研究認為,干旱脅迫導致甘薯減產的原因在于限制了莖葉和根系的生長,不同時期表現的敏感程度不同[1-2],苗期敏感程度較高,干旱脅迫導致地上部失水萎蔫,不定根的形成、生長和分化受抑制,薯苗移栽成活率下降[3],中后期干旱脅迫,土壤機械阻力的增大限制了甘薯根系生長和塊根膨大[4],因此不同時期干旱脅迫均導致甘薯產量下降[2]。干旱脅迫導致減產的機理較復雜,涉及到諸多生理、生化變化,在植物對逆境脅迫的響應機制研究中,抗氧化酶活性及膜脂過氧化作用被廣泛應用,各種非生物脅迫對植物造成的損傷均與氧化損傷有關[5]。干旱脅迫作為非生物脅迫造成減產主要是氧化損傷引起的[6-8],增強抗氧化能力可以改善植物對脅迫的耐受性[9-10]。逆境脅迫誘導植物產生過多的氧自由基,而抗氧化酶則起著清除自由基的作用,維持著氧化還原的平衡,提高了植物忍耐或抵抗逆境脅迫的能力[11]。前人研究認為,干旱脅迫導致甘薯葉片過氧化氫(H2O2)、超氧陰離子自由基()等活性氧積累,脂氧合酶(LOX)活性增加,超氧化物歧化酶(SOD)、過氧化氫酶(CAT)和抗壞血酸過氧化物酶(ASP)活性下降,還原性抗壞血酸(ASA)含量上升,還原性谷胱甘肽(GSH)含量先降后升,丙二醛(MDA)含量增加,膜透性增大[12-13]。輕度水分脅迫,對甘薯葉片抗氧化酶活性有誘導作用,重度水分脅迫,抗氧化酶系統損傷,品種間差異較大,抗旱性強的高于抗旱性弱的[14-15]。干旱脅迫條件下,活性氧的累積導致葉綠體膜結構受損、質膜損傷、膜透性增加[16-17],隨著脅迫的加劇,MDA含量呈逐漸升高的趨勢,MDA含量的上升與膜透性增大呈顯著的正相關,抗旱性強的品種抗膜脂過氧化能力較強,MDA含量也較低,細胞膜受傷害程度也較輕,其含量高低可反映植物受傷害的程度[18]。【本研究切入點】在植物對逆境脅迫的機理研究方面,抗氧化能力已被廣泛用于評價植物的抗旱性,在甘薯抗旱性研究中,多集中在苗期葉片抗氧化能力對干旱脅迫的響應,針對不同生育時期干旱脅迫,研究甘薯功能葉、纖維根和塊根抗氧化能力對干旱脅迫響應機制的報道尚未見報道。【擬解決的關鍵問題】本研究在人工控水條件下,以抗旱品種濟薯21和不抗旱品種濟紫薯1號為試驗材料,通過研究不同時期干旱脅迫對甘薯生長和抗氧化能力的影響,探討干旱脅迫條件下甘薯減產的機理,為干旱年份甘薯生產提供理論依據。
1 材料與方法
1.1 試驗設計
以抗旱品種濟薯21和不抗旱品種濟紫薯1號為試驗材料,每個品種設4個水分處理,分別為WW(全生育期正常灌水,對照);DS1(發根分枝期干旱脅迫);DS2(蔓薯并長期干旱脅迫);DS3(快速膨大期干旱脅迫)(表1),隨機區組設計,每處理重復3次。采用測墑補灌的方法給抗旱池補充水分,每隔5—7 d灌水一次,灌水前用HH2土壤水分測定儀(Delta-T Devices LTD,Cambridge,UK)測定0—60 cm土層土壤絕對含水量,根據各處理池子設計含水量,用水表計量補充灌水。灌水量m=10ρbH(βi-βj),m為灌水量(mm),H為該時段土壤計劃濕潤層的深度(cm),ρb為計劃濕潤層土壤容重(g·cm-3),βi為設計含水量(田間持水量乘以設計相對含水量),βj為灌溉前土壤絕對含水量[19]。干旱脅迫處理的抗旱池在脅迫前7 d停止灌水。
試驗在山東省農業科學院作物研究所抗旱棚內進行,每個池子四周由水泥砌成,底部開放,長×寬=6 m×4 m,深為2 m。2013—2015年栽插時間分別為6月10日、6月12日和6月11日,收獲時間分別為10月9日、10月11日和10月10日,生育期均為122 d。

表1 不同處理的土壤相對含水量
WW:對照,全生育期正常灌水;DS1:發根分枝期干旱脅迫;DS2:蔓薯并長期干旱脅迫;DS3:快速膨大期干旱脅迫。下同
WW: control, well watered at whole stage; DS1: drought stress during the establishment stage; DS2: drought stress during the intermediate stage (storage root initiation); DS3: drought stress during the final stage (storage root bulking). The same as below
1.2 測定項目及方法
1.2.1 生物量、葉面積系數和薯干產量測算方法 栽后40 d開始,每隔20 d調查取樣1次,每處理選取代表性植株5株,稱量其地上部和地下部鮮重,烘干后稱取干重,獲得地上部和地下部生物量(g/plant)。
葉面積系數測算參考王留梅等的方法[20],測量出所有葉片的長(沿葉脈測量)和寬(最寬處測量),所有葉片長乘以寬之和得出單株虛葉面積,葉面積系數=單株虛葉面積×0.6×密度(株數/hm2)/10 000。
收獲期進行小區測產,獲得小區薯塊鮮產,折算成單位面積薯塊鮮產(kg·hm-2)。每處理選取代表性薯塊5塊,稱取鮮重,待烘干后再稱取干重,計算獲得干物率。根據薯塊鮮產和干物率計算獲得薯干產量(kg·hm-2)。
1.2.2 取樣方法 栽后40 d開始,每20 d取樣1次。田間選取代表性植株5株,取主莖倒4葉,用于葉綠素、葉片相對電導率測定,錫箔紙包裝,編號后放置液氮中。將整個根系小心挖出,用蒸餾水迅速將根系沖洗干凈,用吸水紙吸干表面水分,取纖維根根尖處5 cm用于根系活力的測定,將纖維根和塊根分類取樣,錫箔紙包好,編號后放置液氮中。將液氮速凍樣品放入-80℃超低溫冰箱中保存,用于酶活力測定。
1.2.3 功能葉葉綠素含量、相對電導率和根系活力測定方法 參考李合生[21]的方法測定葉綠素含量,稱取待測樣品0.5 g左右,研磨后轉入具塞刻度試管中,加95%乙醇15 ml,閉光保存48 h。以95%乙醇為空白,在波長665 nm、649 nm下測定光密度。Ca=13.95D665-6.88D649;Cb=24.96D649-7.32D665。式中,D649和D665為待測樣品在波長665 nm和649 nm的吸光度,Ca、Cb分別為葉綠素a和b的濃度。色素含量(mg·g-1FW)=色素的濃度C(mg·L-1)×提取液體積(L)/樣品鮮重(g)。
采用浸泡法測定相對電導率,將葉片剪成長條,置于10 ml去離子水的刻度試管中,室溫下浸泡處理12 h,測定浸提液電導率(R1),沸水浴加熱30 min后,再次測定浸提液電導率(R2),相對電導率=R1/R2×100%。
采用氯化三苯基四氮唑(TTC)法測定根系活力[22]。
1.2.4 功能葉、纖維根和塊根抗氧化酶活性測定方法 稱取0.5 g左右的樣品放入研缽中,加5 mL磷酸緩沖液(pH 7.8),冰浴研磨,勻漿倒入離心管中,冷凍離心20 min(10 000 r/min),測定上清液體積,4°C保存備用。抗氧化酶活性測定參考陳建勛等[23]的方法,略有改進。超氧化物歧化酶(SOD)活性采用氮藍四唑(NBT)光化還原法測定;過氧化物酶(POD)活性采用愈創木酚法測定;過氧化氫酶(CAT)活性采用紫外吸收法;抗壞血酸過氧化物酶(APX)活性和谷胱甘肽還原酶(GR)活性采用比色法測定。
1.3 數據處理與分析
數據處理分析及作圖采用Microsoft Excel 2010進行,方差分析和差異顯著性檢驗采用DPS v8.01版數據處理軟件。本試驗采用3年數據,方差分析結果表明,各指標及其與年份間的互作不顯著(<0.05),試驗結果趨勢基本一致,因此,均采用3年的平均值進行分析。
2 結果
2.1 不同時期干旱脅迫對甘薯生長的影響
2.1.1 薯干產量 從表2可以看出,不同時期干旱脅迫均導致甘薯薯干產量下降,3個時期干旱脅迫比較,發根分枝期干旱脅迫薯干產量下降幅度最大。抗旱品種減產幅度小于不抗旱品種。抗旱品種濟薯21的DS1、DS2和DS3處理薯干產量分別比對照減產32.24%、30.68%和13.76%,不抗旱品種濟紫薯1號分別比對照減產44.02%、39.54%和17.87%。
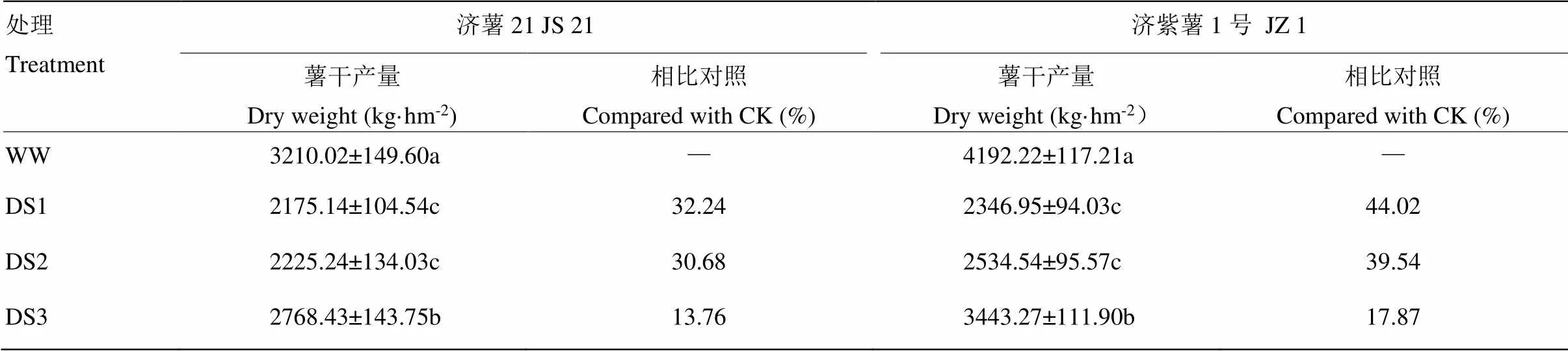
表2 不同時期干旱脅迫對甘薯塊根產量的影響
數據為3次重復的平均值±標準差。同列數據不同字母表示差異顯著(<0.05)。下同
Data are shown in mean ± standard deviation of three replicates. Different letter in the same column meant significantly different (<0.05). The same as below
2.1.2 地上部和地下部生物量 表3可見,不同時期干旱脅迫均導致甘薯地上部生物量下降,3個時期干旱脅迫比較,發根分枝期干旱脅迫的甘薯地上部生物量下降幅度最大,其次是蔓薯并長期和塊根快速膨大期。2個品種比較,抗旱品種濟薯21下降幅度小于不抗旱品種濟紫薯1號,栽后100 d,DS1、DS2、DS3處理的地上部生物量與對照相比,濟薯21分別降低29.17%、15.96%、8.61%,濟紫薯1號分別降低37.43%、19.10%、9.22%。
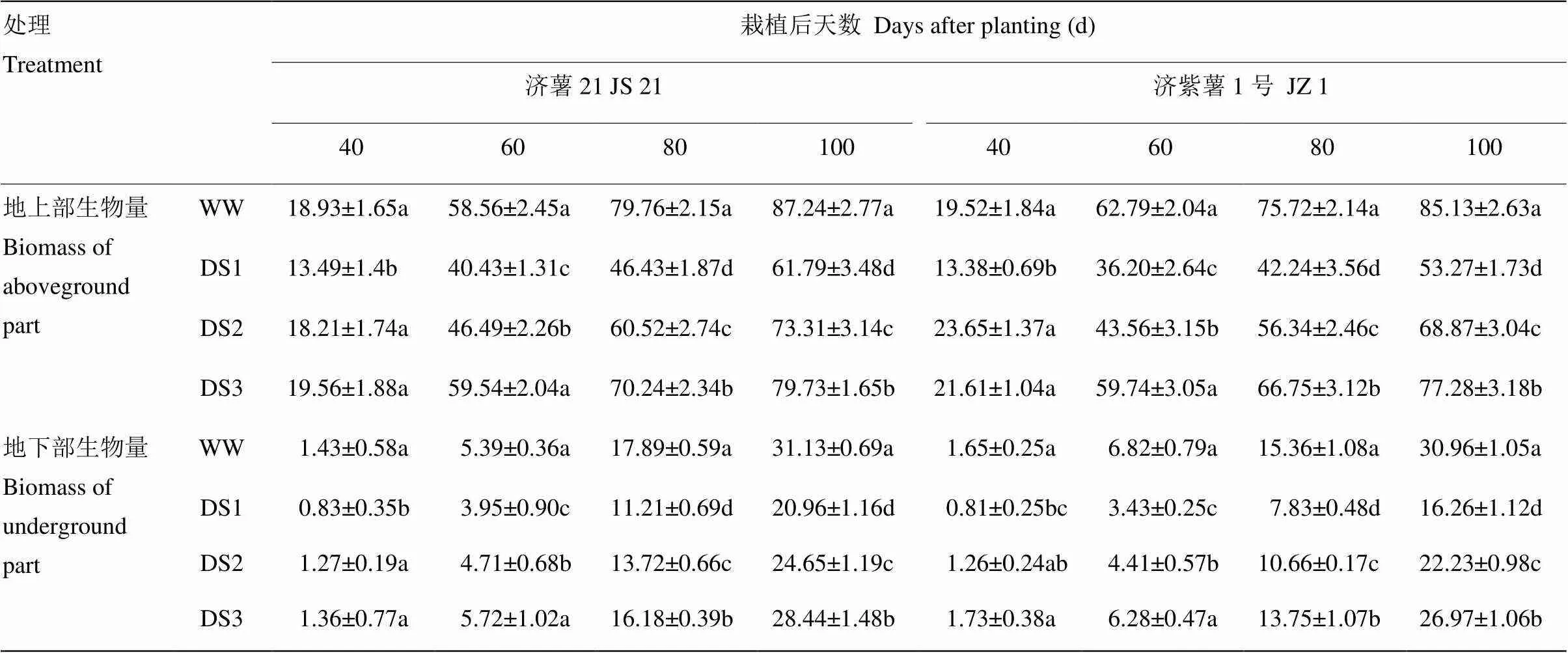
表3 不同時期干旱脅迫對甘薯地上部和地下部生物量的影響
干旱脅迫處理的地下部生物量均顯著低于對照,與對照相比的降低幅度均表現為DS1>DS2>DS3。栽后100 d,DS1處理,濟薯21和濟紫薯1號分別降低32.67%和47.49%,DS2處理分別降低20.82%和28.22%,DS3處理分別降低8.62%和12.91%(表3)。說明干旱脅迫抑制了甘薯根系的生長以及塊根的形成和膨大,以發根分枝期脅迫對甘薯地下部生物量影響最大。抗旱品種地下部生物量下降幅度小于不抗旱品種。
2.1.3 葉面積系數 從表4可以看出,各處理在干旱脅迫后葉面積系數均顯著低于對照,3個時期干旱脅迫比較,發根分枝期干旱脅迫的葉面積系數下降幅度最大,其次是蔓薯并長期和塊根快速膨大期。2個品種比較,抗旱品種濟薯21下降幅度小于不抗旱品種濟紫薯1號,栽后80 d,各處理的葉面積系數均達到峰值,DS1、DS2、DS3處理的葉面積系數與對照相比,濟薯21分別降低50.62%、31.08%、11.72%,濟紫薯1號分別降低56.92%、40.59%、20.37%。
2.1.4 功能葉葉綠素含量 從圖1可以看出,甘薯功能葉葉綠素含量呈單峰曲線,栽后80 d達到峰值,隨后開始下降。2個品種干旱脅迫處理的葉綠素含量各生育時期均顯著低于對照,且以DS1處理的降幅最大,其次是DS2和DS3處理。栽后100 d,DS1、DS2、DS3處理的功能葉葉綠素含量與對照相比,濟薯21分別降低23.36%、17.33%、6.36%,濟紫薯1號分別降低35.71%、20.84%、16.89%。說明干旱脅迫可導致甘薯功能葉葉綠素含量下降,且脅迫時間越早,下降幅度越大,抗旱品種濟薯21下降幅度小于不抗旱品種濟紫薯1號。
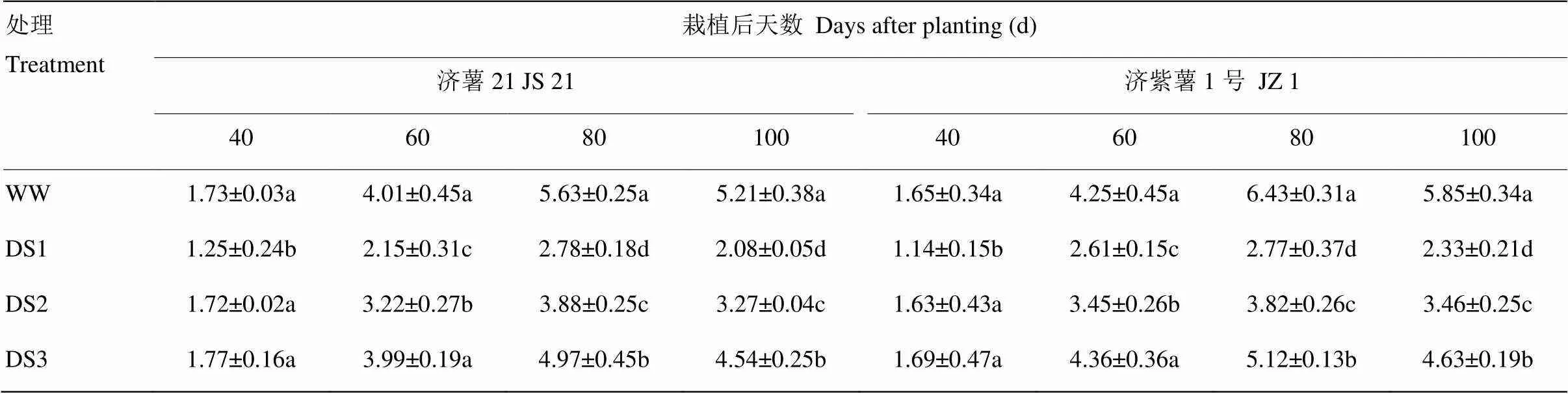
表4 不同時期干旱脅迫對甘薯葉面積系數的影響
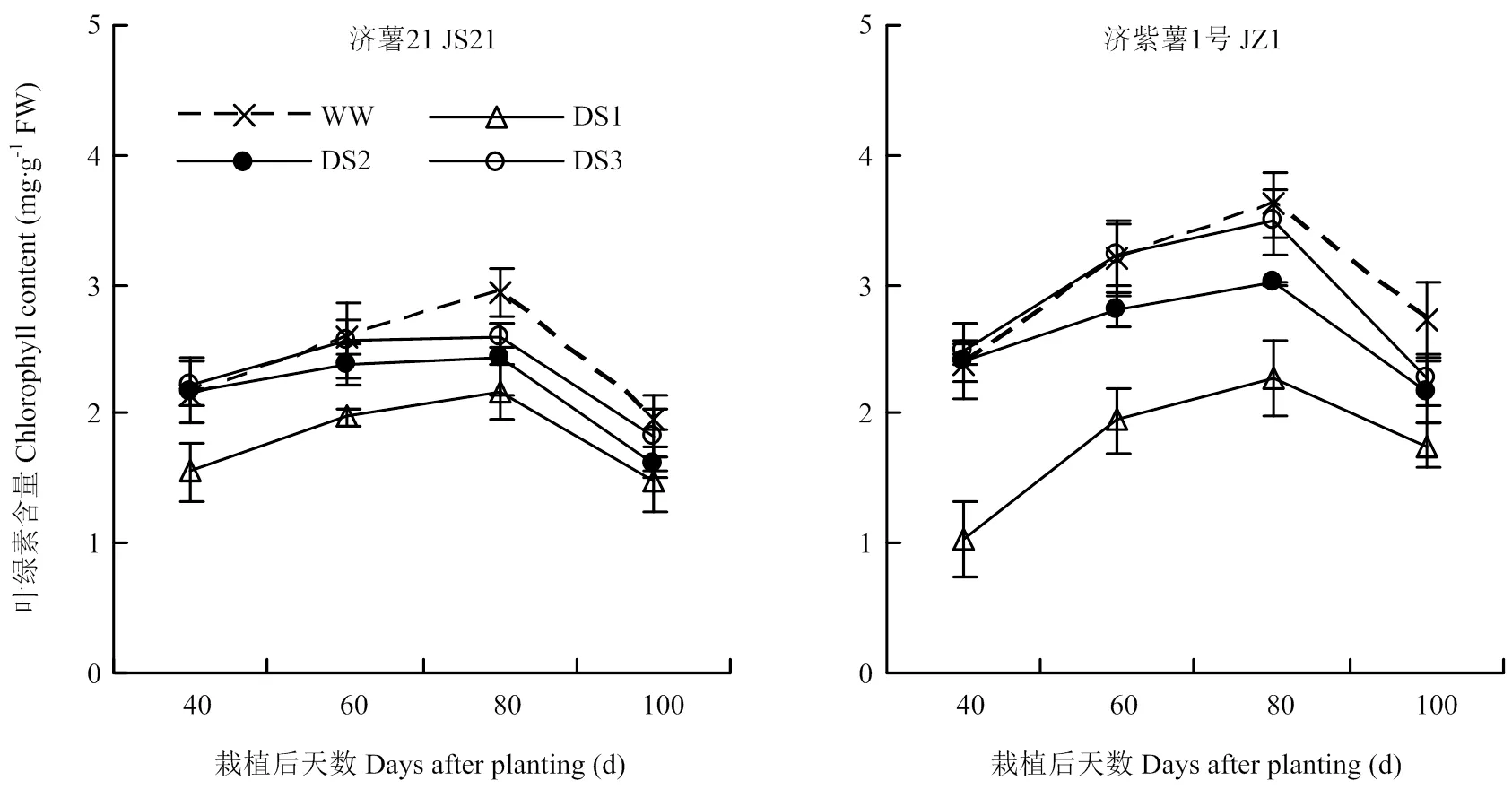
圖1 不同時期干旱脅迫對甘薯功能葉葉綠素含量的影響
2.2 不同時期干旱脅迫對甘薯功能葉抗氧化能力的影響
2.2.1 相對電導率 干旱脅迫處理的功能葉相對電導率均在脅迫后呈逐漸升高的趨勢,各生育時期均表現出DS1處理升高幅度最大,其次為DS2和DS3處理。抗旱品種濟薯21功能葉相對電導率與對照相比的升高幅度均小于不抗旱品種濟紫薯1號(圖2)。說明干旱脅迫時間越早,甘薯功能葉相對電導率與對照
相比的升高幅度越大。
2.2.2 MDA含量 圖3可見,所有處理功能葉MDA含量的變化趨勢一致,隨著甘薯生長發育,甘薯功能葉MDA含量均呈逐漸上升的趨勢。各生育時期均表現出干旱脅迫處理的MDA含量高于對照,且DS1處理升高幅度最大,其次為DS2和DS3處理。干旱脅迫條件下,抗旱品種濟薯21功能葉MDA含量與對照相比的升高幅度小于不抗旱品種濟紫薯1號。
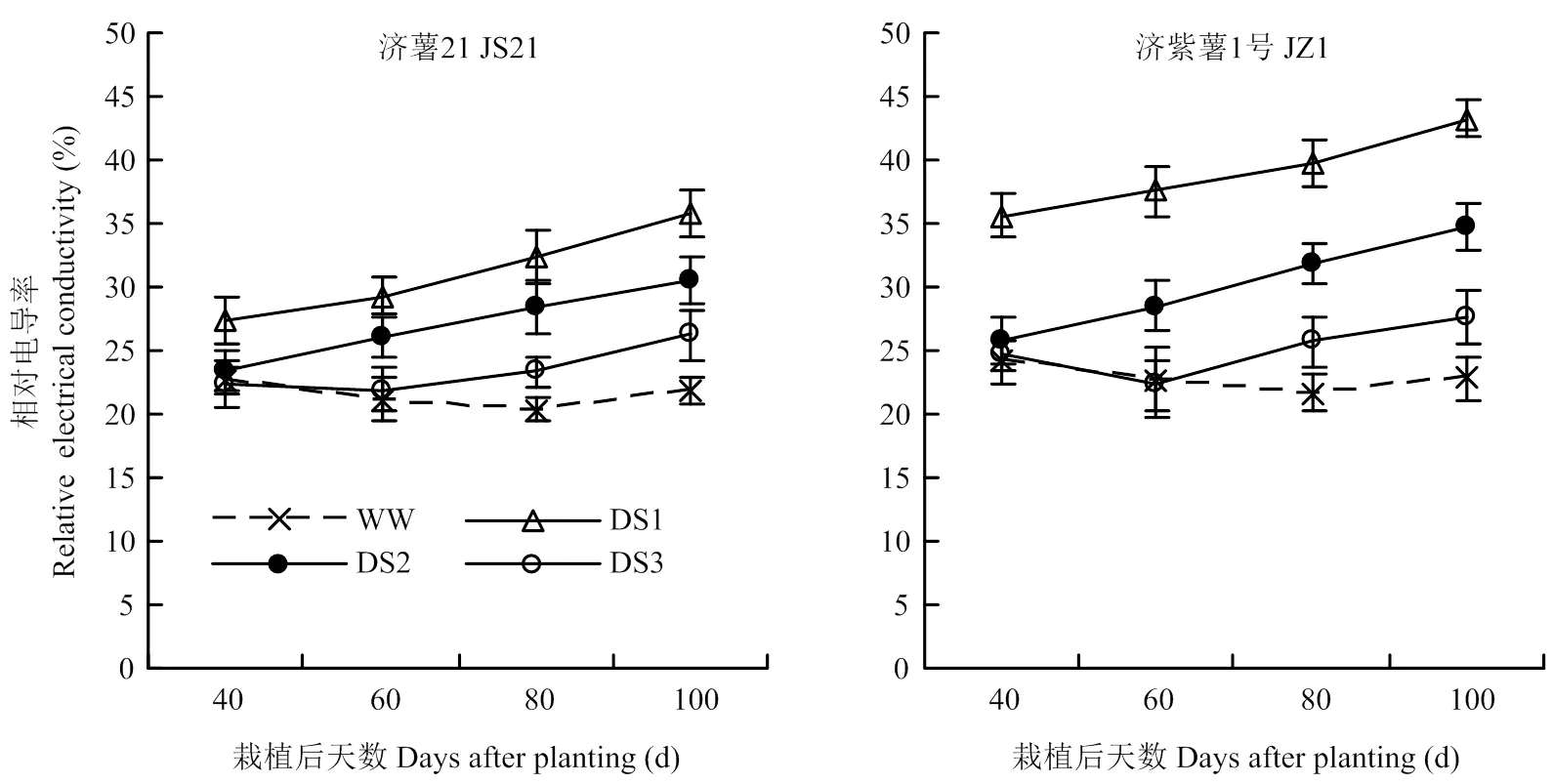
圖2 不同時期干旱脅迫對甘薯功能葉相對電導率的影響
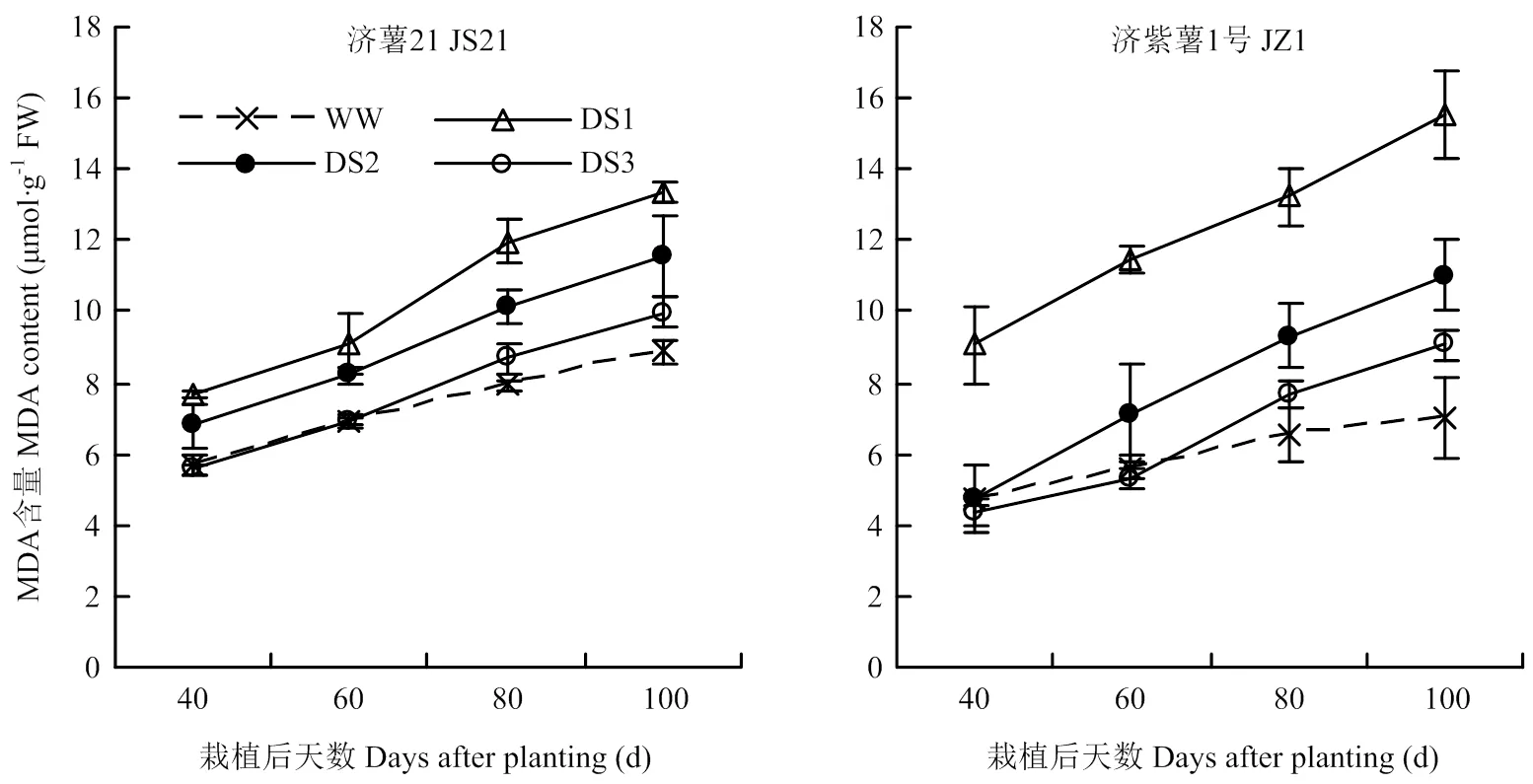
圖3 不同時期干旱脅迫對甘薯功能葉MDA含量的影響
2.2.3 酶活性 從表5可以看出,2個品種功能葉抗氧化酶活性的變化趨勢基本一致。干旱脅迫條件下,DS1處理的SOD、POD、CAT和APX活性在脅迫后40 d高于對照,60 d后低于對照,抗旱品種濟薯21的上升幅度高于不抗旱品種濟紫薯1號,下降幅度低于濟紫薯1號。DS2和DS3處理均在脅迫后升高,栽后100 d,DS2和DS3處理的抗氧化酶活性均高于對照。
2.3 不同時期干旱脅迫對甘薯纖維根抗氧化能力的影響
2.3.1 根系活力 圖4結果表明,不同時期干旱脅迫均導致纖維根根系活力下降,3個時期干旱脅迫比較,發根分枝期干旱脅迫的根系活力下降幅度最大,其次是蔓薯并長期和塊根快速膨大期。2個品種比較,抗旱品種濟薯21根系活力與對照相比下降幅度小于不抗旱品種濟紫薯1號。
2.3.2 MDA含量 各生育時期均表現出干旱脅迫處理的纖維根MDA含量高于對照,且以DS1處理升高幅度最大,其次為DS2和DS3處理(圖5)。抗旱品種濟薯21在干旱脅迫條件下,纖維根MDA含量與對照相比的升高幅度小于不抗旱品種濟紫薯1號。
2.3.3 酶活性 表6可見,干旱脅迫條件下,DS1處理的纖維根SOD、POD、CAT和APX活性均在脅迫后40 d高于對照,抗旱品種濟薯21的升高幅度高于不抗旱品種濟紫薯1號。DS2和DS3處理的纖維根酶活性在脅迫后升高的幅度低于DS1。說明干旱脅迫時間越早,對纖維根抗氧化酶活性的影響越大,中后期脅迫甘薯纖維根已具備較高的酶活性,干旱脅迫對其影響較小。
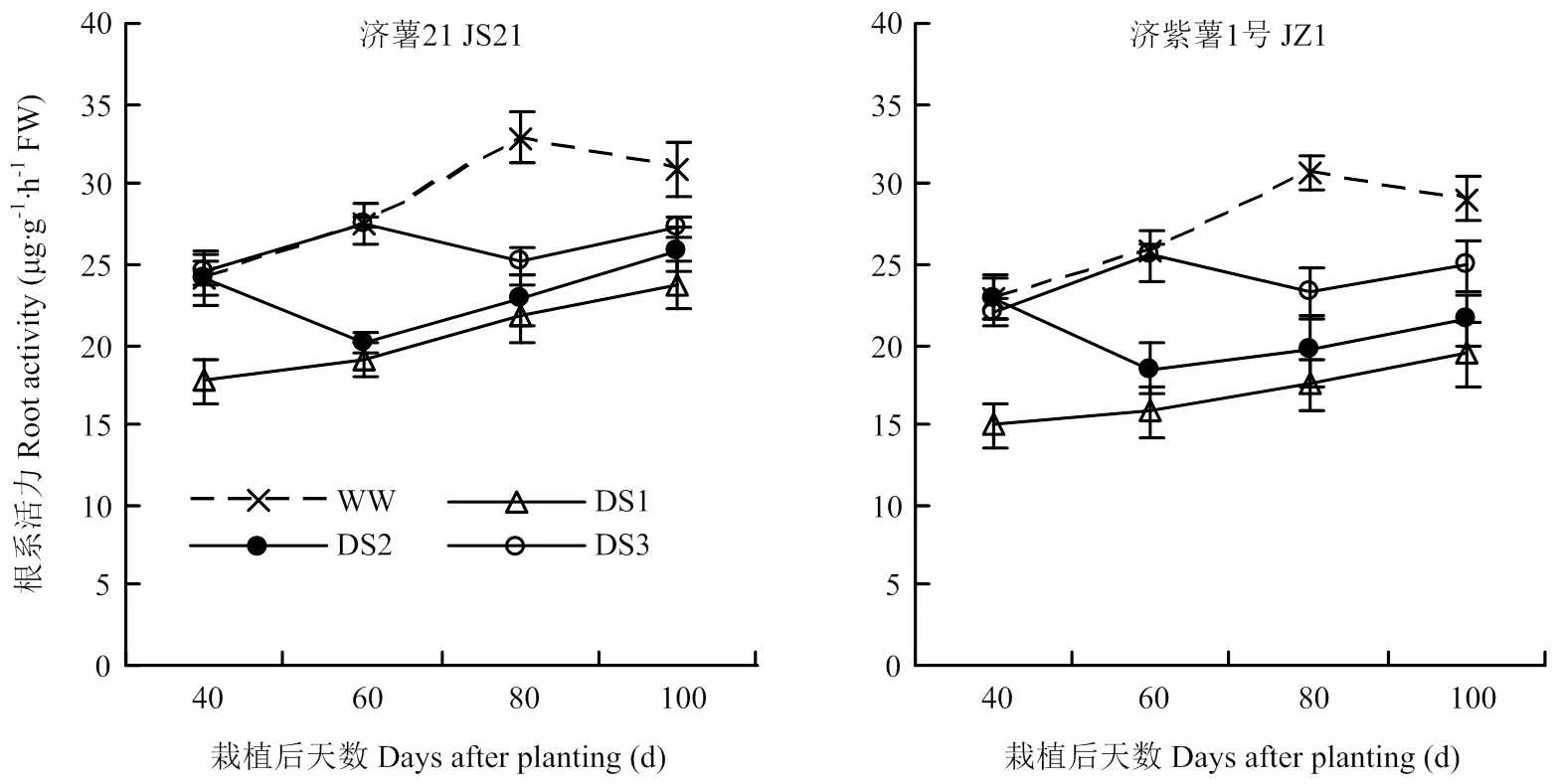
圖4 不同時期干旱脅迫對甘薯根系活力的影響
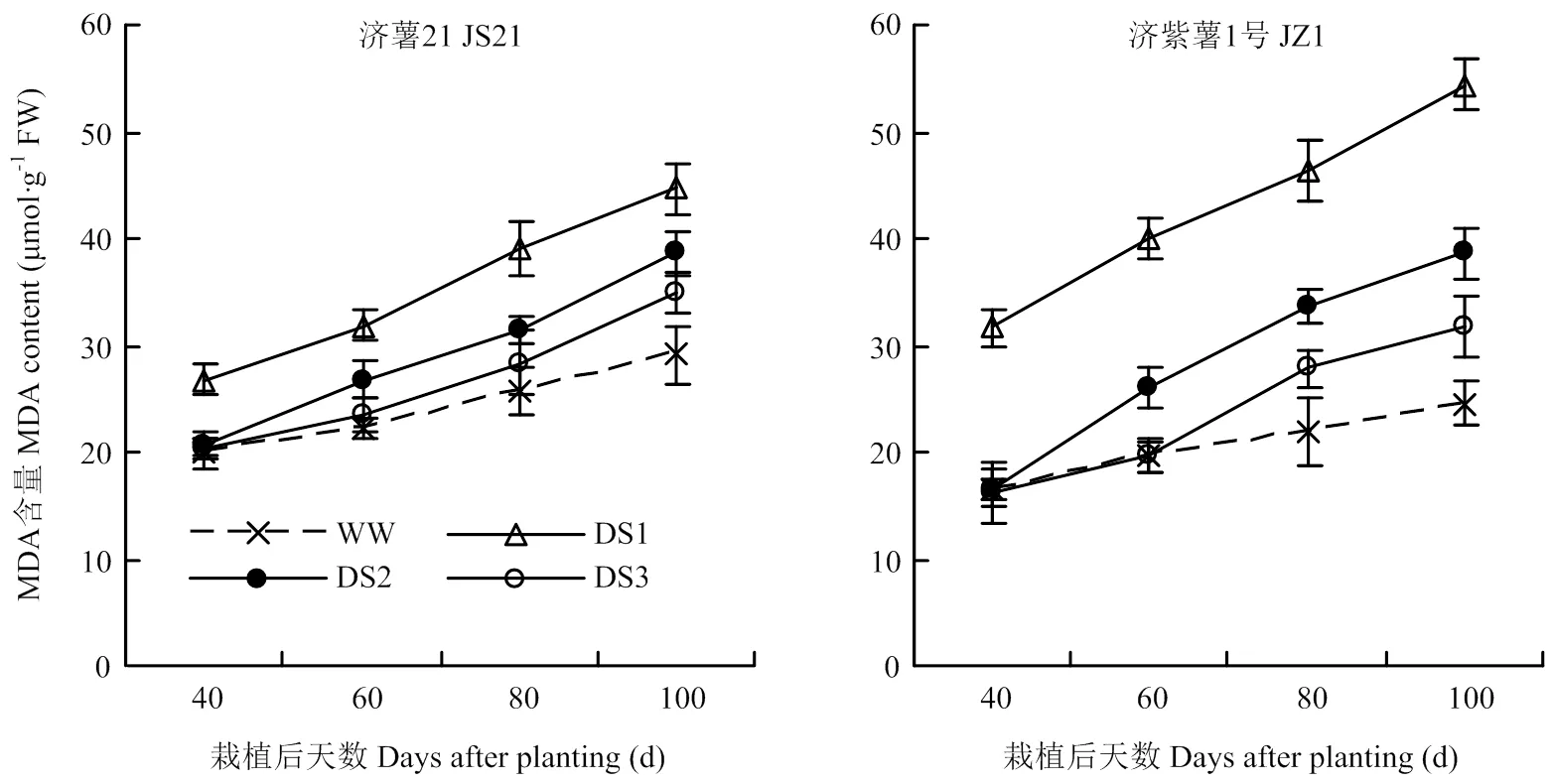
圖5 不同時期干旱脅迫對甘薯纖維根MDA含量的影響
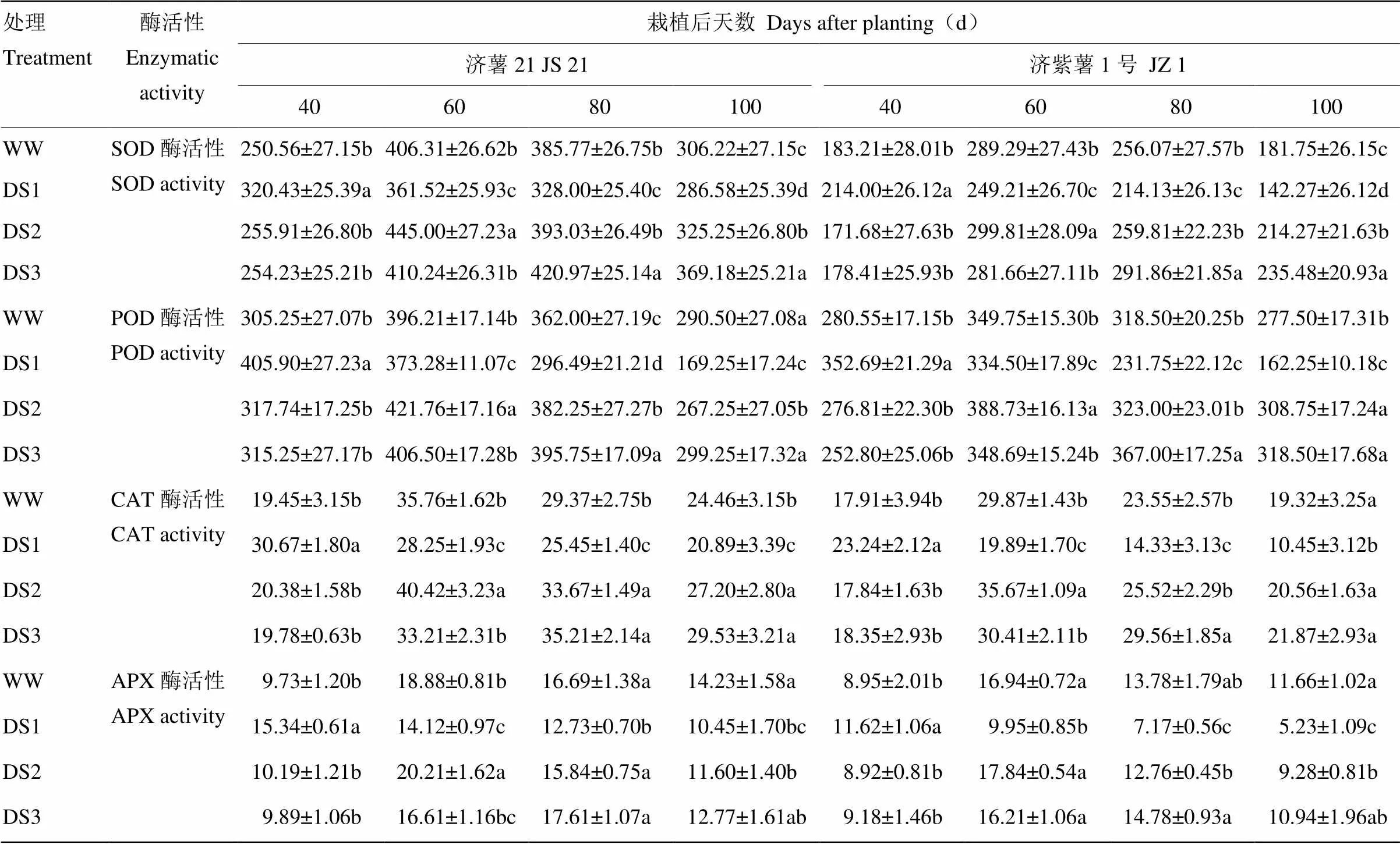
表5 不同時期干旱脅迫對甘薯功能葉SOD、POD、CAT和APX活性的影響
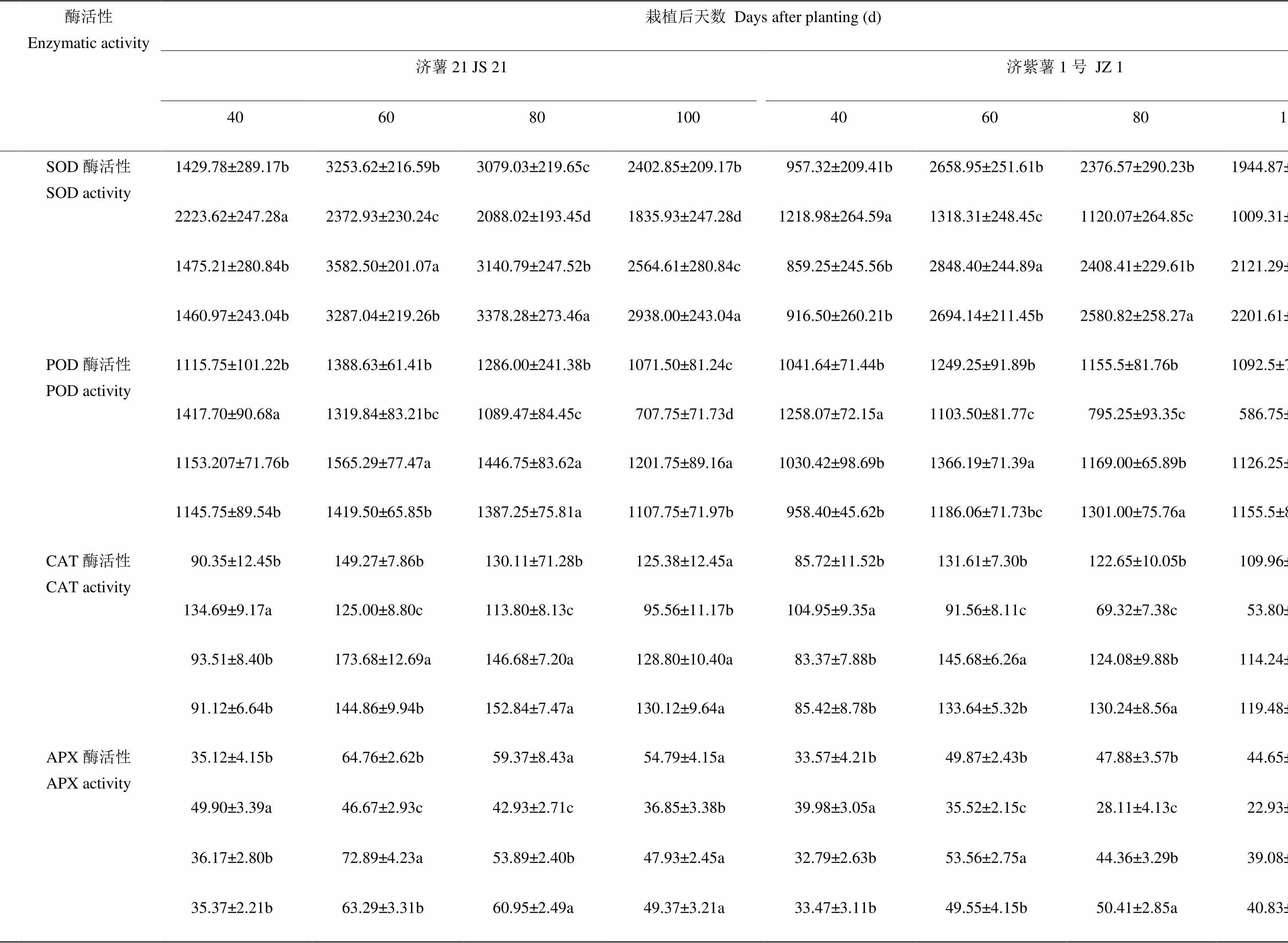
表6 不同時期干旱脅迫對甘薯纖維根SOD、POD、CAT和APX活性的影響
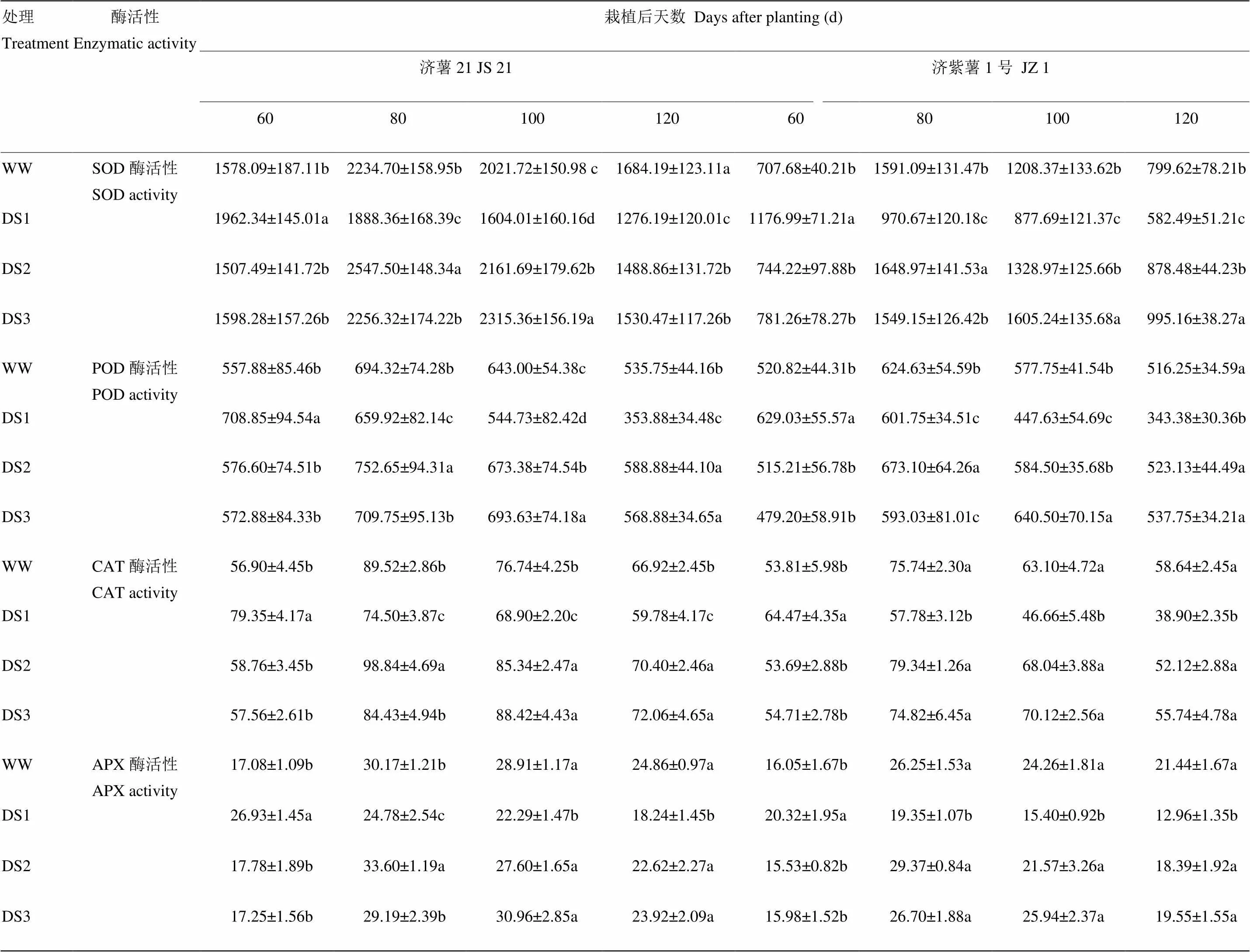
表7 不同時期干旱脅迫對甘薯塊根SOD、POD、CAT和APX活性的影響
2.4 不同時期干旱脅迫對甘薯塊根抗氧化能力的影響
2.4.1 MDA含量 從圖6可以看出,干旱脅迫處理的纖維根MDA含量均高于對照,3個時期干旱脅迫比較,發根分枝期干旱脅迫的塊根MDA含量升高幅度最大,其次為蔓薯并長期和塊根快速膨大期。干旱脅迫處理的塊根MDA含量與對照相比的升高幅度表現為抗旱品種濟薯21小于不抗旱品種濟紫薯1號。
2.4.2 酶活性 從表7可以看出,2個品種塊根抗氧化酶活性的變化趨勢基本一致。干旱脅迫導致甘薯塊根SOD、POD、CAT和APX活性升高,DS1處理的塊根SOD活性升高幅度和下降幅度均高于DS2和DS3處理。抗旱品種濟薯21的升高幅度高于不抗旱品種濟紫薯1號。說明發根分枝期干旱脅迫對甘薯塊根抗氧化酶活性的影響最大。
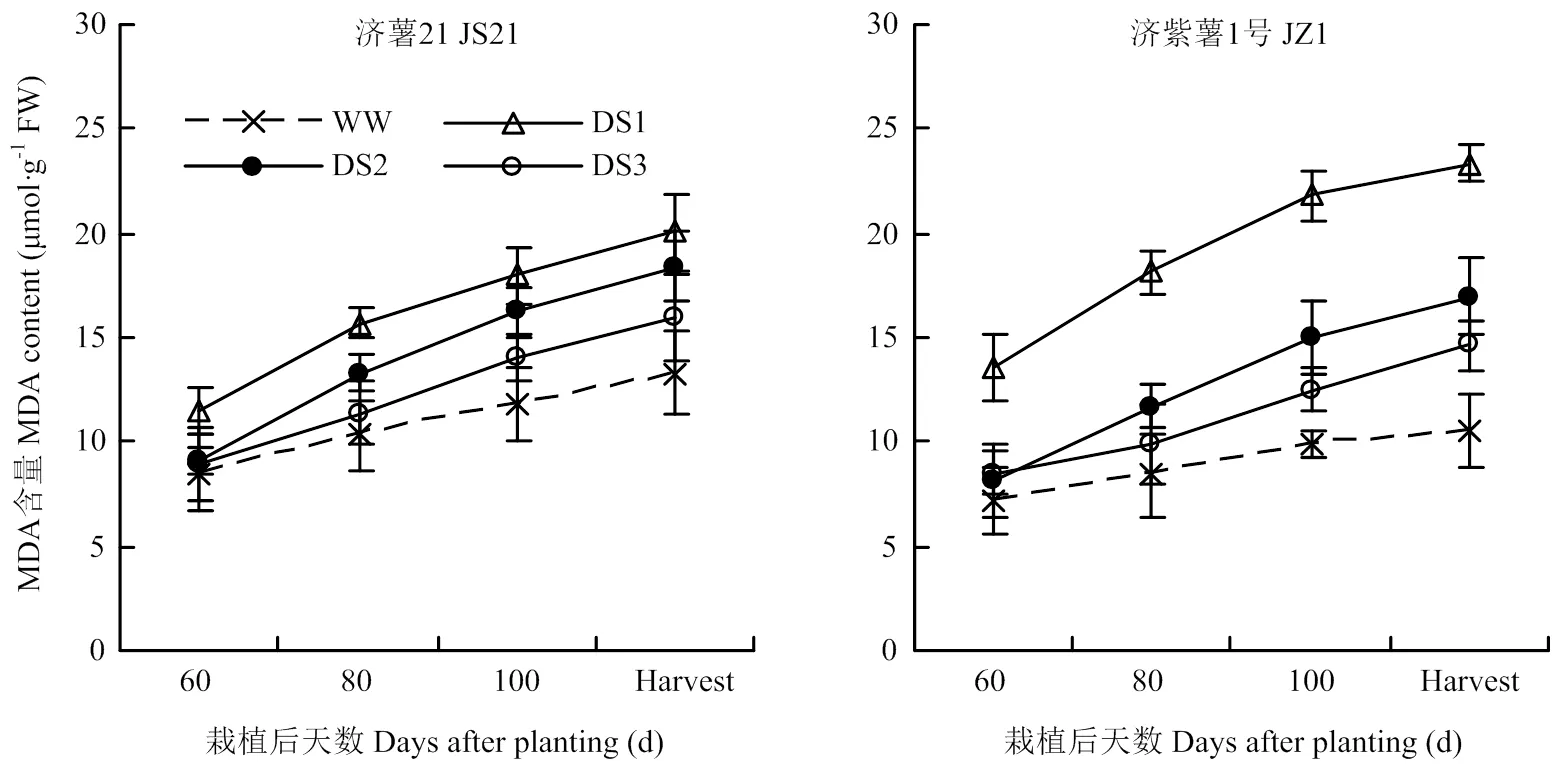
圖6 不同時期干旱脅迫對甘薯塊根MDA含量的影響
3 討論
3.1 不同時期干旱脅迫對甘薯生長的影響
干旱脅迫可導致植物單株葉面積降低,生物量下降[24-26]。前人研究認為,不同甘薯品種的植株形態、生長勢和產量性狀等對干旱脅迫的適應能力不同,導致了品種間抗旱性的差異,葉面積系數、比葉面積、塊根重量等與品種抗旱性呈顯著的正相關關系[27],收獲期的相對莖葉重能反映不同品種對逆境條件的適應性[28]。干旱脅迫導致的葉面積系數和生物量的下降幅度,品種間不同,可作為甘薯品種抗旱性鑒定的指標[29]。本試驗中,抗旱品種濟薯21的地上部生物量、地下部生物量、葉面積系數、葉綠素含量等在干旱脅迫條件下與對照相比的下降幅度均低于不抗旱品種濟紫薯1號,認為甘薯植株的相對生物量、葉面積系數以及葉綠素含量等指標可以反映不同品種對干旱脅迫的適應性。
干旱脅迫降低了甘薯總葉數[30],使葉片大小、比葉面積和葉面積系數不同程度地降低,單株光合面積下降[1, 31],光合生產能力下降,生物產量和薯干產量隨之下降[32],前期和中期脅迫對甘薯產量影響大于后期,前期干旱甘薯的總生物量降低50%,中期干旱地上和地下生物量分別降低38.4%和31.1%,后期干旱地上和地下生物量均減低10%[1]。不同時期干旱脅迫均抑制了甘薯地上部生長及塊根形成和膨大,從而造成塊根產量不同程度的降低,干旱脅迫時間越早,下降的幅度越大[2]。本研究認為,干旱脅迫條件下,甘薯葉面積系數的下降和功能葉葉綠素含量的下降導致光合生產能力下降,而根系活力的下降則影響了根系的生長和塊根的膨大,進而導致地上部和地下部生物量的下降,干旱脅迫對地上部和地下部生長的抑制最終導致產量的降低,在本試驗條件下,抗旱品種濟薯21在發根分枝期干旱脅迫的減產幅度最大,其次是蔓薯并長期,塊根快速膨大期干旱脅迫減產幅度最小,不抗旱品種濟紫薯1號減產幅度大于抗旱品種濟薯21,說明發根分枝期是甘薯產量對水分反應最敏感的時期,此時期應保證充足的水分供應,才能使甘薯在早期建立合理的群體結構,為獲得高產奠定基礎,而塊根快速膨大期甘薯已具備較高的生物量,大部分塊根已經形成,此時期干旱脅迫對薯干產量影響較小。
3.2 不同時期干旱脅迫對甘薯抗氧化能力的影響
逆境條件下,植物體內活性氧急劇增加,對植物生長造成嚴重的傷害,如抑制酶活性、破壞細胞膜穩定性、阻礙信號傳導等。但是植物體同時也存在著發達的抗氧化酶防御系統,當植物遭受逆境脅迫時,該系統通過抗氧化劑和抗氧化酶協同作用清除植物體內過剩的活性氧,以維持活性氧的平衡。SOD、CAT和POD是抗氧化酶系統的關鍵酶,細胞中多余的超氧陰離子可被SOD清除,H2O2被CAT和POD歧化成水和氧分子,從而保護了SOD活性,在逆境脅迫中三者具有協同作用[33]。抗氧化酶活性高低與作物自身因素有關,逆境脅迫條件下,基因型不同[34-37]、器官不同[38-39]、發育階段不同[40-41],抗氧化酶活性的變化也不同,而針對不同時期干旱脅迫對甘薯抗氧化能力的研究報道較少,汪寶卿等[42-43]研究了抗旱性不同的甘薯品種對干旱脅迫的適應性反應,認為抗旱品種塊根通過抗氧化酶類協同作用抵御逆境,而耐旱性弱的甘薯品種塊根木質化增強,僅能維持基礎性代謝。本文研究了不同時期干旱脅迫對甘薯功能葉、纖維根和塊根抗氧化酶活性的影響,結果表明,功能葉、纖維根和塊根抗氧化酶活性均在脅迫后升高。干旱脅迫時間越早,抗氧化酶活性升高和下降的幅度越大。各生育時期纖維根的抗氧化酶活性均高于塊根和葉片,KIM等[44]研究也認為纖維根抗氧化酶活性高于其他分化根,因此本研究結合前人的研究結果,認為甘薯根系是最先感受土壤干旱脅迫的敏感部位,在各種分化根中,纖維根對干旱脅迫的敏感性最強。逆境脅迫條件下活性氧累積,導致膜飽和度增加,流動性減小,細胞膜透性加大,電解質大量外滲。作為膜脂過氧化作用的主要產物,MDA含量隨著脅迫的加劇呈逐漸升高的趨勢[17-18]。本研究中,干旱脅迫導致甘薯功能葉、纖維根和塊根的MDA含量升高,且脅迫時間越早,升高的幅度越大,對甘薯功能葉、纖維根和塊根的傷害程度越大,MDA含量的高低,反映了細胞膜受傷害的程度,也決定了植物受傷害的程度。
4 結論
不同時期干旱脅迫導致甘薯薯干產量不同程度下降,3個時期干旱脅迫比較,發根分枝期干旱脅迫薯干產量的下降幅度大于蔓薯并長期和塊根快速膨大期。干旱脅迫條件下,功能葉、纖維根和塊根的抗氧化酶系統遭到破壞,細胞膜透性增大,滲透調節物質積累,生理代謝平衡被破壞,抑制了甘薯葉片和根系的正常生長,限制了塊根的形成和膨大,導致塊根產量的下降。早期干旱脅迫導致的抗氧化酶活性的變化無法在復水后得到有效修復;而甘薯進入塊根快速膨大期,地上部和地下部均已具有較高的生物量、且抗氧化能力已具有較高的水平,該時期干旱脅迫對甘薯生長的影響較小。因此,認為干旱脅迫時間越早,對甘薯生長發育的影響越大,發根分枝期是甘薯塊根產量對水分最敏感的時期。
[1] 李長志, 李歡, 劉慶, 史衍璽. 不同生長時期干旱脅迫甘薯根系生長及熒光生理的特性比較. 植物營養與肥料學報, 2016, 22(2): 511-517.
LI C Z, LI H, LIU Q, SHI Y X. Comparison of root development and fluorescent physiological characteristics of sweet potato exposure to drought stress in different growth stages., 2016, 22(2): 511-517. (in Chinese)
[2] 張海燕, 段文學, 解備濤, 董順旭, 汪寶卿, 史春余, 張立明. 不同時期干旱脅迫對甘薯內源激素的影響及其與塊根產量的關系. 作物學報, 2018, 44(1): 126-136.
ZHANG H Y, DUAN W X, XIE B T, DONG S X, WANG B Q, SHI C Y, ZHANG L M. Effects of drought stress at different growth stages on endogenous hormones and its relationship with storage root yield in sweetpotato., 2018, 44(1): 126-136. (in Chinese)
[3] VILLORDON A Q. Characterization of lateral root development at the onset of storage root initiation in ‘Beauregard’ sweetpotato adventitious roots.2012, 47(7): 961-968.
[4] CHOWDHORY S R, SINGH R, KUNDU D K, ANTONY E, THAKUR A K, VERMA H N. Growth, dry matter partitioning and yield of sweet potato (L.) as influence by soil mechanical impedance and mineral nutrition under different irrigation regimes., 2000, 16(1): 25-29.
[5] FANG Y J, XIONG L Z. General mechanisms of drought response and their application in drought resistance improvement in plants., 2015, 72(4): 673-689.
[6] REDDY A R, CHAITANYA K V, VIVEKANANDAN M. Drought- induced responses of photosynthesis and antioxidant metabolism in higher plants., 2004, 161(11): 1189-1202.
[7] KIM Y H, JEONG J C, LEE H S, KWAK S S. Comparative characterization of sweetpotato antioxidant genes from expressed sequence tags of dehydration-treated fibrous roots under different abiotic stress conditions., 2013, 40(4): 2887-2896.
[8] SRIVALLI B, SHARMA G, KHANNA CHOPRA R. Antioxidative defense system in an upland rice cultivar subjected to increasing intensity of water stress followed by recovery., 2003, 119(4): 503-512.
[9] GUO Z F, OU W, LU S L, ZHONG Q. Differential responses of antioxidative system to chilling and drought in four rice cultivars differing in sensitivity., 2006, 44(11/12): 828-836.
[10] LI Z, ZHOU H, PENG Y, ZHANG X, MA X, HUANG L, YAN Y. Exogenously applied spermidine improves drought tolerance in creeping bentgrass associated with changes in antioxidant defense, endogenous polyamines and phytohormones., 2015, 76(1): 71-82.
[11] 陳京. 抗旱性不同的甘薯品種對滲透脅迫的生理響應. 作物學報, 1999, 25(2): 232-236.
CHEN J. Physiological response for different drought resistance of sweet potato under osmotic stress., 1999, 25(2): 232-236. (in Chinese)
[12] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants., 2010, 48(12): 909-930.
[13] 李文卿, 潘廷國, 柯玉琴, 陳鳳翔. 土壤水分脅迫對甘薯苗期活性氧代謝的影響. 福建農業學報, 2000, 15(4): 45-50.
LI W Q, PAN T G, KE Y Q, CHEN F X. Effects of soil water stress on metabolism of active oxygen in leaves of sweet potato seedling., 2000, 15(4): 45-50. (in Chinese)
[14] 何冰, 許鴻原, 陳京. 干旱脅迫對甘薯葉片質膜透性及抗氧化酶類的影響. 廣西農業大學學報, 1997, 16(4): 287-290.
HE B, XU H Y, CHEN J. Effects of drought stress on the permeability of plasma membrane and antioxidation enzymes of the leaves of sweet potato,, 1997, 16(4): 287-290. (in Chinese)
[15] 張明生, 談鋒, 張啟堂. 快速鑒定甘薯品種抗旱性的生理指標及方法的篩選. 中國農業科學, 2001, 34(3): 260-265.
ZHANG M S, TAN F, ZHANG Q T. Physiological indices for rapid identification of sweet potato drought resistance and selection of methods., 2001, 34(3): 260-265. (in Chinese)
[16] 陳京, 王支槐, 周啟貴. PEG處理對甘薯葉肉細胞超微結構的影響. 西南師范大學學報(自然科學版), 1997, 22(4): 398-404.
CHEN J, WANG Z H, ZHOU Q G. Effects of PEG treatment on ultrastructure in mesophyll cells of sweet potato.(), 1997, 22(4): 398-404. (in Chinese)
[17] 李錦樹, 王洪春, 王文英, 朱亞芳. 干旱對玉米葉片細胞透性及膜脂的影響. 植物生理學報, 1983, 9(3): 223-230.
LI J S, WANG H C, WANG W Y, ZHU Y F. Effect of drought on the permeability and membrane lipid composition from maize leaves., 1983, 9(3): 223-230. (in Chinese)
[18] DHINDSA R S, MATOWE W. Drought tolerance in two mosses: correlated with enzymatic defence against lipid peroxidation., 1981, 32(1): 79-91.
[19] 山侖, 康紹忠, 吳普特. 中國節水農業. 北京: 中國農業出版社, 2004: 229-230.
SHAN L, KANG S Z, WU P T.. Beijing: China Agriculture Press, 2004: 229-230. (in Chinese).
[20] 王留梅, 毛守民, 潘明華, 周利霞. 甘薯葉面積系數田間速測方法初探. 中國農學通報, 2001, 17(6): 82, 90.
WANG L M, MAO S M, PAN M H, ZHOU L X. Field measurement method of leaf area index of sweet potato., 2001,17 (6): 82, 90. ( in Chinese).
[21] 李合生. 植物生理生化實驗原理和技術. 北京: 高等教育出版社, 2000: 184-185.
LI H S.. Beijing: Higher Education Press, 2000: 184-185. (in Chinese)
[22] 張丹, 劉國順, 章建新, 徐敏. 打頂時期對烤煙根系活力及煙堿積累規律的影響. 中國煙草科學, 2006, 27(1): 38-41.
ZHANG D, LIU G S, ZHANG J X, XU M. Effect of different topping time on activity of root system and accumulation of nicotine in tobacco plants., 2006, 27(1): 38-41. (in Chinese)
[23] 陳建勛, 王曉峰. 植物生理學實驗指導(第二版). 廣州:華南理工大學出版社, 2006: 64-66.
CHEN J X, WANG X F.(). Guangzhou: South China University of Technology Publishers, 2006: 64-66. (in Chinese)
[24] 馬富舉, 李丹丹, 蔡劍, 姜東, 曹衛星, 戴廷波. 干旱脅迫對小麥幼苗根系生長和葉片光合作用的影響. 應用生態學報, 2012, 23(3): 724-730.
MA F J, LI D D, CAI J, JIANG D, CAO W X, DAI T B. Responses of wheat seedlings root growth and leaf photosynthesis to drought stress., 2012, 23(3): 724-730. (in Chinese)
[25] Pinheiro C, Chaves M M. Photosynthesis and drought: Can we make metabolic connections from available data., 2011, 62: 869-882.
[26] 井大煒, 邢尚軍, 杜振宇, 劉方春. 干旱脅迫對楊樹幼苗生長、光合特性及活性氧代謝的影響. 應用生態學報, 2013, 24(7) : 1809-1816.
JING D W, XING S J, DU Z Y, LIU F C. Effects of drought stress on the growth,photosynthetic characteristics,and active oxygen metabolism of poplar seedlings., 2013, 24 (7): 1809-1816. ( in Chinese)
[27] 張明生, 謝波, 戚金亮, 談鋒, 張啟堂, 楊永華. 甘薯植株形態、生長勢和產量與品種抗旱性的關系. 熱帶作物學報, 2006, 27(1): 39-43.
ZHANG M S, XIE B, QI J L, TAN F, ZHANG Q T, YANG Y H. Relationship of drought resistance of sweet potato with its plant type, growth vigour and yield under water stress., 2006, 27(1): 39-43. (in Chinese)
[28] 談鋒, 張啟堂, 陳京, 李坤培. 甘薯品種抗旱適應性的數量分析. 作物學報, 1991, 17(5): 394-398.
TAN F, ZHANG Q T, CHEN J, LI K P. Quantitative analysis of adaptability of drought resistance in sweet potato cultivars., 1991, 17(5): 394-398. (in Chinese)
[29] 張海燕, 解備濤, 汪寶卿, 董順旭, 段文學, 張立明. 不同甘薯品種抗旱性評價及耐旱指標篩選. 作物學報, 2019, 45(3): 419-430.
ZHANG H Y, XIE B T, WANG B Q, DONG S X, DUAN W X, ZHANG L M. Evaluation of drought tolerance and screening for drought-tolerant indicators in sweetpotato cultivars., 2019, 45(3): 419-430. (in Chinese)
[30] 許育彬, 程雯蔚, 陳越, 華千勇. 不同施肥條件下干旱對甘薯生長發育和光合作用的影響. 西北農業學報, 2007, 16(2): 59-64.
XU Y B, CHENG W W, Chen Y, HUANG Q Y. Effect of drought on growth and development and photosynthesis of sweet potato under different fertilization conditions., 2007, 16(2): 59-64. (in Chinese)
[31] 孫哲, 史春余, 劉桂玲, 高俊杰, 柳洪鵑, 鄭建利, 張鵬. 干旱脅迫與正常供水鉀肥影響甘薯光合特性及塊根產量的差異. 植物營養與肥料學報, 2016, 22(4): 1071-1078.
SUN Z, SHI C Y, LIU G L, GAO J J, LIU H J, ZHENG J L, ZHANG P. Effect difference of potassium fertilizer on leaf photosynthetic characteristics and storage root yield of sweet potato under drought stress and normal water condition., 2016, 22(4): 1071-1078. (in Chinese)
[32] 張海燕, 解備濤, 段文學, 董順旭, 汪寶卿, 張立明, 史春余. 不同時期干旱脅迫對甘薯光合效率和耗水特性的影響. 應用生態學報, 2018, 29(6): 1943-1950.
ZHANG H Y, XIE B T, DUAN W X, DONG S X, WANG B Q, ZHANG L M, SHI C Y. Effects of drought stress at different growth stages on photosynthetic efficiency and water consumption characteristics in sweet potato., 2018, 29(6): 1943-1950. (in Chinese)
[33] 李璇, 岳紅, 王升, 黃璐琦, 馬炯, 郭蘭萍. 影響植物抗氧化酶活性的因素及其研究熱點和現狀. 中國中藥雜志, 2013, 38(7): 973-978.
LI X, YUE H, WANG S, HUANG L Q, MA J, GUO L P. Research of different effects on activity of plant antioxidant enzymes., 2013, 38(7): 973-978. (in Chinese)
[34] NELSON D M, HU F S, TIAN J, STEFANOVA I, BROWN T A. Response of C3and C4plants to middle-holocene climatic variation near the prairie-forest ecotone of Minnesota., 2004, 101(2): 562-567.
[35] UZILDAY B, TURKAN I, SEKMEN A H, OZGUR R, KARAKAYA H C. Comparison of ROS formation and antioxidant enzymes in Cleome gynandra (C4) and Cleome spinosa (C3) under drought stress., 2012, 182: 59-70.
[36] NAYYAR H, GUPTA D. Differential sensitivity of C3and C4plants to water deficit stress: association with oxidative stressand antioxidants., 2006, 58(1): 106-113.
[37] HU L X, LI H Y, PANG H C, FU J. Responses of antioxidant gene,protein and enzymes to salinity stress in two genotypes of perennial ryegrass () differing in salt tolerance., 2012, 169(2): 146-156.
[38] MISRA N, GUPTA A K. Effect of salinity and different nitrogen sources on the activity of antioxidant enzymes and indole alkaloid content inseedlings., 2006, 163(1): 11-18.
[39] JIANG L, YANG H. Prometryne-induced oxidative stress and impact on antioxidant enzymes in wheat., 2009, 72(6): 1687-1693.
[40] ALMESELMANI M, DESHMUKH P S, SAIRAM R K, KUSHWAHA S R, SINGH T P. Protective role of antioxidant enzymes under high temperature stress., 2006, 171(3): 382-388.
[41] OHE M, RAPOLU M, MIEDA T, MIYAGAWA Y. Decline in leaf photooxidative-stress tolerance with age in tobacco., 2005, 168(6): 1487-1493.
[42] 汪寶卿, 姜瑤, 解備濤, 董順旭, 張海燕, 王慶美, 張立明. 2個不同耐旱性甘薯品種的苗期根系蛋白組差異分析. 核農學報, 2017, 31(2): 232-240.
WANG B Q, JIANG Y, XIE B T, DONG S X, ZHANG H Y, WANG Q M, ZHANG L M. Proteomic analysis of roots in seedling stage of two sweetpotato varieties with different drought tolerance., 2017, 31(2): 232-240. (in Chinese)
[43] 汪寶卿, 解備濤, 張海燕, 董順旭, 段文學, 王慶美, 張立明. 基于iTRAQ技術的不同耐旱性甘薯苗期根系差異蛋白分析. 核農學報, 2017, 31(10): 1904-1912.
WANG B Q, XIE B T, ZHANG H Y, DONG S X, DUAN W X, WANG Q M, ZHANG L M. Analysis of differential proteome in roots during seedling stage of sweetpotato with different drought tolerance based on iTRAQ method., 2017, 31(10): 1904-1912. (in Chinese)
[44] KIM Y H, PARK S C, JI C Y, LEE J J, JEONG J C, LEE H S, KWAK S S. Diverse antioxidant enzyme levels in different sweetpotato root types during storage root formation., 2015, 75(1): 155-164.
Effects of Drought Treatments at Different Growth Stages on Growth and the Activity of Antioxidant Enzymes in Sweetpotato
ZHANG HaiYan1, XIE BeiTao1, WANG BaoQing1, DONG ShunXu1, DUAN WenXue1, ZHANG LiMing2
(1Crop Research Institute, Shandong Academy of Agricultural Sciences/Scientific Observation and Experimental Station of Tubers and Root Crops in Huang-Huai-Hai Region, Ministry of Agriculture and Rural Affairs/Shandong Engineering Laboratory of Featured Crops, Jinan 250100;2Shandong Academy of Agricultural Sciences, Jinan 250100)
【Objective】The aim of this study was to investigate the mechanism of yield reduction of sweetpotato ((L.) Lam) caused by drought stress at different growth stages, so as to provide theoretical basis and technical support for production of sweetpotato in dryland areas. 【Method】Field experiments were conducted under a rain exclusion shelter to investigate the effects of drought treatments at different growth stages on growth and the activity of antioxidant enzymes in sweetpotato. Two sweetpotato cultivars (JS 21, a drought-tolerant cultivar, and JZ 1, a drought-sensitive cultivar) were subjected to four drought stress treatments respectively, including WW (well watered during the whole growth period, constructed as a control), DS1 (drought stress during the establishment stage), DS2 (drought stress during the intermediate stage), and DS3 (drought stress during the final stage). 【Result】 Drought stress resulted in significant decrease of dry weight in sweetpotato, and which declined most under the earliest drought stress. Compared with the control, the dry weight of storage roots of DS1, DS2 and DS3 in drought-tolerant cultivar (JS 21) were 32.24%, 30.68% and 13.76%, respectively, while 44.02%, 39.54% and 17.87% in drought-sensitive cultivar (JZ 1), respectively. The activity of antioxidant enzymes of functional leaves, fibrous roots and storage roots increased after drought stress. Similarly, the earlier of the drought stress, the greater influence on the activity of antioxidant enzymes was observed in sweetpotato. The enzyme activity in the fibrous roots in each stage was higher than that in the storage roots and the functional leaves. Our results indicated that the fibrous roots were the most sensitive to drought stress. Drought stress could lead to the increase of the relative electrical conductivity of functional leaves, and the MDA content in functional leaves, fibrous roots and storage roots of sweetpotato. The earlier the application of the drought stress in sweetpotato, the greater the increase of the MDA content was observed. 【Conclusion】The earlier of the drought stress, the greater influence on the activity of antioxidant enzymes was observed in sweetpotato, and could not be renovated. Therefore, the normal growth of leaves and roots were inhibited, and the formation and bulking of storage roots were limited. Establishment stage of sweetpotato was the most sensitive to drought stress.
sweetpotato; drought stress; yield; activity of antioxidant enzymes
2019-08-19;
2019-09-19
國家現代農業產業技術體系建設專項(CARS-10-B08)、山東省薯類產業創新團隊項目(SDAIT-16-09)、山東省農業科學院農業科技創新工程項目(CXGC2016A05)、山東省農業重大應用技術創新項目(SD2019zz022)
張海燕,E-mail:zhang_haiyan02@163.com。解備濤,E-mail:279151695@qq.com。張海燕和解備濤為同等貢獻作者。通信作者段文學,E-mail:duanwenxue2010@163.com。通信作者張立明,E-mail:zhanglm11@sina.com
(責任編輯 楊鑫浩)

