轉(zhuǎn)PnAlaAT3基因可提高低氮條件下楊樹上位葉谷氨酰胺合成酶活力
張國壁 馬靜 左壯
摘要:谷氨酸氨基轉(zhuǎn)移酶又稱谷丙轉(zhuǎn)氨酶,在植物氮同化中起到關(guān)鍵作用。本試驗(yàn)以小黑楊為試材構(gòu)建pROKⅡ-PnAlaAT3植物表達(dá)載體,通過農(nóng)桿菌介導(dǎo)法轉(zhuǎn)化小黑楊,獲得轉(zhuǎn)基因植株,發(fā)現(xiàn)5號(hào)轉(zhuǎn)基因株系葉片中PnAlaAT3基因表達(dá)量升高,但根中表達(dá)量卻顯著降低。對野生型和PnAlaAT3 5號(hào)轉(zhuǎn)基因株系的谷氨酰胺合成酶(GS)和谷氨酰胺-α-酮戊二酸氨基轉(zhuǎn)移酶(GOGAT)活性檢測結(jié)果發(fā)現(xiàn),在低氮條件下,PnAlaAT3轉(zhuǎn)基因株系上位葉GS活LT 較野生型植株有顯著增加。結(jié)果表明,PnAlaAT3基因可以提高小黑楊上位葉中GS活力。
關(guān)鍵詞:谷丙轉(zhuǎn)氨酶基因;楊樹;轉(zhuǎn)基因;氮素同化;谷氨酰胺合成酶活性
中圖分類號(hào): Q785 ?文獻(xiàn)標(biāo)志碼: A ?文章編號(hào):1002-1302(2020)03-0086-04
丙氨酸氨基轉(zhuǎn)移酶又稱谷丙轉(zhuǎn)氨酶(Alanine aminotransferase,AlaAT),在磷酸吡哆醛的存在下,該酶可催化丙氨酸和α-酮戊二酸反應(yīng),生成丙酮酸和谷氨酸[1-2]。在植物中,該酶位于細(xì)胞質(zhì)中,是氮素同化的關(guān)鍵酶[3]。第一個(gè)植物AlaAT基因是Muench等從玉米(Zea mays)中分離得到的[4],之后相繼從擬南芥、大豆、小麥和苜蓿中獲得了多個(gè)編碼AlaAT的基因。以擬南芥為例,Igarashi等共鑒定了4個(gè)AlaAT基因,分別命名為AOAT1~AOAT4[5],而大豆[6]和苜蓿[7]也有同樣的家族成員數(shù)量。從功能上來看,在擬南芥中過表達(dá)外源物種的AlaAT基因可以提高擬南芥的氮素利用效率,而過表達(dá)大麥AlaAT基因的水稻(Oryza sativa)和油菜(Brassica nupas)的產(chǎn)量和生物量都發(fā)生了顯著的提高[8-9]。過表達(dá)大麥AlaAT基因的甘蔗也在低氮條件下表現(xiàn)出了提高氮素利用率的現(xiàn)象[10-11]。
林木AlaAT基因研究相對較晚,2017年,Xu等從楊樹中共克隆得到4個(gè)成員,分別命名為PnAlaAT1、PnAlaAT2、PnAlaAT3、PnAlaAT4,其中PnAlaAT1和PnAlaAT2主要表達(dá)在葉中,并受日節(jié)律的影響,而PnAlaAT3和PnAlaAT4表達(dá)量在根中相對較多,其中PnAlaAT3在根中表達(dá)量最高,并受外源氮素的調(diào)節(jié)而顯著上調(diào)[12]。但該基因在氮素同化中是否起到關(guān)鍵作用尚不清楚。本研究將PnAlaAT3在楊樹體內(nèi)進(jìn)行過表達(dá)的遺傳轉(zhuǎn)化,并對轉(zhuǎn)化株系在不同濃度氮素下的植株生長狀況進(jìn)行研究,從而推斷該基因在楊樹氮素同化中所起的作用。
1 材料與方法
1.1 試驗(yàn)材料
采用小黑楊作為試驗(yàn)材料,取材于東北林業(yè)大學(xué)試驗(yàn)林場。pGEM-T Easy載體和大腸桿菌(Escherichia coli) Trans1-T1感受態(tài)細(xì)胞,購自北京全式金生物技術(shù)有限公司;雙元表達(dá)載體pROKⅡ和根癌農(nóng)桿菌(Agrobacterium tumefaciens)菌株EHA105,由筆者實(shí)驗(yàn)室保存;各種限制性內(nèi)切酶、T4 DNA連接酶、反轉(zhuǎn)錄試劑盒,均購自TAKARA公司;引物合成委托哈爾濱博士生物科技有限公司完成。其他所需試劑均為國產(chǎn)分析純。
1.2 試驗(yàn)方法
1.2.1 載體構(gòu)建 根據(jù)楊樹來源的PnAlaAT3(GenBank登錄號(hào):KT768062)設(shè)計(jì)引物PnAlaAT3-F/R:5′-GCTCTAGACCATGGCTCGTGTTTCTCTTG-3′,5′-TCCCCCGGGTCACTCGCGAAACTCCTCC-3′。下劃線分別為XbaⅠ和SmaⅠ的酶切位點(diǎn)。以重組質(zhì)粒pGEM-T Easy-AlaAT3為模板,用KOD plus高保真酶擴(kuò)增目的片段,擴(kuò)增產(chǎn)生的目的基因條帶為 1 446 bp。采用XbaⅠ和SmaⅠ雙酶切將目的片段連接到雙元表達(dá)載體pROKⅡ中,構(gòu)建植物表達(dá)載體pROKⅡ-AlaAT3(圖1-A)。在構(gòu)建的表達(dá)載體中,AlaAT3上游啟動(dòng)子為組成型強(qiáng)啟動(dòng)子CaMV 35S,終止子為NOS,卡那霉素抗性基因。采用電擊法將重組表達(dá)載體pROKⅡ-PnAlaAT3轉(zhuǎn)入農(nóng)桿菌EHA105中。
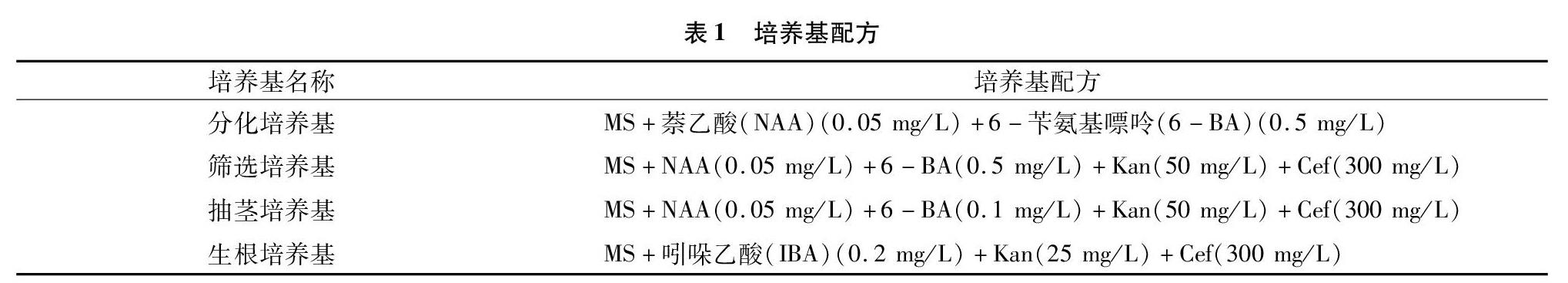
1.2.2 遺傳轉(zhuǎn)化 以小黑楊為受體物種,采用農(nóng)桿菌介導(dǎo)法對其進(jìn)行遺傳轉(zhuǎn)化。選取長勢好的小黑楊無菌苗的葉片切成邊長為1 cm的正方形小塊,在農(nóng)桿菌中侵染20 min后取出葉片,接種在不含抗生素的MS[13](Murashige & Skoog)分化培養(yǎng)基上,于25 ℃條件下黑暗培養(yǎng)2 d。之后將葉片接種到含有50 mg/L卡那霉素(Kan)和300 mg/L頭孢霉素(Cef)的篩選培養(yǎng)基中,在25 ℃、16 h光照/8 h黑暗的條件下培養(yǎng)。待分化的不定芽長到1 cm左右時(shí)將其切下,轉(zhuǎn)移到含有50 mg/L卡那霉素和 300 mg/L 頭孢霉素的抽莖培養(yǎng)基中,待抗性芽長到2 cm時(shí),將其切下并放入含有25 mg/L卡那霉素和300 mg/L頭孢霉素的生根培養(yǎng)基中,繼續(xù)培養(yǎng)抗性植株并生根。詳細(xì)培養(yǎng)基配方見表1。
1.2.3 轉(zhuǎn)基因植株的分子檢測 以轉(zhuǎn)基因小黑楊DNA為模板,用PnAlaAT3基因的特異性引物序列(PnAlaAT3-F,5′-ATGGAAGTCACTGGGTTTGG-3′;PnAlaAT3-R,5′-GAGTAGGCTGCGACAGTAAAAG-3′)進(jìn)行PCR檢測,目的條帶送樣測序。利用實(shí)時(shí)熒光定量PCR方法檢測PnAlaAT3基因在轉(zhuǎn)基因小黑楊中的表達(dá)情況,以PtActin基因?yàn)閮?nèi)參基因。PnAlaAT3定量引物序列:F:5′-GTTCCTGGCTCTGGCTTTGGG-3′;R:5′-ACTCCGTGAGACGGGAGACAACA-3′。
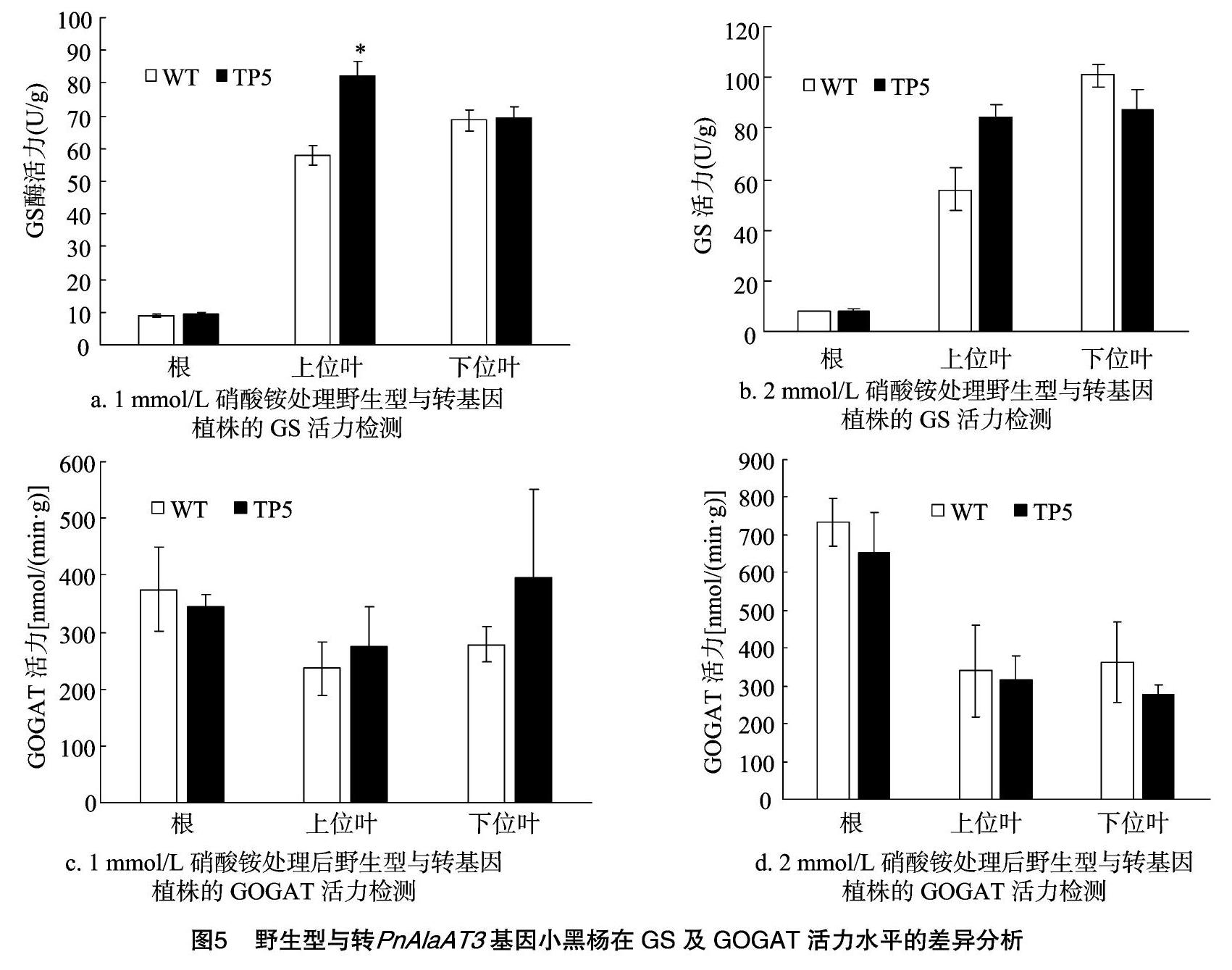
1.2.4 不同氮素處理及指標(biāo)檢測 選取健壯的轉(zhuǎn)化植株和野生型無菌苗,移到滅菌的水培培養(yǎng)液(無蔗糖及瓊脂的MS培養(yǎng)液)中,溫室培養(yǎng)一段時(shí)間后,將所有試驗(yàn)苗分為4組,分別為野生型正常氮組(2 mmol/L NH4NO3)、轉(zhuǎn)基因正常氮組(2 mmol/L NH4NO3)、野生型低氮組(1 mmol/L NH4NO3)和轉(zhuǎn)基因低氮組(1 mmol/L NH4NO3)。用上述配置好的營養(yǎng)液裝入水培裝置,把小黑楊材料轉(zhuǎn)入水培裝置,處理2 d,處理2 d后用吸水紙吸干根部殘留的營養(yǎng)液,收樣,放入-80 ℃保存。其中葉片收樣分為2個(gè)部分:第一部分是從小黑楊第1張完全展開的葉片開始依次向下取3張葉片的混樣;第二部分是最下方3張葉片,分別代表小黑楊的新葉(上位葉)及老葉(下位葉)部分。轉(zhuǎn)氨酶、谷氨酰胺合成酶、谷氨酸合酶等的活性用蘇州科銘生物技術(shù)有限公司的試劑盒進(jìn)行檢測。
1.2.5 數(shù)據(jù)分析 采用SPSS 20.0軟件對轉(zhuǎn)基因株系與對照在表達(dá)水平及表型性狀的差異顯著性進(jìn)行t檢驗(yàn)(P=0.05)。所有樣品為5棵苗的混合樣本,生物學(xué)重復(fù)3次。
2 結(jié)果與分析
2.1 轉(zhuǎn)PnAlaAT3基因的獲得及分子檢測
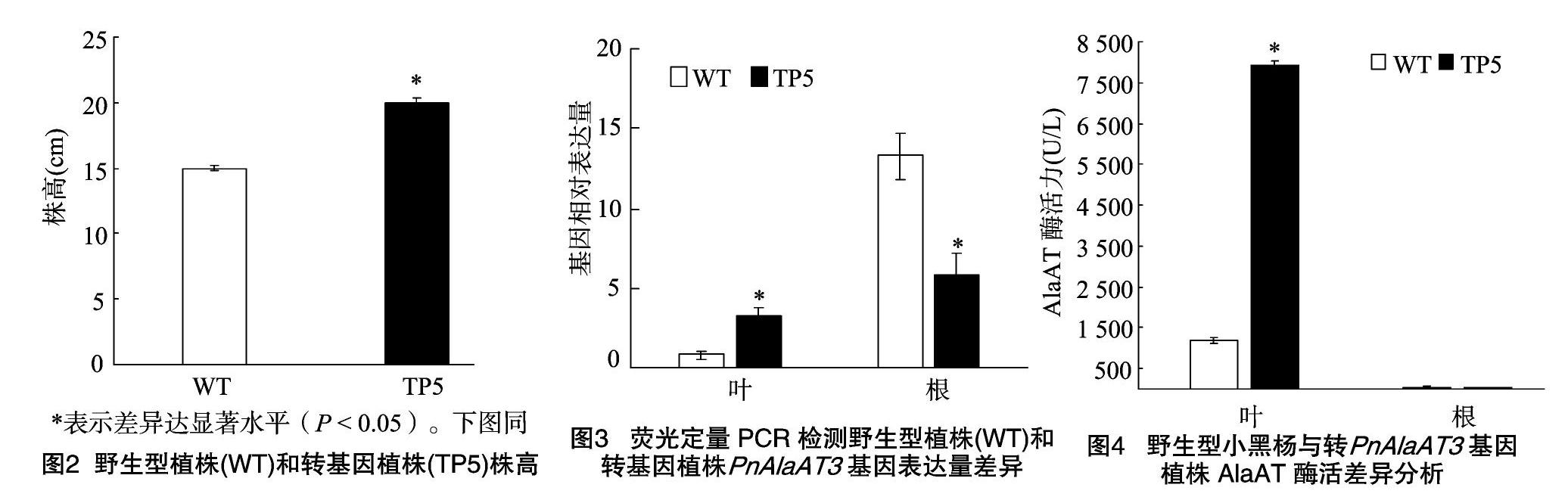
采用農(nóng)桿菌介導(dǎo)法,將PnAlaAT3基因轉(zhuǎn)入小黑楊中,共獲得17棵轉(zhuǎn)化株系,挑選5、6、7號(hào)轉(zhuǎn)化株系(圖1-B中1~3)進(jìn)行DNA及RNA等后續(xù)檢測,以DNA為模板的PCR檢測結(jié)果表明這些條帶的大小約為400 bp(圖1-B),經(jīng)測序確定為 354 bp,擴(kuò)增結(jié)果與預(yù)期相符。這些結(jié)果初步證明PnAlaAT3基因已經(jīng)成功整合到野生型小黑楊的基因組中。將5號(hào)轉(zhuǎn)化株系進(jìn)行無性擴(kuò)繁后檢測株高,結(jié)果如圖 1-C和圖2所示,野生型平均株高為15 cm,轉(zhuǎn)化株系平均株高為20 cm,兩者株高差異顯著(P<0.05)。通過熒光定量PCR方法檢測PnAlaAT3基因在該轉(zhuǎn)化株系根和葉中的表達(dá)量,結(jié)果如圖3所示,在葉片中,轉(zhuǎn)基因小黑楊葉片中的基因表達(dá)量高于非轉(zhuǎn)基因的植株;而在根中,轉(zhuǎn)基因小黑楊中PnAlaAT3基因的表達(dá)量顯著低于野生型植株。由此表明,PnAlaAT3基因不僅成功整合到野生型小黑楊的基因組中,并且在小黑楊不同組織中成功表達(dá)。
2.2 轉(zhuǎn)PnAlaAT3基因植株AlaAT酶活變化
為了確定轉(zhuǎn)PnAlaAT3基因的轉(zhuǎn)化株系在酶活水平的變化情況,對野生型及轉(zhuǎn)化株系地上和地下部分酶活進(jìn)行檢測,結(jié)果如圖4所示,在根中,轉(zhuǎn)基因植株的AlaAT酶活與野生型植株基本一致,但在葉片中轉(zhuǎn)基因植株的AlaAT酶活相對于野生型植株有顯著的提高。
2.3 轉(zhuǎn)PnAlaAT3基因小黑楊對氮同化相關(guān)基因酶活的影響
GS和GOGAT是氮素同化過程中關(guān)鍵的基因,本試驗(yàn)對不同氮素下轉(zhuǎn)PnAlaAT3基因株系的谷氨酰胺合成酶(GS)以及谷氨酰受-α-酮戊二酸氨基轉(zhuǎn)移酶(GOGAT)活力進(jìn)行檢測,結(jié)果如圖5所示,在根中以及下位葉中,GS以及GOGAT活力沒有顯著差異,即使在不同氮素處理的條件下也是如此;在上位葉中,轉(zhuǎn)PnAlaAT3基因的轉(zhuǎn)化株系GOGAT活力沒有顯著區(qū)別,但GS活力在低氮條件下相對于野生型植株有明顯的提高,且差異達(dá)到顯著水平。
3 結(jié)論與討論
在植物中,谷丙轉(zhuǎn)氨酶不僅在逆境條件下發(fā)揮一定的作用,在外界氮素發(fā)生變化時(shí),該酶也同時(shí)起到提高氮素利用的功能[13]。有研究表明,在小麥中氮素利用率的高低與谷丙轉(zhuǎn)氨酶表達(dá)量成正相關(guān)[14-15]。在油菜中組成型表達(dá)大麥的谷丙轉(zhuǎn)氨酶基因,結(jié)果導(dǎo)致在低氮條件下油菜的氮素利用率提高[9,16]。將大麥AlaAT基因轉(zhuǎn)入水稻,并加以水稻的根部特異性啟動(dòng)子,結(jié)果導(dǎo)致轉(zhuǎn)基因水稻分蘗數(shù)明顯增加,根更加稠密[8]。同時(shí),轉(zhuǎn)基因水稻地上
部分的生物量和含氮總量也顯著增加,籽粒產(chǎn)量顯著高于野生型水稻[8]。同時(shí),谷氨酸、谷氨酰胺和天冬氨酸等的含量也發(fā)生相應(yīng)變化[17]。
本研究中將PnAlaAT3基因轉(zhuǎn)入野生型小黑楊,獲得了過表達(dá)株系,在相同生長條件下發(fā)現(xiàn)轉(zhuǎn)基因植株長勢優(yōu)于野生型植株,株高有顯著增加。且轉(zhuǎn)基因植株葉片中的AlaAT酶活高于野生型植株葉片中的AlaAT酶活。在低氮處理下,轉(zhuǎn)化株系的上位葉片中GS活力顯著高于野生型植株,株高也優(yōu)于野生型植株。GS活力升高會(huì)積累更多的谷氨酰胺,以提供給上位葉更多的原材料,從而使轉(zhuǎn)基因植株長勢更好。
參考文獻(xiàn):
[1]Miyashita Y,Dolferus R,Ismond K P,et al. Alanine aminotransferase catalyses the breakdown of alanine after hypoxia in Arabidopsis thaliana[J]. The Plant Journal,2007,49(6):1108-1121.
[2]Yonaha K,Suzuki K,Toyama S. Streptomyces beta-alanine:alpha-ketoglutarate aminotransferase,a novel omega-amino acid transaminase. Purification,crystallization,and enzymologic properties[J]. Journal of Biological Chemistry,1985,260:3265-3268.
[3]黃冰艷,高 偉,苗利娟,等. 谷氨酰胺合成酶基因研究進(jìn)展及其在植物氮代謝調(diào)控中的應(yīng)用[J]. 中國農(nóng)學(xué)通報(bào),2010,26(23):53-57.
[4]Muench D G,Christopher M E,Good A G. Cloning and expression of a hypoxic and nitrogen inducible maize alanine aminotransferase gene[J]. Physiologia Plantarum,1998,103(4):503-512.
[5]Igarashi D,Miwa T,Seki M,et al. Identification of photorespiratory glutamate:glyoxylate aminotransferase (GGAT) gene in Arabidopsis[J]. The Plant Journal,2003,33(6):975-987.
[6]Rocha M,Sodek L,Licausi F,et al. Analysis of alanine aminotransferase in various organs of soybean (Glycine max) and in dependence of different nitrogen fertilisers during hypoxic stress[J]. Amino Acids,2010,39(4):1043-1053.
[7]Ricoult C,Echeverria L O,Cliquet J B,et al. Characterization of alanine aminotransferase (AlaAT) multigene family and hypoxic response in young seedlings of the model legume Medicago truncatula[J]. Journal of Experimental Botany,2006,57(12):3079-3089.
[8]Shrawat A K,Carroll R T,DePauw M,et al. Genetic engineering of improved nitrogen use efficiency in rice by the tissue-specific expression of alanine aminotransferase[J]. Plant Biotechnology Journal,2008,6(7):722-732.
[9]Good A G,Johnson S J,De Pauw M,et al. Engineering nitrogen use efficiency with alanine aminotransferase[J]. Revue Canadienne De Botanique,2007,85:252-262.
[10]Snyman S J,Hajari E,Watt M P,et al. Improved nitrogen use efficiency in transgenic sugarcane:phenotypic assessment in a pot trial under low nitrogen conditions[J]. Plant Cell Reports,2015,34(5):667-669.
[11]徐紅衛(wèi),郭桂梅,黃賽華, 等. 兩份大麥純合突變體氮代謝相關(guān)基因于不同生長發(fā)育時(shí)期的表達(dá)[J]. 植物生理學(xué)報(bào),2017,53(11):2031-2036.
[12]Xu Z,Jing M,Qu C,et al. Identification and expression analyses of the alanine aminotransferase(AlaAT) gene family in poplar seedlings[J]. Scientific Reports,2017,7:45933.
[13]Enosawa S,Dozen M,Tada Y,et al. Electron therapy attenuated elevated alanine aminotransferase and oxidative stress values in type 2 diabetes-induced nonalcoholic steatohepatitis of rats[J]. Cell Medicine,2013,6(1/2):63-73.
[14]Tian H,F(xiàn)u J,Drijber RA,et al. Expression patterns of five genes involved in nitrogen metabolism in two winter wheat(Triticum aestivum L.) genotypes with high and low nitrogen utilization efficiencies[J]. Journal of Cereal Science,2015,61:48-54.
[15]董召娣,易 媛,張明偉,等. 春性和半冬性小麥花后旗葉和籽粒氮代謝關(guān)鍵酶活性的差異[J]. 麥類作物學(xué)報(bào),2015,35(8):1098-1106.
[16]Mauchline T H,F(xiàn)owler J E,East A K,et al. Mapping the Sinorhizobium meliloti 1021 solute-binding protein-dependent transportome[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(47):17933-17938.
[17]Kan C C,Chung T Y,Juo Y A,et al. Glutamine rapidly induces the expression of key transcription factor genes involved in nitrogen and stress responses in rice roots[J]. BMC Genomics,2015,16(1):731.

