天然產物Rubradirin的合成研究進展
楊丹丹 韓珂 魏洋 鄭紹軍 高玉華


摘 ?????要:創制新藥的途徑很多,天然產物模型仍然是最主要的途徑之一,但是提取活性天然產物不僅操作困難、步驟繁瑣,而且含量特別低,難于工業化生產。因此,通過化學合成方法得到具有生物活性的天然產物及其類似物,是一種更綠色、更高效的方式。Rubradirin 是一種對金黃色葡萄球菌具有顯著的抑制活性(MIC = 125 nM)的天然產物,有望開發成新藥。綜述了天然產物 Rubradirin 的研究進展,重點對關鍵中間體 ABCD 環的合成方法進行了綜述,并對今后研究的重點提出了建議。
關 ?鍵 ?詞:Rubradirin; 天然產物; 全合成;?多環骨架
中圖分類號:TQ 041+.8 ??????文獻標識碼: A ??????文章編號: 1671-0460(2020)03-0660-05
Research Progress in Synthesis of Natural Product Rubradirin
YANG?Dan-dan, HAN?Ke, WEI?Yang, ZHENG?Shao-jun,?GAO?Yu-hua*
(Jiangsu University of Science and Technology, Jiangsu?Zhenjiang?212003, China)
Abstract:?There are many ways to develop new drugs, and the?model of natural?product is still one of?the main strategies. However, the extracting method of active natural products is not only difficult to operate, but also has tedious steps. Whats more, it is?difficult to industrialize?due to low content. Therefore, organic synthesis?is a more environmentally friendly and efficient alternative way?to provide bioactive natural products and their analogues. Rubradirin is a natural product with significant inhibitory activity against staphylococcus aureus (MIC = 125 nM). In this paper, the recent research progress of natural product Rubradirin was?summarized, including the construction of the ABCD rings. Finally, suggestions for future research?were given.
Key words: ?Rubradirin; ?natural product; ?total synthesis; ?macrocycle
具有生物活性的天然產物是藥物研發的重要源泉,眾所周知,已經被臨床使用的藥物有很大一部分來源于自然界,如常用的青霉素、紅霉素、小檗堿、利血平和麻黃堿等。20世紀80年代至21世紀初期,全球已獲得批準的新藥已經達到1 355種,其中63%來源于天然產物及其衍生物[1]。
近年來關于天然產物的研究如火如荼,面臨的問題也同樣突出。一方面,許多含有高活性有效成分的天然產物在自然界中分布有限,而且含量也非常低,提取過程繁瑣、低效,無法滿足人類對藥物的大量需求[2]。
另一方面,隨著抗菌藥物的廣泛應用,在殺滅細菌的同時也帶來細菌耐藥性的問題,比如由于抗生素的濫用[3]導致超級細菌耐藥金黃色葡萄球菌(MRSA)的產生[4-7]。因此,以有效成分的特殊結構為基礎,通過化學合成的方法,尋找、創制新的高效抗菌藥物迫在眉睫。
1 ?Rubradirin研究進展綜述
Rubradirin是從Streptomyces achromogenes var. rubradiris發酵液中分離出來一種安莎霉素抗生素[8]。根據眾多報道中對于 Rubridirin 的抗菌活性測定可知,Rubradirin 對多種革蘭氏陽性細菌表現出高效的抑菌作用,尤其是對金黃色葡萄球菌菌株表現出顯著的抑制活性[9-13]。Rubradirin 的多功能性取決于其四個特殊結構片段,分別是: Rubransarol、AMC(3-amino-4-hydroxyl-7- methoxy coumarin)、DHDP (3, 4-dihydroxydipicolina te)和D-rubranitrose,這是該化合物的標志性特征[14-16](圖1)。Rubradirin的抑菌功效是通過選擇性干預微生物蛋白質合成過程中翻譯鏈起始從而抑制核糖體的功能來實現的[17-20]。Rubradirin本身能抑制核糖體功能,不影響 RNA 聚合酶的功能。Rubransarol 對細菌RNA聚合酶或核糖體功能都沒有抑制作用,AMC和DHDP 則表現出對RNA合成的中等程度的抑制活性[21,22]。另外,科學家還從該發酵液中還分離出了Rubradirin aglycon、Rubradirin B和Rubradirin C。Rubradirin aglycon 抑菌活性一般,但是對細菌 RNA 聚合酶表現出較好的抑制作用,比如對 HIV 逆轉錄酶和 RNAP 有很高的抑制活性,可作為人類免疫缺陷病毒(HIV)逆轉錄酶的有效抑制劑[10,23]。因此,Rubradirin 類化合物具有被開發成為抗生素的潛力。
2 ?Rubradirin的合成研究進展
2.1 ?Rubradirin的合成研究
1965年,科學家們首次從Streptomyces achromogenes var. rubradiris發酵液中成功分離出活性抑菌成分?Rubradirin,但發酵液中該類活性抑菌成分含量比較低,且化學結構復雜[24-26]。因此,Rubradirin 的開發利用大大受限。研究人員將研究焦點放在了 Rubradirin 的化學合成上,利用一系列化學反應進行全合成,希望獲得天然產物 Rubradirin 及其類似物。
從1980年開始,Kozikowski等[27-31]展開了 Rubradirin中間體的合成研究,兩年間嘗試了多種合成 Rubradirin中間體的方法。比如,在堿性條件先構建C環,通過 Diels-Alder反應得到A環,成功得到了ABC三環骨架關鍵中間體5和6(見圖2)。
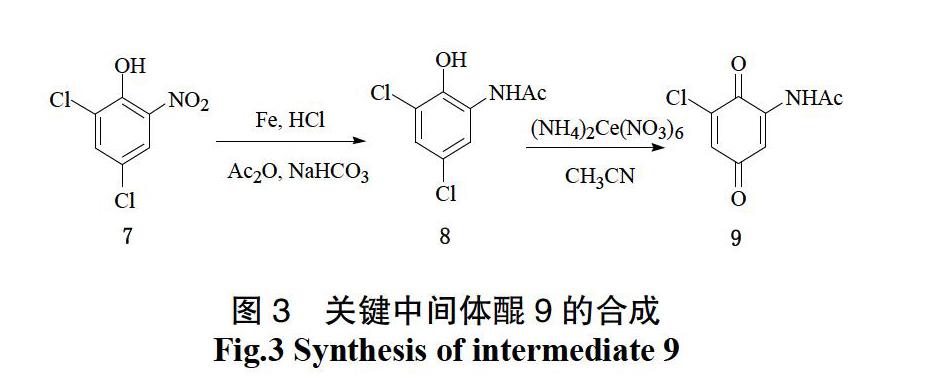
1983年,Kelly[32]等通過對Rubradirin新穎的骨架結構進行了研究分析,得到了中間體醌9,這為合成Rubradirin 構建B環提供了重要的中間體(見圖3)。
1987年,Kozikowski等[33]利用Diels-Alder 反應作為關鍵步驟合成A環,從而得到中間體11。值得注意的是,Kozikowski在之前的研究基礎上,創新性地嘗試先完成骨架大環 D 環的關閉,再通過多步反應,最后得到關環產物中間體14(見圖4)。
1995年,Roush等[34]首先通過 Diels-Alder 反應成功構建了A環和B環,然后在n-BuLi 的作用下,與醛反應得到中間體22(見圖5)。
2012年,Kuttruff等[35]通過方法學研究,對Rubradirin的苯并醌的骨架合成進行了一系列條件篩選與優化,以較高產率得到關鍵步驟中間體27,最終通過Diels-Alder反應成功構建A環和B環,完成了重要中間體31和32的合成,為Rubradirin 的全合成提供了重要的合成思路(見圖6)。
2016年,賀耘等[36]受Kuttruff 小組啟發,利用Diels-Alder 反應,成功構建了苯并醌骨架(A環和B環),再通過還原胺化及 Michael 加成反應形成C環,之后嘗試了利用GrubbsⅡ催化烯烴復分解反應完成分子骨架大環(D 環)的閉環。雖然未能得到預期目標產物46,但是成功獲得了多個關鍵中間體36、40和47等。
這為Rubradirin的全合成,提供了重要的參考素材和眾多中間體的合成方法,為今后的研究打下堅實的基礎(見圖7)。
同時,作者設計并探索了將 Mitsunobu 反應應用到 RubradirinD環的關閉,最后再實現C環的關閉。并且在此基礎上以較好收率合成了一系列類似衍生物(化合物48-54),對以后的化學工作者完成天然產物Rubradirin 的全合成有著十分重要的參考價值(見圖8)。
2.2 ?結論
(1)Rubradirin 對有抗藥性的金黃色葡萄球菌具有十分出色的抑制活性(125 nM),有望被開發成新型抗生素。
(2)Rubradirin 結構復雜,目前為止,未見到 Rubradirin 的全合成的相關報道,但是已經涌現了大量對其中間體合成的報道,比如中間體5、6、9、14、22、31、32和47等,這為完成 Rubradirin 的全合成奠定了基礎。
(3)大部分課題組設計的合成路線都以 Diels-Alder 反應為關鍵步驟,得到ABC環,但是未完成D環的閉環。賀耘課題組探索將 Mitsunobu 反應應用到Rubradirin D環的閉環,最后再實現C環的閉環,得到一系列衍生物48-54,對Rubradirin 的全合成具有十分重要的參考價值。
3 ?展 望
Rubradirin 對金黃色葡萄球菌具有顯著的抑制活性,目前金黃色葡萄球菌對大多數抗生素產生抗藥性,并且產生超級細菌,所以化學工作者已經對 Rubradirin 的高效抑菌活性產生興趣,并紛紛展開了對 Rubradirin 的合成研究。目前為止,雖然未見 Rubradirin 的全合成的相關報道,但是已經出現大量對其中間體合成的報道,這為完成 Rubradirin 的全合成奠定了基礎。天然產物 Rubradirin 能為新型抗生素的開發提供重要的有效成分結構骨架和抗菌作用機制,然后構建先導化合物庫篩選高效的臨床藥物。最終,克服日益嚴峻的病菌耐藥性問題,為人類健康做出貢獻。
參考文獻:
[1]Newman D J, Cragg G M. Natural Products as Sources of New Drugs over the Last 25 Years[J]. Journal of Natural Products, 2007, 70: 461-477.
[2]涂永強.天然產物全合成領域研究態勢分析[J].科學觀察,2012, 7: 59-63.
[3]肖明月,崔爽,李萍.土壤環境中抗生素污染界面過程的研究進展[J].當代化工, 2014, 43(10): 2039-2041.
[4]Anthony A A, Adekunle C F, Gulshan S,?et al. Antibiotic Resistant Superbugs: Assessment of the Interrelationship of Occurrence in Clinical Settings and Environmental Niches[J]. Molecules,2016, 22(1):29.
[5] Argudin M A, Mendoza M C, Rodicio M R. Food poisoning and Staphylococcus aureus enterotoxins[J]. Toxins,2010,2(7): 1751-1773.
[6]Reusser F, Zurenko G E, Coats J H. Rubradirin treatment of methicillin-resistant staphylococcal infections:US,4749568A[P]. 1988.
[7]Vitale M, Scatassa M L, Cardamone C, et al. Staphylococcus food poisoning case and molecular analysis of toxin genes in Staphylococcus aureus strains isolated from food in Sicily, Italy[J]. Food-borne Pathog Dis,?2015, 12(1): 21-23.
[8]Kim C G, Lamichhane J, Song K I, et al. Biosynthesis of rubradirin as an ansamycin antibiotic from Streptomyces achromogenes var. rubradiris NRRL3061[J]. Archives of Microbiology, 2008,?189: 463-473.
[9]Bhuyan B K, Owen S P, Dietz A. Rubradirin, a new antibiotic. I. Fermentation and biological properties[J].Antimicrobi Agents Chemother,1964, 10: 91-96.
[10]Reusser F, Bannister B, Tarpley W G, et al. Rubradirin derivatives for treatment of HIV infection: WO,8808707A2[P]. 1988.
[11]Hoeksema H. Degradation of rubradirin and its B form: FR, 2409999A1[P]. 1979.
[12]Hoeksema H, Reusser F, Wait D R.Antibiotic rubradirin B DE2810264A1[P]. 1978.
[13]Hoeksema H. Decomposition products of antibiotics rubradirin and rubradirin: BDE,2816052A1[P]. 1978.
[14]Johnson L E, Smith R M, Meyer C E, et al.Rubradirin antibiotic: DE,1220558[P]. 1966.
[15]Marshall V P, McWethy S J, Sirotti J M, et al. The effect of neutral resins on the fermentation production of rubradirin[J]. Journal of Industrial Microbiology & Biotechnology, 1990, 5: 283-287.
[16]Hoeksema H, Mizsak S A, Baczynskyj L, et al. Structure of rubradirin [J]. Journal of the American Chemical Societ, 1982, 104: 5173-5181.
[17]Maharjan J, Liou K, Lee H C, et al. Functional identification of rub52 gene involved in the biosynthesis of rubradirin[J]. Biotechnology Letters, 2003, 25: 909-915.
[18]Reusser F. Rubradirin, an inhibitor of ribosomal polypeptide biosynthesis[J]. Biochemistry, 1973, 12: 1136–1142.
[19]Hoeksema H, Chidester C, Mizsak S A, et al. The chemistry of the rubradirins. I. The structures of rubransarols A and B [J].Journal of Antibiotics?(Tokyo), 1978, 31: 1067-1069.
[20]Lamichhane J, Liou K, Lee H C, et al. Functional characterization of ketoreductase (rubN6) and aminotransferase (rubN4) genes in the gene cluster of Streptomyces achromogenes var. rubradiris[J]. Biotechnology Letters, 2006, 28: 545-553.
[21]Reusser F. Inhibition of ribosomal and RNA polymerase functions by rubradirin and its aglycone[J]. Journal of Antibiotics, 1979, 32: 1186-1192.
[22]Lamichhane J, Oh T J, Lee H C, et al. Mediation of rubradirin resistance by ABC transporters (RubT1) from Streptomyces achromogenes var. rubradiris NRRL3061[J]. Journal of Microbiology and Biotechnology, 2006,?16: 1928-1934.
[23]Russer F, Bannister B, Tarpley W G, et al. Rubradirin derivatives for treatment of HIV infection Patent Cooperation Treaty: W08808707[P]. 1988.
[24]Boll B, Heide L A. Domain of RubC1 of Rubradirin Biosynthesis Can Functionally Replace MbtH-Like Proteins in Tyrosine Adenylation[J]. ChemBioChem, 2013,?14: 43-44.
[25]Bannister B Z, apotocky B A. Protorubradirin, an antibiotic containing a C-nitroso-sugar fragment, is the true secondary metabolite produced by Streptomyces achromogenes var. rubradiris. Rubradirin, described earlier, is its photo-oxidation product[J]. Journal of Antibiotics, 1992, 45: 1313-1324.
[26]Bannister B, Cialdella J I, Dolak L A, et al. Increased rubradirin yields:WO,9004034A1[P]. 1990.
[27]Kozikowski A P, Sugiyama K, Springer J P. Studies directed toward the total synthesis of the rubradirin antibiotics.2. Synthesis of the unique morpholinonaphthoquinone chromophore: a lesson in Diels-Alder regiocontrol by diene substituent selection[J]. Journal of Organic Chemistry, 1981, 46: 2426-2428.
[28]Kozikowski A P, Sugiyama K, Springer J P. An approach to the construction of the aromatic portions of naphthomycin and the rubradirins. Nucleophilic additions to unsymmetrically substituted naphthoquinones[J]. Tetrahedron Letters, 1980, 21: 3257-3260.
[29]Kozikowski A P, Sugiyama K. Studies directed toward the total synthesis of the rubradirin antibiotics. 3. Diels-Alder reactions of unsymmetrically substituted quinones. A confirmation of structure[J]. Tetrahedron Letters, 1980, 21: 4597-4600.
[30]Kozikowski A P, Sugiyama K Huie E. Studies directed toward the total synthesis of the rubradirin antibiotics. 4. A new Diels-Alder-Claisen effective diene[J]. Tetrahedron Letters, 1981, 22: 3381-3384.
[31]Kozikowski A P, Kitigawa Y. Studies directed toward the total synthesis of the rubradirin antibiotics. 5. A convenient preparation of functionalized isoprene units for the Diels-Alder reaction[J]. Tetrahedron Letters, 1982, 23: 2087-2090.
[32]Kelly T R, Echavarren A, Behforouz M. Synthesis of 6-bromo- and 6-chloro-2-acetamidobenzoquinone. A structure revision[J].The Journal of Organic Chemistry?,1983, 48: 3849-3851.
[33]Kozikowski A P, Xia Y. Synthetic studies of the rubradirins. A strategy for the incorporation of the ansa bridge[J]. Journal of Organic Chemistry, 1987,?52: 1375-1378.
[34]Roush W R, Coffey D S. Synthesis of the Naphthoquinone Nucleus of Awamycin[J]. The Journal of Organic Chemistry, 1995, 60: 4412-4418.
[35]Kuttruff C A, Geiger S, Cakmak M, et al. An Approach to Aminonaphthoquinone Ansamycins Using a Modified Danishefsky Diene[J]. Organic Letters, 2012, 14: 1070-1073.
[36]Reddy R S, Zheng S J, Lagishetti C, et al.practical and efficient route to heteraphanes: synthesis of structurally simplified analogues of ansamycins[J]. RSC Advances, 2016, 6: 68199-68203.
![]()

