TOME環化反應熱力學分析及反應動力學研究
劉宏曉,孫偉振,趙玲,2
(1 華東理工大學化學工程聯合國家重點實驗室,上海200237; 2 新疆大學化學化工學院,新疆烏魯木齊830046)
引 言
吡羅克酮乙醇胺鹽是一種新型的去屑止癢劑,同時具有良好的溶解性和熱穩定性以及低毒性和低刺激性,市場應用前景廣闊[1]。4-甲基-6-(2,4,4-三甲基戊基)-2-吡喃酮(MTP)是吡羅克酮乙醇胺鹽合成過程的中間體,它的吡喃酮環結構可以與羥胺反應生成具有吡啶酮環結構的吡羅克酮,后者再與乙醇胺在溶劑中成鹽析出得到吡羅克酮乙醇胺鹽[2-3]。其中,MTP 的合成反應是制備吡羅克酮乙醇胺鹽的關鍵反應步驟。MTP 的合成以3,7,9,9-四甲基-5-酮-2-癸烯酸甲酯(TOME)為原料,目前國內外對該反應的研究較少。Horace等[4-5]先將TOME水解得到相應的酸,再以濃硫酸為催化劑,在醋酸溶劑中誘導其環化得到MTP。Pittet等[6]采用高溫加熱反應物TOME 的方式使其發生環化反應,只需一步反應即可得到產物。
熱力學分析是判斷反應系統進行的可能性和進行程度的重要依據,并且可以為操作條件確定、反應裝置設計和催化劑選擇提供重要的借鑒和指導作用[7-10]。并且,反應動力學對反應過程的優化、放大以及工業反應器的設計都具有重要意義[11-15]。然而,目前缺少關于該反應體系熱力學分析的公開報道,有關反應物TOME 和產物MTP 的熱力學數據也相當匱乏。同時,也鮮有關于該過程的反應動力學方面的研究報道。
本文利用基于物質分子結構的基團貢獻法,對TOME 環化反應體系進行了熱力學數據估算,計算了溫度對焓變、熵變、Gibbs 自由能和反應平衡常數的影響。在此基礎上采用間歇實驗裝置,研究了反應溫度463~493 K 范圍內TOME 進行直接環化反應的反應動力學規律。本文相關研究結果可以為TOME環化制備MTP反應的優化和工業應用提供參考依據。
1 反應體系熱力學計算
TOME環化反應方程式如式(1)所示。
該反應體系中,副產物甲醇(methanol)的基礎熱力學數據可以直接從物性手冊[16-19]中獲得。而反應物TOME和目標產物MTP的熱力學數據未見公開報道。本文采用基團貢獻法進行熱力學數據的估算。
1.1 理想氣體標準摩爾生成焓、標準摩爾熵和摩爾等壓熱容
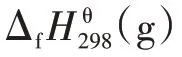
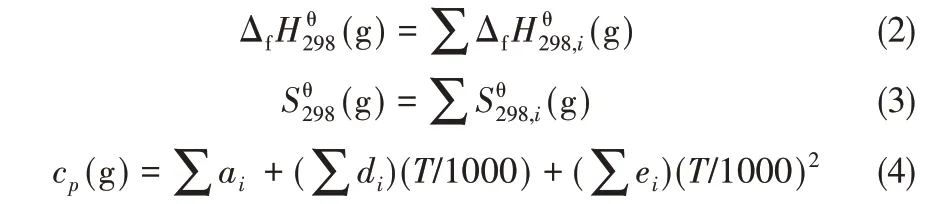
采用Yoneda 基團貢獻法得到的各組分熱力學基團貢獻值如表1 所示。表1 中的A 代表被取代的碳原子型號,B 代表與A 相連的最高型號碳原子。表1中的數字所代表的碳原子類型如表2所示。
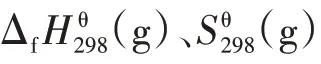
1.2 不同溫度下汽化潛熱的計算
由于本反應體系為液相反應,所以通過Yoneda基團貢獻法得到各組分氣體標準摩爾生成焓、標準摩爾熵和值壓摩爾熱容之后,還需要知道不同溫度下各組分的汽化潛熱ΔvHT,才能計算各組分的液態標準摩爾生成焓和標準摩爾熵。不同溫度下的汽化潛熱選擇Watson 經驗公式[26]計算。計算式如式(5)所示。
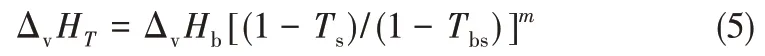
式中,ΔvHb為常壓沸點下的蒸發焓;Ts為對比溫度,Ts=T/Tc;Tbs=Tb/Tc;m取0.38[27]。ΔvHb采用Ma 等[28]提出的基團貢獻法計算,臨界溫度Tc采用Joback 基團貢獻法[29]計算,常壓沸點Tb采用Stein 等[30]改進的Joback基團貢獻法計算。計算式如式(6)~式(8)所示。各基團的貢獻值見表4,各組分的ΔvHb、Tb、Tc和ΔvHT的計算結果見表5。
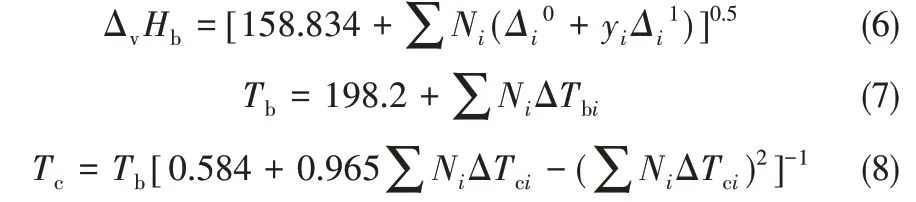
將上述通過基團貢獻法計算得到的甲醇的各項熱力學數據與文獻值進行對比,對比結果見表6。可以看出,采用基團貢獻法得到的計算值與文獻值的最小相對偏差為0.03%,最大相對偏差為3.78%,說明采用上述方法得到的基礎熱力學數據是可靠的,可以用于下文的熱力學計算及分析。

表1 各組分的熱力學基團貢獻值(Yoneda法)[24-25]Table 1 Thermodynamic data of group contribution of each component(Yoneda method)[24-25]
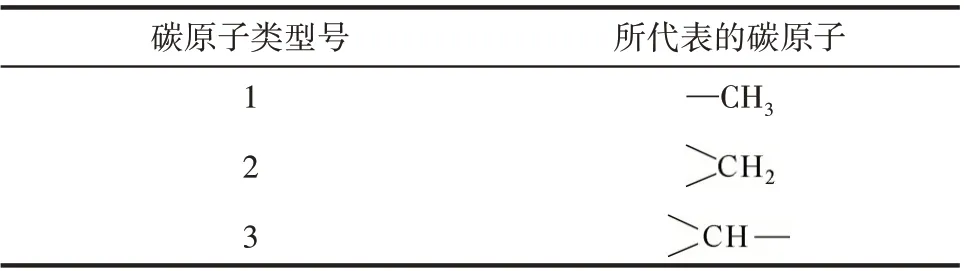
表2 不同碳原子的類型號(Yoneda法)Table 2 Type number of different carbon atoms(Yoneda method)
1.3 液態標準摩爾生成焓和標準摩爾熵
在計算得到了氣態標準摩爾生成焓和標準摩爾熵以及不同溫度下汽化潛熱后,通過熱力學基本公式計算液態標準摩爾生成焓和標準摩爾熵,所用公式如式(9)和式(10)所示。

式中,cp采用表3中關于溫度T的多項式。
1.4 不同溫度下的標準反應焓變、反應熵變、Gibbs自由能變和平衡常數
通過以上計算得到了各物質的ΔfHθT和SθT,再利用熱力學基本公式便可以求得該反應在不同溫度下的標準反應焓變、反應熵變、反應Gibbs 自由能變和反應平衡常數。所用熱力學基本公式如式(11)~式(14)所示。
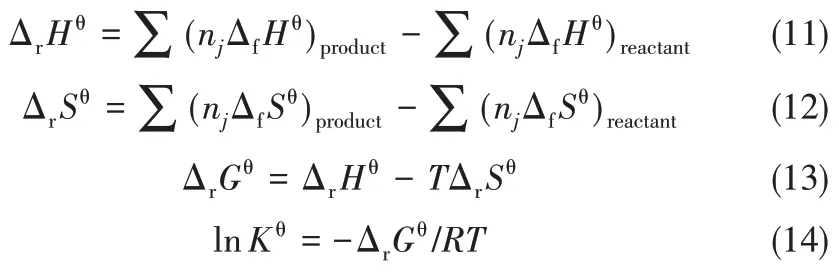
2 實驗部分
2.1 實驗試劑
3,7,9,9-四甲基-5-酮-2-癸烯酸甲酯(TOME),分析純,百靈威科技有限公司;4-甲基-6-(2,4,4-三甲基戊基)-2-吡喃酮(MTP),分析純,百靈威科技有限公司;HPLC 分析用試劑:乙腈,色譜純,阿拉丁試劑有限公司;超純水,自制。
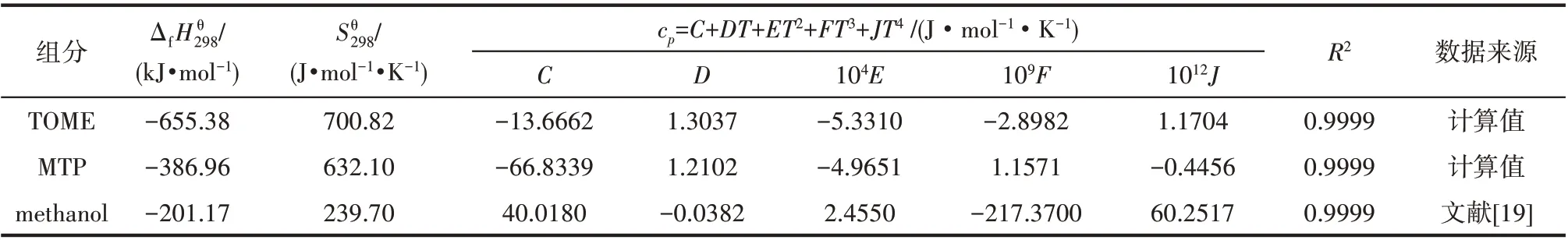
表3 各組分的熱力學數據Table 3 Thermodynamic data for each component
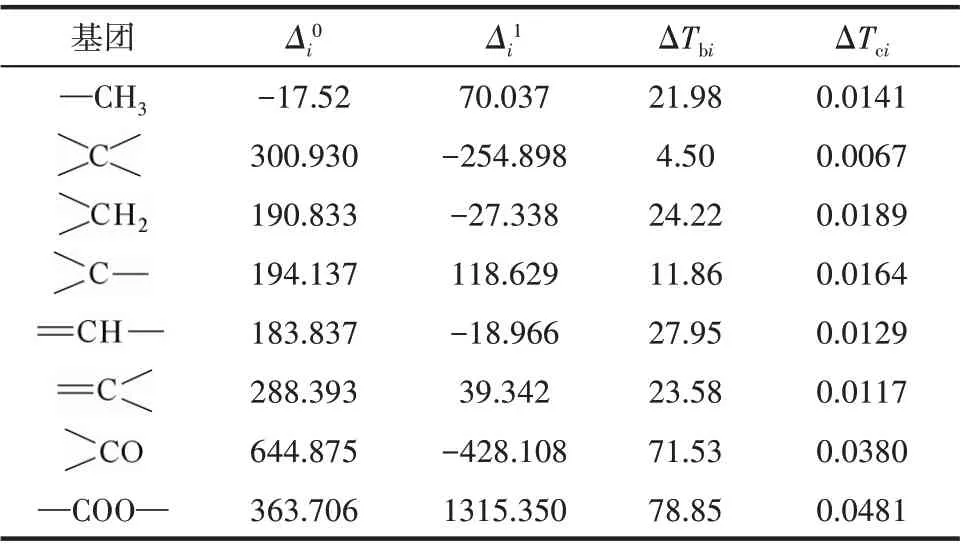
表4 Δi0、Δi1、ΔTbi和ΔTci的基團貢獻值Table 4 Group contributions of Δi0,Δi1,ΔTbi and ΔTci
2.2 實驗儀器與實驗過程
實驗所用儀器如圖1 所示。首先,向三口燒瓶內加入一定量的反應物TOME,開啟機械攪拌,開啟油浴加熱,冷凝器通冷卻水。實驗過程中產生的副產物甲醇經過冷凝后采出,加速反應正向進行。當燒瓶內反應體系達到反應溫度后開始計時,并每隔一定時間用一次性吸管取2~3 ml 樣品進行液相色譜分析。
圖1 環化反應裝置Fig.1 Experimental setup of cyclization reaction
2.3 分析方法
TOME 環化反應實驗的分析采用液相色譜,外標法定量。所用儀器為Waters 公司的HPLC 系統,由自動進樣器(Waters 2707)、兩元梯度泵(Waters 1525)、紫外檢測器(Waters 2487)以及恒溫箱組成。采用的色譜條件為:色譜柱為C18反相柱(φ4.6 mm×250 mm),流動相乙腈∶水體積比為70∶30,流速為1 ml·min-1,柱溫為35℃,進樣量為10 μl,檢測波長為305 nm。
3 結果分析與討論
3.1 溫度對熱力學參數的影響
通過對反應體系熱力學數據的計算,可以得到不同溫度下環化反應的標準反應焓變、熵變、Gibbs自由能變和平衡常數,結果匯總如表7 所示。可以看出,在所計算溫度343~503 K 范圍內,反應的標準焓變均大于零,說明該反應為吸熱反應,從熱力學角度可知,升高溫度有利于反應向正方向進行。隨著反應溫度的升高,標準反應焓變呈減小趨勢,說明隨著反應溫度的升高,反應的吸熱量減小。在343~393 K 范圍內大于零,說明在此溫度范圍內反應為非自發過程;在高于403 K 范圍內反應的標準Gibbs 自由能變小于零,說明溫度高于403 K,反應為自發過程。隨著反應溫度的升高,反應Gibbs 自由能呈減小趨勢,說明升溫有利于反應正向進行。反應的平衡常數隨溫度的升高呈增大趨勢,說明反應的平衡轉化率隨溫度的升高而增大。
為了進一步驗證熱力學分析的可靠性,將一定量的TOME 置于封閉反應體系中進行環化反應,反應時間設定12 h,之后迅速取樣,并將樣品置于冰水混合物中迅速冷卻終止反應,分析樣品中各物質的濃度,從而計算一定溫度下該反應達到平衡時的實驗平衡常數。實驗平衡常數的計算公式如式(15)所示。
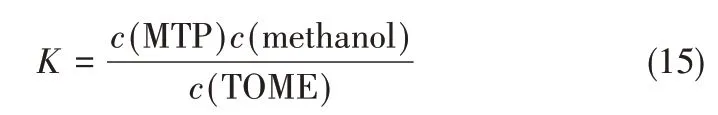
實驗平衡常數與熱力學計算得到的理論平衡常數見表8。可以看出,理論平衡常數與實驗平衡常數比較接近,進一步證明上述采用的基團貢獻法進行的熱力學分析是可靠的。
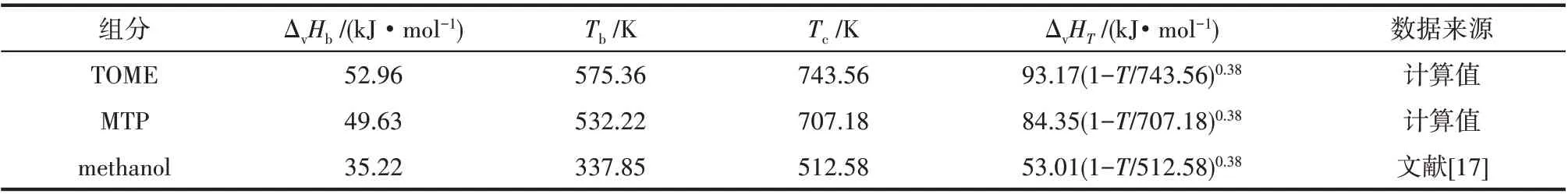
表5 各組分的ΔvHb、Tb、Tc和ΔvHT值Table 5 ΔvHb,Tb,Tc and ΔvHT of each component

表6 甲醇熱力學數據的計算值與文獻值對比Table 6 Comparison of calculation data and document data of methanol
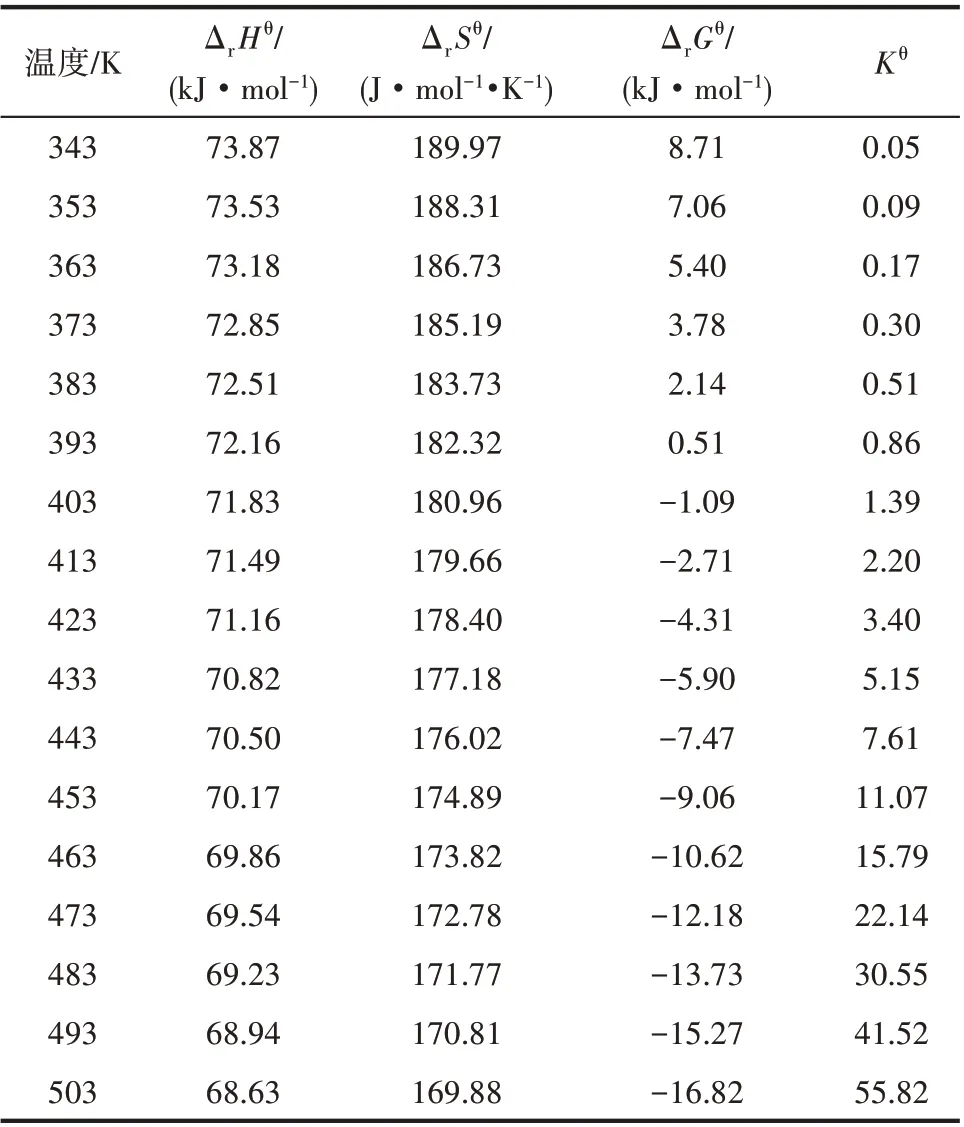
表7 不同溫度下反應的ΔrHθ、ΔrSθ、ΔrGθ和KθTable 7 ΔrHθ,ΔrSθ,ΔrGθ and Kθ of reaction at different temperature
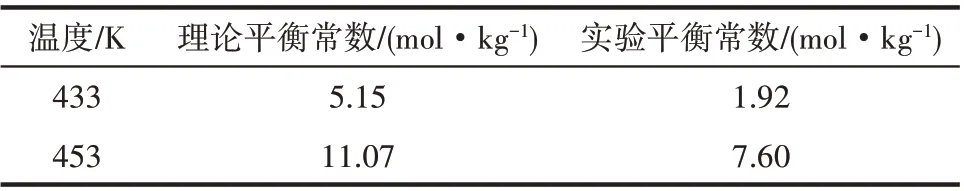
表8 平衡常數的理論計算值與實驗值Table 8 Theoretical and experimental values of equilibrium constants
3.2 不同溫度和時間下的反應物轉化率
通過熱力學分析可知高溫對反應有利,因此采用間歇實驗研究了常壓、463~493 K 溫度范圍內TOME 的轉化率隨反應時間的變化,反應過程中通過移除副產物甲醇來促進反應正向進行,實驗結果如圖2 所示。從圖2 可以看出,隨著反應溫度的升高,TOME 環化反應的速率顯著加快,463 K 溫度下環化反應進行270 min,反應物轉化率約80%;493 K溫度下反應進行50 min時反應物轉化率約94%。
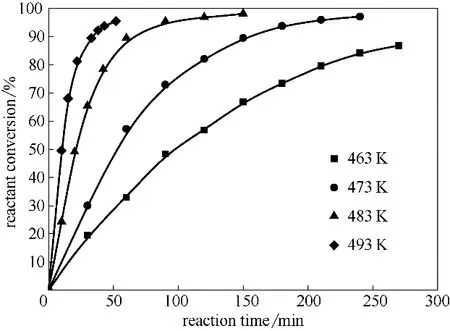
圖2 溫度和反應時間對反應物轉化率的影響Fig.2 Effect of temperature and reaction time on reactant conversion
3.3 動力學參數擬合
假設在所研究的反應條件下反應為一級反應,則反應物轉化率x與反應時間t存在以下關系:-ln(1-x)與t呈線性關系,斜率為反應速率常數k。以反應時間t為橫坐標,-ln(1-x)為縱坐標作圖,如圖3 所示。可以看出-ln(1-x)與t呈良好的線性關系。擬合得到的不同溫度下的反應速率常數如表9所示。
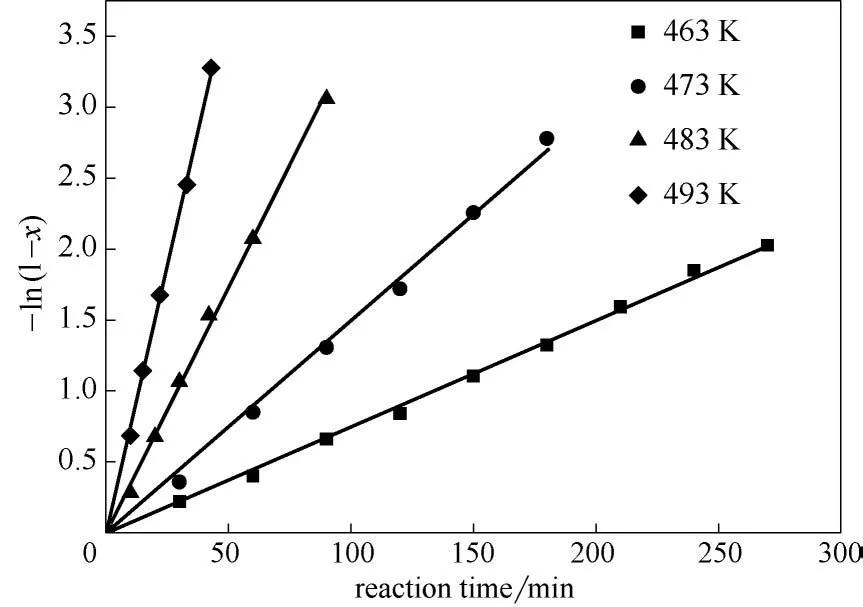
圖3 不同溫度下反應速率常數的擬合Fig.3 Evaluation of reaction rate constants at different temperatures
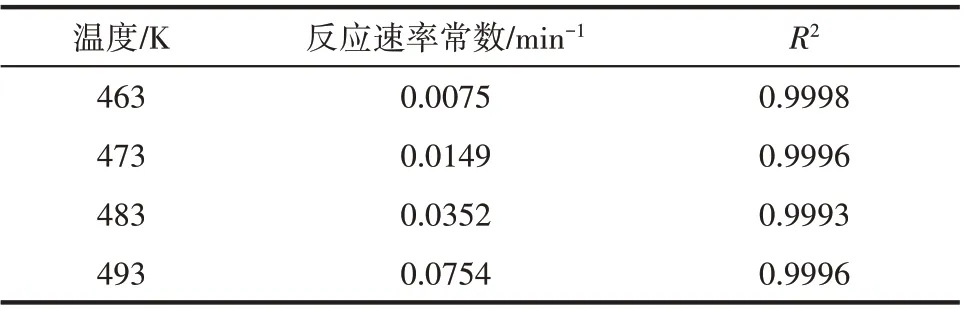
表9 不同溫度下的反應速率常數Table 9 Reaction rate constants at different temperatures
用Arrhenius 方程關聯表9 中的數據,以1/T為橫坐標,lnk為縱坐標作圖,如圖4 所示。通過擬合得到線性方程,可以獲得反應的活化能為143.72 kJ·mol-1,指前因子為1.19×1014min-1。
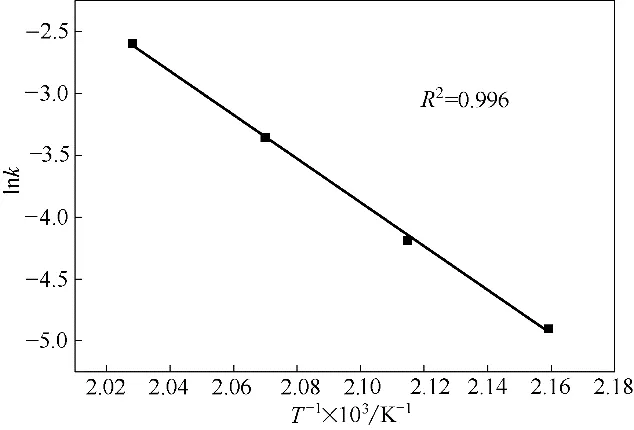
圖4 Arrhenius方程擬合結果Fig.4 Fitting plot of Arrhenius equation
4 結 論
(1)通過基團貢獻法計算了TOME 環化反應體系中各物質的基礎熱力學數據,獲得了不同溫度下的標準反應焓變、標準反應Gibbs 自由能變以及反應平衡常數。343~503 K 溫度范圍內該反應為吸熱反應,Gibbs 自由能計算結果表明在403 K 以上的溫度范圍內反應為自發過程。
(2)隨著溫度升高,反應Gibbs 自由能變減小,反應平衡常數增大,說明升高反應溫度有利于反應正向進行。
(3)通過實驗研究了常壓、463~493 K 溫度范圍內TOME環化反應的反應動力學。升溫能夠明顯加快反應速率,在實驗研究范圍內,該反應為一級反應,反應的活化能為143.72 kJ?mol-1。
符 號 說 明
a,d,e——Yoneda 法中恒壓摩爾熱容的計算式參數,J?mol-1?K-1
C,D,E,F,J——恒壓摩爾熱容多項式中的參數
c——濃度,mol?kg-1
cp——恒壓摩爾熱容,J?mol-1?K-1
ΔG——Gibbs自由能變,kJ?mol-1
g——氣態
ΔH——焓變,kJ?mol-1
K——反應平衡常數
k——反應速率常數,min-1
l——液態
Ni——基團數
nj——反應中各物質的化學計量系數
R——摩爾氣體常數
R2——相關系數
ΔS——熵變,J?mol-1?K-1
T——溫度,K
t——時間,min
x——反應物轉化率
yi——分子中i類官能團數與官能團總數之比
Δi——常壓沸點下蒸發焓的基團貢獻值
上角標
θ——標準態
下角標
b——常壓沸點
c——臨界點
f——生成態
i——基團
j——反應中各物質
r——反應態
s——對比態
v——蒸發態

