Fe-Zn基廢脫硫劑制備鐵碳材料及其對廢水微電解性能
張霄玲,于鳳芹,皇甫林,王超,李長明,高士秋,余劍
(1 中國科學院大學化學與化工學院,北京100049; 2 中國科學院過程工程研究所多相復雜系統國家重點實驗室,北京100190; 3 湘潭大學化工學院,湖南湘潭411105)
引 言
廢脫硫劑是煤氣干法脫除H2S 工藝過程產生的失效脫硫劑固體廢棄物,其主要成分為吸收H2S 后生成的金屬硫化物(Fe2S3,FeS,ZnS)以及不斷再生過程中生成的硫磺(S6)及吸附的有機硫噻吩等含硫化合物[1-3]。傳統填埋、投海法處理廢脫硫劑可能造成土壤或水污染。為減少廢脫硫劑污染危害,實現其資源化利用,目前已有針對傳統單一氧化鐵或氧化鋅系廢脫硫劑資源再生或回收處理的相關研究報道[4-7]。其中硫磺采用有機溶劑CS2萃取,蒸汽掃吹法可回收。但萃取法難度大,蒸汽吹掃成本高,而且無法直接處理FeS、ZnS 等硫化物[8]。丁明雷等[9]研究表明空氣氣氛下600℃氧化鋅脫硫劑中的硫化鋅可再生為氧化鋅進行循環使用,但硫酸鹽的生成導致脫硫劑的再生不完全且再生活性降低。楊文剛[10]采用氧化鐵廢脫硫劑與硫鐵礦摻燒制硫酸。秦亞平[11]研究用氮肥廠的氧化鋅廢脫硫劑制備七水硫酸鋅。但復合氧化鐵-氧化鋅系廢脫硫劑因成分復雜,再生或回收難度大,且無法充分回收利用廢脫硫劑中的鋅,導致資源浪費,且目前尚無較好的關于Fe-Zn 基廢脫硫劑處理技術的報道[12-13]。
近年來,工業廢水排放量逐年上升,對環境、水資源污染日益嚴重。工業廢水處理主要采用物理法、化學法及生物降解法等[14-17]。化學法是利用鐵碳材料、芬頓試劑、臭氧或光電等反應過程中產生的·OH 來氧化降解廢水中的有機物[18]。其中以鐵碳材料微電解工業有機廢水應用比較廣泛,以電沉積、芬頓反應、絮凝和吸附的綜合作用降解化學需氧量(COD),具有耗能低、操作簡單、成本低、效果優良的特點引起人們廣泛關注[19-20]。而芬頓反應是以H2O2為氧化劑,以Fe2+為氧化反應的催化劑,降解廢水中有機物的過程,其優點在于雙氧水氧化性強,對用生物降解法難以處理的化學有機廢水效果顯著,但成本較高。結合鐵碳微電解和芬頓氧化兩者優點,采用鐵碳材料-芬頓聯用技術,可減少芬頓試劑用量,降低成本,以期達到更高的處理效果[21]。微電解-芬頓聯用處理工業廢水時,微電解結束后廢水中溶解的Fe2+濃度及酸余量(即pH)將影響到芬頓反應對廢水中COD 的去除效果,因此此工藝技術的核心是微電解過程。而微電解工藝的核心是鐵碳微電解填料。當前工業鐵碳材料多以鐵屑或刨花為鐵源,與活性炭免燒混合或與煤高溫焙燒制備[22]。選擇廉價的鐵源和合理的工藝是制備低成本、高性能鐵碳材料的關鍵。
本文針對廢脫硫劑的循環利用,提出以廢脫硫劑為鐵源、以煤為碳源和還原介質,添加Na2CO3為反應助劑,實現廢脫硫劑中ZnS 的還原與單質Zn 的氣相蒸發分離,獲得高品質的Fe0-C 材料。深入研究了不同工藝條件對制備鐵碳材料品質、Zn 單質和Na2S 分離效率的影響,并對比研究了廢脫硫劑制備的鐵碳材料與商業鐵碳材料對工業有機廢水COD的處理效果。
1 實驗部分
1.1 材料與試劑
廢脫硫劑(waste desulfurizer)(來自山東明碩新能源科技有限公司)的XRD 譜圖如圖1 所示,物相主要有MgCa(CO3)2、S、CaSO4·2H2O、NaCl、FeO(OH)、ZnS、FeS 等[23];同時使用如下材料:粉狀煤(取自不連溝)、Na2CO3(分析純)、硫酸(分析純)、Ca(OH)2(分析純)、30%H2O2(分析純)、有機廢水(某芯片制造廠表面清洗廢水)、商業鐵碳材料(commercial Fe-C,取自某廢水處理廠)。其中不連溝煤的工業分析及元素分析如表1 所示。由表可知,不連溝煤中揮發分及灰分含量較大,固定碳含量較低,碳含量為62.38%,屬于較低品質煤。煤的揮發分在高溫熱處理時利于造孔,提高鐵碳材料的比表面。

表1 不連溝煤的工業分析和元素分析Table 1 Proximate and ultimate analysis of Buliangou coal

圖1 廢脫硫劑XRD譜圖Fig.1 XRD pattern of waste desulfurizer
1.2 熱處理實驗
1.2.1 熱處理實驗方法 對廢脫硫劑進行三種不同的熱處理:煅燒(氮氣氣氛),炭熱還原,以Na2CO3為助劑的炭熱還原處理。其中廢脫硫劑(waste desulfurizer)以W 表示,粉狀煤(coal)以C 表示,分析純無水Na2CO3以N 表示,分別將其用粉碎機粉碎成粉末。分別將廢脫硫劑(標記為W)、廢脫硫劑/不連溝煤配比為1/1(標記為WC)、廢脫硫劑/不連溝煤/Na2CO3配比為1/1/1.5 的樣品(標記為WCN)研磨均勻,原料W、WC、WCN 在管式爐中900℃煅燒3 h 的產 物 分 別 以W-C900-3、WC-C900-3 及WCNC900-3 表示(標識中第一個C 為coal,煤;第二個C為calcine,煅燒;下文的同一標識中同一位置C表示同義)。
廢脫硫劑與煤基炭發生熱解反應還原FeS、ZnS,FeO(OH)形成鐵碳材料,還原生成的Zn 單質在高溫下(沸點907℃)蒸發而分離,廢脫硫劑中硫元素與鈉形成副產物Na2S附著在鐵碳材料表面[24]。
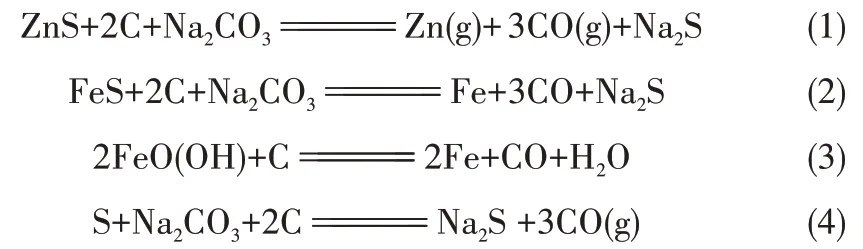
反應結束后,從管式爐取出粗制的鐵碳材料。用去離子水浸泡12 h 后,再洗滌數遍至洗滌水呈中性為止。將其過濾后放置110℃烘箱中干燥過夜即可獲得鐵碳材料。其制備工藝流程如圖2 所示,水洗滌熱處理后廢脫硫劑所產生的Na2S 溶液可作為工業中生產Na2S 化學品的原料液。氮氣在反應中作保護氣循環利用過程中,攜帶上次反應產生的CO可直接參與下次熱還原反應以避免直接排入大氣,可降低CO二次污染。
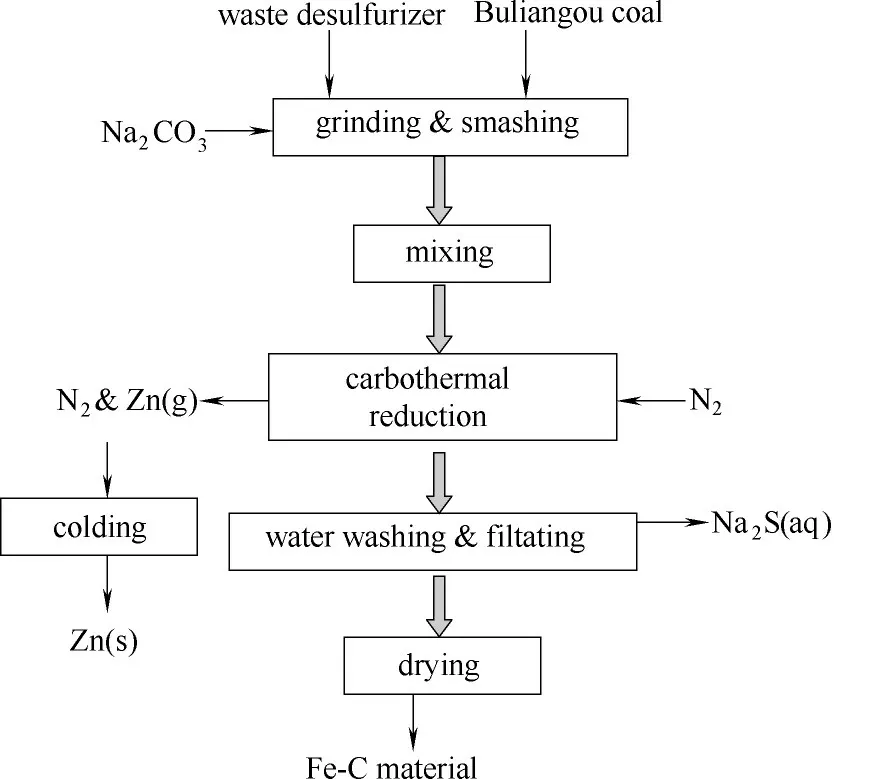
圖2 廢脫硫劑制備鐵碳材料及分離Zn工藝流程圖Fig.2 Schemtic diagram for preparation of Fe-C materatial and separation of Zn
1.2.2 熱處理工藝條件研究 為進一步研究工藝條件對廢脫硫劑熱處理分離鋅硫的影響,以上述熱處理方法及其結果為基礎,進一步擴展研究在不同焙燒溫度(600~1000℃),不同反應時間(1~5 h),不同煤/廢脫硫劑配比(C/W=0~2)以及不同Na2CO3/廢脫硫劑(Na2CO3/W= 0~2)工藝條件下的廢脫硫劑中鋅及硫的分離效率。
1.3 工業有機廢水降解實驗
工業有機廢水來自某芯片清洗廠,COD 值約1500 mg/L。鐵碳材料與有機廢水的質量固液比1∶100,初始pH =2~10(濃硫酸調節pH),曝氣若干小時[25];微電解-芬頓聯用工藝需在曝氣結束后加入一定量30%雙氧水且保證廢水中H2O2= COD = 1500 mg/L,在80℃下反應若干小時。然后用Ca(OH)2調節pH 至10,沉淀分離Fe2+、Fe3+。以K2Cr2O7-H2SO4法測定廢水處理前后的化學需氧量COD,并計算其COD去除率。

1.4 表征
采用X 射線衍射儀(物質)(Empyrean,荷蘭PANAlytical B.V.)分析材料的晶相結構。XRF(AXIOS-MAX 型,荷蘭PANalytical)分析材料組成;BET比表面全自動物理吸附儀(ASAP 2020HD88,美國麥克儀器公司)對材料表面積、孔徑孔容進行分析;熱重差熱分析儀(Seiko7300 型,日本)進行材料失重分析;熱場發射掃描電子顯微鏡與能譜分析儀(JSM-7001F+INCA X-MAX,日本JEOL 公司)對材料表面形貌進行分析。COD 測試儀(CM-02 型,中國北京雙暉京承電子產品有限公司)對用微電解-芬頓聯用工藝處理前后的廢水的化學需氧量COD值進行測試。
2 結果與討論
2.1 廢脫硫劑熱處理制備鐵碳材料與鋅分離
首先對廢脫硫劑(waste desulfurizer)及經過不同熱處理的樣品廢脫硫劑煅燒樣品(W-C900-3),炭熱還原樣品(WC-C900-3),加Na2CO3炭熱還原樣品(WCN-C900-3),及 產 物 鐵 碳 材 料(Fe-C material)進行主要元素含量分析,結果如表2 所示。廢脫硫劑經高溫900℃無氧煅燒3 h 的過程中失去自由水,以及羥基氧化鐵中的結合水后,產物(WC900-3)各元素含量基本都高于廢脫硫劑,而硫元素含量約3.48%的損失,可能與煅燒時H2S 或有機硫的釋放有關。對于炭熱還原產物(WC-C900-3),由于高溫炭還原反應后引入大量煤的灰分,如Al2O3、SiO2等,導致Fe、Zn 等物質的相對含量降低。將煤煅燒產物(C-C900-3)與炭熱還原產物(WCC900-3)相比,經物料守恒核算可知WC-C900-3 樣品中的Zn 含量未發生明顯改變,說明ZnS 未被煤基炭還原和分離。而加Na2CO3的炭熱產物(WCNC900-3)的Zn 含量驟減到0.060%,說明Na2CO3的加入使鋅成功從廢脫硫劑中還原與分離。且觀察到反應器管壁附著有銀白色薄片狀凝結的鋅單質,可認為以Na2CO3為助劑時,煤可成功將廢脫硫劑中的ZnS 還原為單質Zn 并在高溫下(900℃)以蒸氣形式分離回收。而經水洗后的鐵碳材料中(Fe-C material-washed)S 含量顯著降低,同時Fe 含量顯著增加,表明通過水洗可實現生成的含硫副產物的分離。依據相關文獻,以Na2CO3為助劑的煤基炭熱還原ZnS 時,可如式(1)發生反應,ZnS 中硫可被Na2CO3固定生成Na2S,此時ZnS 被還原為鋅單質從廢脫硫劑中分離[24]。
圖3(a)為對于廢脫硫劑不同熱處理樣品的晶型分析。與圖1相比,廢脫硫劑經900℃煅燒后樣品W-C900-3 出現晶型良好的ZnS、Fe3O4衍射峰;而高溫炭熱還原樣品WC-C900-3 主要的組成為Fe0及ZnS,且在43.5°、50.7°和74.5°出現FeC3衍射峰,說明炭熱還原不僅將羥基氧化鐵還原為Fe0,且形成鐵碳合金[26]。樣品WCN-C900-3 中除Fe0外,ZnS 衍射峰消失,Na2S衍射峰出現,且未出現Zn單質的峰,說明加入Na2CO3后,炭可成功還原ZnS 為Zn 單質,并在高溫以Zn 蒸氣逸出[27-29],同時副產Na2S。樣品WCN-C900-3 經過水洗后,Na2S 溶于水中與鐵碳材料分離,得到的純化樣品Fe-C material 中只存在Fe0、Fe3C 及SiO2衍射峰。而商業鐵碳(commercial Fe-C)與純化鐵碳材料相比,其SiO2峰強而Fe0峰較弱,表明自制鐵碳材料具有較好的品質。
圖3(b)為不同熱處理樣品的空氣氣氛下的熱重分析結果。廢脫硫劑煅燒樣品W-C900-3 在300~400℃下失重峰可歸屬羰基硫與空氣燃燒釋放SO2與CO2導致的重量損失,550~650℃失重為ZnS被氧化后的氣相產物SO2逃逸失重[9]。對于炭熱還原樣品WC-C900-3,除了200~400℃和550~650℃的SO2和CO2逃逸失重之外,380~525℃范圍出現了碳燃燒失重峰。而加Na2CO3炭熱還原樣品WCNC900-3,由 于 生 成 的Na2S 易 被 氧 化 為Na2SO4,在200℃出現增重峰,且因炭燒失又在500℃驟降。純化鐵碳材料(Fe-C material)僅有炭燃燒失重峰,約為25%,去除分離的鋅、硫等物質,純化的鐵碳材料的鐵碳比約為3∶1。而商業鐵碳(commercial Fe-C)碳失重很少,僅為7%。這表明商業鐵碳材料的碳含量較低。
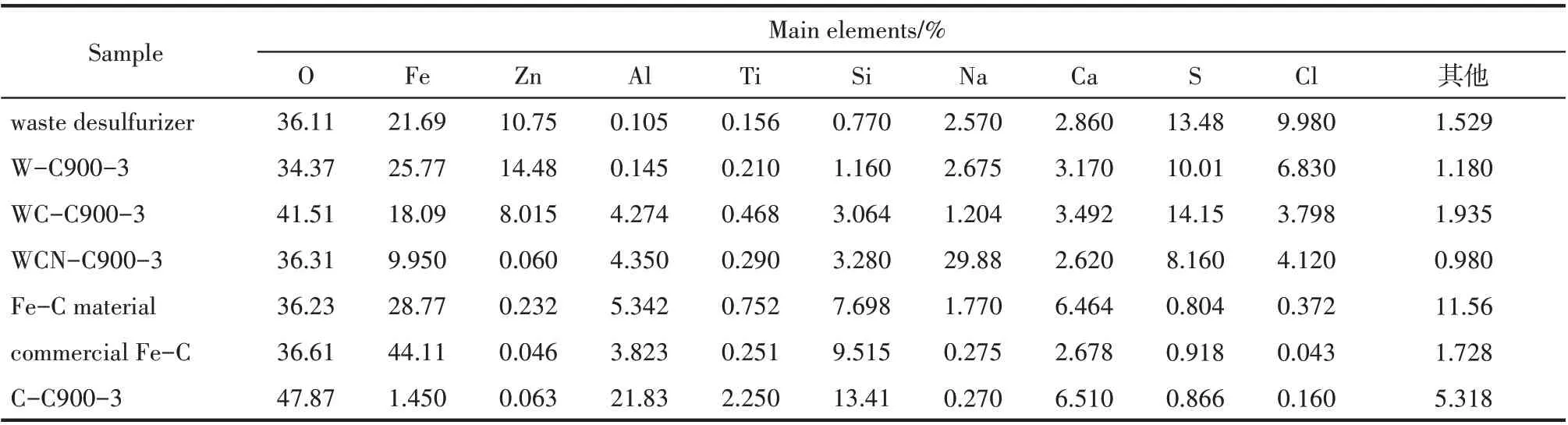
表2 廢脫硫劑及經過不同熱處理樣品的XRF分析結果Table 2 Main chemical composition of waste desulfurizer and samples through different thermal processes
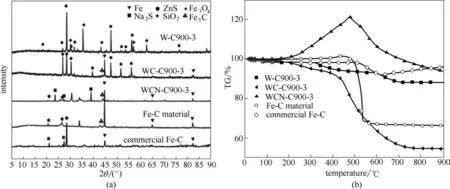
圖3 不同熱處理樣品XRD譜圖及空氣熱重分析Fig.3 XRD patterns and TG analysis of samples through different thermal processes

圖4 不同工藝參數對廢脫硫劑中Zn、S分離效率的影響Fig.4 Separation rate of Zn and S from waste desulfurizer under different preparation processes

圖5 不同樣品的掃描電鏡圖Fig.5 SEM images of W,W-C900-3,WC-C900-3 and Fe-C material
為研究熱處理工藝參數對廢脫硫劑中鋅、硫分離效率的影響,進一步考察了煤與廢脫硫劑配比,Na2CO3與廢脫硫劑配比,溫度及時間等因素對鋅、硫的分離效率的影響。如圖4(a),在900℃,Na2CO3:廢脫硫劑=1.5 時,煤與廢脫硫劑配比從0.5增加到1時,硫分離效率從46%增加到95%,鋅分離效率從35%增加到97%。當煤與廢脫硫劑配比≥1,硫、鋅分離效率均大于95%,表明煤與廢脫硫劑配比≥1 時即可很好地實現鋅、硫分離。在900℃,C/W=1.5 時,助劑Na2CO3與廢脫硫劑配比不同同樣影響鋅、硫的分離效率[圖4(b)]。當Na2CO3∶廢脫硫劑=0.5,S 的分離效率僅為18%,遠低于Zn 的分離效率(73%),說明Na2CO3對S 分離效率的影響遠高于對Zn還原反應的影響;而Na2CO3∶廢脫硫劑=1.5時,Zn、S 的分離效率分別達到96%及94%,表明鋅、硫的分離已較為完全。
圖4(c)則表明隨溫度升高,Zn、S分離效率隨之同步升高;溫度超過700℃,硫、鋅分離效率驟升,說明700~800℃以Na2CO3為助劑炭熱還原ZnS 的反應速率增加迅速。900℃時硫、鋅分離效率進一步增加至95%,表明900℃時炭熱還原反應較為完全。圖4(d)表明反應時長達1h時鋅已基本分離完全,對于S的分離則要延長反應時間至2 h,以達到穩定的分離效率。所以只有當反應溫度≥900℃,煤∶廢脫硫劑≥1,Na2CO3∶廢脫硫劑≥1.5,反應時長≥2h 時,Zn、S 的分離回收效率才可達到95%以上。
2.2 鐵碳材料結構表征
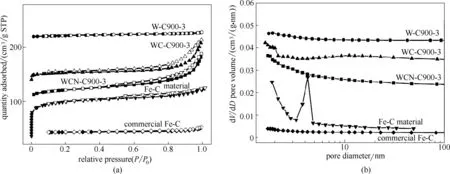
圖6 不同樣品N2等溫線及孔徑分布曲線Fig.6 Nitrogen adsorption isotherms and pore size distribution of different samples
圖5 展示了廢脫硫劑(a),煅燒樣品(b),炭熱還原樣品(c)及鐵碳材料(d)形貌特征的掃描電鏡圖。從圖5(a)中可知廢脫硫劑為顆粒狀堆積物質。經高溫煅燒后,樣品結晶度增加,顆粒變大,呈熔融結塊骨架結構[圖5(b)]。圖5(c)則表明廢脫硫劑經過炭熱還原反應后,質地疏松的無定形炭附著在還原的Fe0及其他焙燒剩余物的空隙處。經過水洗純化后的鐵碳材料呈鱗片狀結構,且表面出現一些較大的空隙,可歸因于副產物Na2S溶解[圖5(d)]。
廢脫硫劑煅燒樣品,炭熱還原樣品,加Na2CO3炭熱還原樣品,及純化鐵碳材料的氮氣吸附脫附等溫線及孔徑分布曲線如圖6所示。由氮氣吸附脫附等溫線可知,四個樣品皆為IV 型曲線,且由于毛細凝聚現象,曲線中出現滯后環。結合表3 及圖6 可知,廢脫硫劑經煅燒處理后,比表面從75.08 m2/g 嚴重減小至12.38 m2/g,且基本無孔結構出現。而與煤混合進行炭熱還原反應后,由于炭將Fe3O4還原為Fe0,比表面增加到84.97 m2/g。加入Na2CO3的樣品,盡管有還原的鋅蒸氣逸出,但比表面基本保持不變(84.36 m2/g),且無明顯的孔結構特征。但經蒸餾水浸泡,隨著Na2S 等可溶性鹽的溶出,鐵碳材料新增大量3~5 nm 的介孔,比表面顯著增加到193.6 m2/g。而商業鐵碳材料比表面僅為9.371 m2/g,表明由廢脫硫劑制備的鐵碳材料具有明顯的結構優勢。
2.3 鐵碳材料微電解-芬頓聯用處理有機廢水特性
所用廢水初始COD 濃度為1500 mg/L,初始pH=2。平行對比自制鐵碳材料(C/W 比為1)和商業鐵碳材料在微電解-芬頓聯用處理電路板清洗PCB廢水時的工作特性(圖7)。由圖7(a)、(b)微電解時的pH,Fe2+溶解變化曲線表明:微電解進行15 min時,廢水的pH 從2 驟增到2.5 左右,Fe2+濃度也突然增加;但隨著微電解繼續進行,pH變高,溶鐵反應減慢,Fe2+濃度的差異也逐漸變小。且考慮到Fe2+和芬頓反應后生成的Fe3+可能水解生成Fe(OH)2和不得Fe(OH)3,后續芬頓反應的處理廢水的pH≤3 為宜,所以微電解時間不宜過長,1.5 h 較為妥當[30]。與商業鐵碳相比,由于自制鐵碳材料本身鐵含量較低,微電解過程Fe0消耗速率也較小,導致廢水的pH 及Fe2+上升速度較慢。自制鐵碳處理的有機廢水中Fe2+濃度較小。
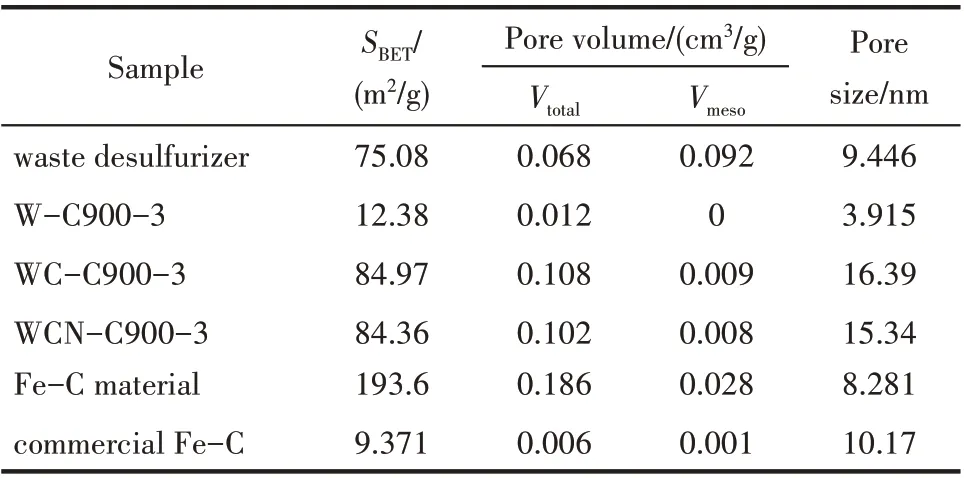
表3 不同樣品的比表面,孔容及孔徑結果Table 3 Specific surface area and pore size distribution of different samples
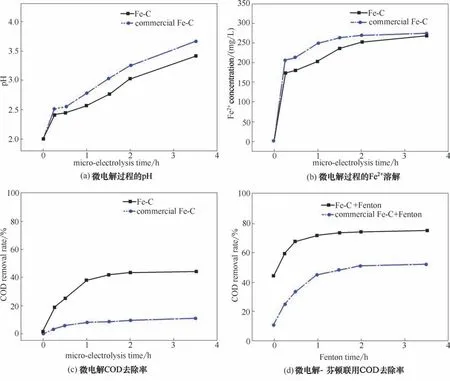
圖7 鐵碳微電解-聯用處理有機廢水過程的工作特性Fig.7 Changing rules of disposing waste water by micro-electrolysis-Fenton technology
圖7(c)微電解去除COD 效果的變化曲線表明:隨著微電解過程進行,中間產物活性氫[H]、·OH 與廢水中有機物發生加氫,開環及氧化等反應將其降解成小分子,廢水COD 去除率升高[31]。但與此同時微電解反應速率也在逐漸減小;微電解1.5 h 后,COD 去除率開始趨于穩定。且自制鐵碳材料微電解的穩定COD去除效率達到41.78%,而商業鐵碳僅有8.43%。這歸因于廢脫硫劑制備的鐵碳材料較高的比表面(193.6 m2/g)和孔容(0.186 cm3/g)使其具有較好的吸附能力并暴露較多的活性中心,有利于活性氫與水中有機物的反應進行[32]。
而圖7(d)后續芬頓反應去除COD 效果的變化曲線表明,鐵碳微電解溶解Fe2+作為氧化反應的催化劑,可使廢水COD 去除率顯著增加,且反應2h 后COD 去除率已趨于穩定。就芬頓反應而言,由于商業鐵碳處理的廢水Fe2+濃度較高,處理效果略優于自制鐵碳;但自制鐵碳微電解-芬頓聯用的COD 去除率(73.56%)明顯優于商業鐵碳(48.43%)。這主要歸因于自制鐵碳本身性能優良,微電解時已達到較高的COD 去除率,使得在后續芬頓處理中保持明顯優勢。
進一步研究初始pH 對鐵碳材料微電解-芬頓聯用處理有機廢水的影響。由表4 可以看出,當廢水的初始pH ≥2.5 時,由于微電解的溶鐵反應,廢水的pH 持續增高到4 以上,Fe2+和芬頓反應后生成的Fe3+可能水解生成Fe(OH)2和Fe(OH)3,影響了后續芬頓反應降解廢水剩余COD 的效果。而當廢水的初始pH<2.5時,初始pH主要是對微電解過程溶解Fe2+的濃度造成影響,從而對后續芬頓反應降解廢水剩余COD 的效果造成一定影響。當pH =1.5 時,微電解一次溶鐵量為471.2 mg/L,約是pH=2一次溶鐵量的2.30 倍,但COD 去除率卻僅為pH=2 時COD 去除率的1.13 倍。考慮到鐵碳材料一次溶鐵量過高時嚴重影響其使用壽命,且可以通過調控其他參數,如雙氧水添加量等達到理想的COD 去除率,所以優選廢水初始pH=2。
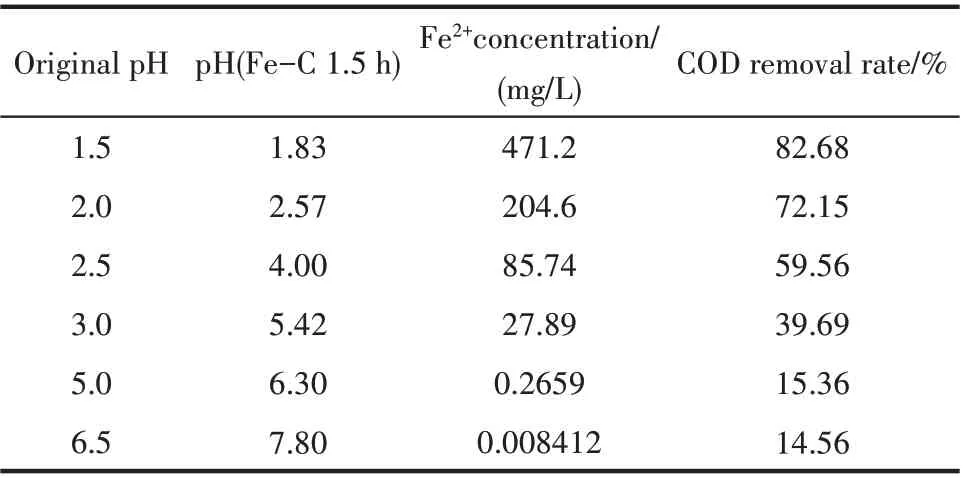
表4 初始pH對鐵碳材料微電解-芬頓聯用處理有機廢水的影響Table 4 Effect of original pH on removal rate of COD via micro-electrolysis-Fenton in waste water
2.4 鐵碳材料重復使用性能
基于前述研究結果,在所用廢水初始COD 濃度為1500 mg/L,初始pH=2,微電解時間1.5 h,芬頓反應時間2 h 條件下,自制鐵碳材料與商業鐵碳在微電解處理電路板清洗PCB 廢水后,過濾出鐵碳材料在管式爐900℃中無氧焙燒3 h 后,重新進行微電解-芬頓聯用實驗。
圖8是自制鐵碳材料與商業鐵碳的重復使用性能對比。就微電解而言,兩者重復使用次數都不超過4 次,第5 次時,二者溶鐵量都接近0,即已經不可再重復使用。但前三次時,自制鐵碳明顯優于商業鐵碳的微電解處理效果。且由圖8(a)可以看出自制鐵碳隨重復使用次數增加,溶鐵量在大幅度減少,COD 去除率卻不斷增加,至第4 次時,COD 去除率突然下降。這是因為鐵碳材料中鐵不斷消耗,C/W 比不斷增加。一方面比表面積也會增加,增強了鐵碳材料對有機物的吸附能力;另一方面,陰極材料的碳增加,微電解反應產生活性氫及羥基自由基與廢水有機物接觸更加充分。所以微電解去除COD 的效果增加;而至第4 次時鐵碳材料中充當陽極材料Fe0過少,COD 去除率下降。而圖8(b)表明隨著使用次數增加,商業鐵碳材料因Fe0的消耗,微電解的COD去除率下降。
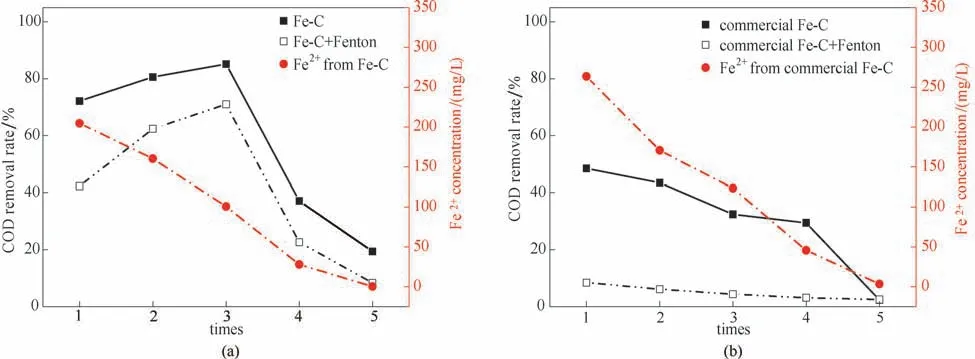
圖8 鐵碳材料/商業鐵碳的重復使用性能及鐵的溶出特性Fig.8 Cyclic utilization performance of Fe-C/commercial Fe-C and dissolution of corresponding Fe element
就芬頓反應而言,隨鐵碳材料重復使用次數增加,微電解的溶鐵量在大幅度減少,芬頓反應的COD 去除率下降,由于商業鐵碳處理的廢水Fe2+濃度較高,COD 去除率略優于自制鐵碳。就微電解-芬頓聯用的COD 去除率而言,前三次重復使用時,自制鐵碳明顯優于商業鐵碳;仍歸因于自制鐵碳本身微電解去除COD的性能優良;至第4次時,由于自制鐵碳材料微電解COD 去除率下降,兩者差異不大;第5次時,二者溶鐵量都接近0,微電解與芬頓反應都受到強烈抑制,自制鐵碳材料與商業鐵碳雙雙失效,不可再重復使用。
3 結 論
以廢脫硫劑為鐵源,不連溝煤為碳源,添加Na2CO3為助劑,采用炭還原熱處理工藝,成功制備了鐵碳材料,同時實現了Zn 和S 的分離,有望能實現廢脫硫劑的綜合利用。首先分析了廢脫硫劑熱處理過程的產物組成,優化廢脫硫劑熱處理溫度、時間、原料配比等制備工藝參數。然后對自制鐵碳材料進行BET 和SEM 表征。最后研究了廢脫硫劑制備的鐵碳材料微電解-芬頓技術去除PCB 廢水COD 的效果,工作特性及鐵碳材料的重復使用性能,得出以下結論。
(1)通過XRF、XRD、TG 表征可知,廢脫硫劑與煤及Na2CO3高溫反應,廢脫硫劑中的氧化鐵被還原為零價鐵,獲得鐵碳材料;Na2CO3固定ZnS 中S 生成Na2S,ZnS 還原為鋅蒸氣逸出,實現鋅的分離;經水洗后Na2S與鐵碳材料分離,實現硫的分離。
(2)進一步考察廢脫硫劑熱處理工藝參數對熱處理工藝的影響,結果表明,反應溫度≥900℃,煤∶廢脫硫劑≥1,Na2CO3∶廢脫硫劑≥1.5,反應時長≥2 h,Zn、S的分離回收效率可達到95%以上。
(3)BET 和SEM 表征結果表明:與商業鐵碳材料相比,廢脫硫劑制備的鐵碳材料具有高達193.6 m2/g 的比表面積和0.028 cm3/g 介孔孔體積,且炭均勻分布于鐵納米顆粒之間,減緩了鐵碳材料的燒結,促進了顆粒分散。
(4)微電解-芬頓聯用處理廢水的實驗結果表明,廢脫硫劑制備的鐵碳材料和商業鐵碳材料的COD 去除率分別為73.56%和59.65%,證明了廢脫硫劑制備的鐵碳材料具有更好的COD 降解效果與較好的吸附能力。
(5)重復使用性能對比的實驗結果表明:自制鐵碳材料與商業鐵碳的兩者重復使用次數都不超過4次,前三次重復使用時,自制鐵碳明顯優于商業鐵碳的微電解處理效果。至第4 次時,由于自制鐵碳材料微電解COD去除率下降,兩者差異不大;第5次時,二者溶鐵量都接近0,即已經不可再重復使用。

