FGG在結直腸癌中的表達及意義
馬舒婷,謝 風,劉金華,李 威
(吉林大學中日聯誼醫院 檢驗科,吉林 長春130033)
纖維蛋白原γ鏈(FGG)是纖維蛋白原(FG)的一種組分,DNA分析顯示是10.5 kb中存在10個外顯子和9個內含子[1]的片段。人血漿中FG主要由肝臟產生,由α,β以及γ三條多肽鏈以二硫鍵為連接方式組成[2],三條多肽鏈分別由FGA、FGB以及FGG基因編碼。FGG可在凝血過程中發揮功能,同時在早期創傷性修復中具有穩定病灶和引導上皮細胞遷移的作用。本研究旨在探究FGG在結直腸癌和其癌旁組織中的表達情況以及差異性,探討FGG與腫瘤的發生及發展間的關系,進而為臨床提供診斷依據。
1 材料與方法
1.1 研究對象
23例結直腸癌患者(均被吉林大學中日聯誼醫院確診),手術中切除的新鮮組織作為研究對象,同時留取與其配對的癌旁組織(距離取材的癌組織10 cm以上)。以上取材離體后液氮速凍,置-80℃保存備用。
1.2 主要試劑與儀器
測序級胰蛋白酶、DNA酶、RNA酶、考馬斯亮藍-G250均購于西格瑪(美國)公司,蛋白定量試劑盒、IAA(購于Bio-Rad公司),DTT,FA,尿素,TMED。液相色譜分析儀(Agilent公司),LTQ XL離子阱質譜儀(Thermo Fisher公司),UV-2000型分光光度計。
1.3 實驗方法
1.3.1總蛋白的提取、蛋白濃度測定 將凍存的待測組織樣本取出,充分研磨至勻漿。在4℃,12 000 g條件下離心,1 h,留取上清液待用。考馬斯亮藍染色后用UV-2000型分光光度計于590 nm處進行比色,從而計算出樣本蛋白的濃度。
1.3.2組織蛋白水解多肽混合物的制備 將樣本從冰箱中取出置于室溫下平衡后,為降低尿素在樣本中的濃度,應用NH4HCO3稀釋。加入一定量DTT后充分混勻,使終濃度調至20 mmol/L,置56℃,避光1 h。待上述操作完成后降至室溫,取1 mol/L IAM 適量,使終濃度調至50 mmol/L,置室溫,避光30 min。測序級胰酶按胰酶與蛋白質1:50的比例加入,而后置于37℃水浴箱中,過夜,酶切產物(真空抽干),保存于-80℃條件下。
1.3.3液質聯用技術分析 待測樣本用FA溶解后取50 μg上樣,洗脫的多肽用LTQXL質譜儀進行檢測,選取合適核質比范圍,以數據依賴的方式進行質譜掃描。所得質譜圖應用Bio works3.3.1SP1軟件進行分析。
1.3.4Western Blot 該方法驗證目的蛋白FGG在癌組織以及癌旁組織中的表達情況。所用FGG單克隆抗體為ABGENT公司(美國),內參抗體:GAPDH。
1.4 統計分析
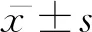
2 結果
2.1 液質聯用技術結果分析
配對樣本中蛋白質譜圖數差值≥72,并且比值≥1時,可以說蛋白質豐度有差異。按此標準,得出結直腸癌組織與其癌旁組織的差異蛋白44個,其中21個表達上調,23個表達下調。FGG質譜圖見圖1。

圖1 FGG質譜圖
2.2 Western blot
用Western blot試驗印證了FGG在結直腸癌及其癌旁組織中的表達水平,結果顯示FGG在結直腸癌中的表達水平明顯高于與其配對的癌旁組織,如圖2。
3 討論
結直腸癌的發病率在近幾年里居高不下,與其他一些癌癥相似,發病具有隱匿性,一經確診已接近中晚期。因此,尋找到可以作為該病病情監測以及療效預測的腫瘤標志物成為了目前亟待解決的問題,進而達到提高生存率以及有效治療的目的。本文通過對癌組織以及癌旁組織中蛋白表達情況進行分析比對,從而為臨床診斷提供新的腫瘤標志物。Garcia[3]等人通過體外證明,腫瘤細胞可以產生FG。Zhang Xiang[4]等人證實,FGG在原發性肝癌組織中表達較相應的癌旁組織比較明顯增加。細胞內FGG的表達上調與血管侵犯增加、衛星結節增多、TNM分期加重顯著相關,FGG表達增強的肝癌患者復發率較高。纖維蛋白原在凝血、纖維蛋白溶解、細胞和基質的相互作用、炎癥和傷口愈合中起著重要的作用[5]。許多研究表明,在惡性腫瘤患者中高纖維蛋白原血癥可以作為預后因子[6],并且與腫瘤的生長、侵襲轉移以及血管生成有關[7-9]。Yokoyama[10]等人發現FGG的C末端區域作為纖維蛋白原的主要整合素結合位點參與血栓形成、血管生成和炎癥過程。Mark Bloomston[11]等人研究發現,在胰腺癌中FGG過表達,采用免疫組織化學、蛋白組學以及血清酶學等方法的驗證,其被視為潛在的腫瘤標志物[12]。KinoshitaA[13]等人研究發現,肝細胞癌中FGG的mRNA水平增高,并且血漿纖維蛋白原水平隨著臨床分期的增加而增加。有學者通過定量蛋白組學以及MALDI-TOF MS的研究表明,FGG與子宮肌瘤的發生和發展有關,可能成為該病診斷的標志物之一[14]。

圖2 結直腸癌及癌周組織FGG免疫印跡圖
本實驗研究采用液質聯用技術以及Western blot技術,驗證了FGG在結直腸癌組織中的表達明顯高于癌旁的組織。綜上,FGG可以作為結直腸癌篩查的早期標志物之一,從而提高該病的診斷和治療效果。

