膠質瘤組織和膠質瘤干細胞miR-520f-3p表達及臨床意義
李霞,任玉嫄,姜忠彩,周新剛
1航空總醫院,北京 100012;2首都醫科大學附屬北京地壇醫院
膠質瘤是中樞神經系統中最常見的原發性惡性腦腫瘤,根據統計數據顯示,膠質瘤約占所有中樞神經系統腫瘤的28%,約占所有惡性顱內腫瘤的80%[1]。盡管目前對膠質瘤的治療采用多模式治療手段,包括手術、放療和化療,但膠質瘤的預后仍不容樂觀[2],尤其是膠質母細胞瘤,患者的平均存活時間僅12~15個月[3]。目前膠質瘤的發病機制尚不清楚,但越來越多的證據表明,膠質瘤的發生發展與微小RNA(miRNAs)的調控密切相關[4],miRNAs是一類廣泛存在的小分子非編碼RNA,在多種疾病中均存在表達異常,包括人類惡性腫瘤[5,6]。此外,腫瘤組織中存在一小部分腫瘤細胞具有干細胞特性,被稱為腫瘤干細胞,是腫瘤發生發展及復發的根源[7]。相關研究已經證實,miRNAs可調控多種腫瘤干細胞的惡性行為[8]。miR-520f-3p是新近發現的miRNA,目前對其研究較少。研究發現,miR-520f-3p在膠質瘤患者血清細胞分泌的外囊泡中高表達[9],同時雄激素受體(AR)/ miR-520f-3p / SOX9信號通路可增加肝癌干細胞的表型[10]。2014年6月~2017年6月,我們檢測了miR-520f-3p在膠質瘤組織和膠質瘤干細胞(CSCs)中的表達,并探討其意義。
1 材料與方法
1.1 材料 組織樣本:收集2014年6月~2017年6月入住我院行手術切除的膠質瘤患者,患者未曾行放化療、靶向治療等影響腫瘤的治療,且未合并其他腫瘤或影響生命的全身性疾病,具有完整的病例資料,共收集40例經病理證實為膠質瘤的標本。其中男25例、女15例, 年齡16~75歲, 中位年齡50歲;按2007年WHO中樞神經系統膠質瘤分類標準進行分級,Ⅰ~Ⅱ級為低級別組,共22例,Ⅲ~Ⅳ級為高級別組,共18例;星型細胞膠質瘤34例,間變型星形細胞膠質瘤6例。另選取因腦外傷行內減壓術取得的正常腦組織20例份作為對照。男14例、女6例,中位年齡48歲。本研究由我院倫理委員會審核通過。
試劑與儀器:TRIzol、反轉錄和qRT-PCR試劑盒等均購自北京天根生化科技有限公司;膠質瘤細胞系U87和星形細胞瘤細胞系H4均購自美國ATCC細胞庫;DMEM高糖、胎牛血清FBS表皮生長因子(EGF)、堿性成纖維細胞生長因子(bFGF)和B-27均購自美國Gibco公司;miR-520f-3p inhibitor和miR-520f-3p mimics均由上海捷瑞生物有限公司設計合成;RIPA裂解液、BCA檢測蛋白濃度試劑盒均購自美國Solarbio公司;MTS購自美國Biovision公司;Transwell小室購自美國Corning公司;兔抗人OCT4多克隆抗體、鼠抗人Nanog多克隆抗體、兔抗人SOX2多克隆抗體、鼠抗人GAPDH多克隆抗體均購自美國Proteintech公司。
1.2 膠質瘤組織、正常腦組織和膠質瘤CSCs中miR-520f-3p的表達檢測 采用qRT-PCR 法。采用TRIzol裂解研磨破碎的組織及細胞,氯仿試劑提取的方法獲得總RNA,并將其逆轉錄為cDNA,以cDNA為模板按照SYBR Premix ExTaq試劑盒說明書進行qRT-PCR。 引物序列:miR-520f-3p正向引物:5′-ACACTCCAGCTGGGCCTCTAAAGGGAAGCG-3′,反向引物:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGAAAGCG-3′。LDOC1正向引物:5′-GCTCCCCGAGTTTATCGTGC-3′,反向引物:5′-TTCATGGCGTCGTTGCAGAA-3′。內參GAPDH正向引物:5′-ACAACTTTGGTATCGTGGAAGG-3′,反向引物:5′-GCCATCACGCCACAGTTTC-3′,采用2-ΔΔCt(循環閾值,Ct)法分析計算膠質瘤組織、正常腦組織和膠質瘤 CSCs中miR-520f-3p的表達。
1.3 細胞培養及轉染 膠質瘤細胞系U87培養基為DMEM高糖+10%FBS,培養條件為37 ℃、5%CO2。將U87細胞腫瘤球制成單個細胞后與小鼠抗人CD133抗體包被的磁珠孵育,分選出CD133+的CSCs和CD133-的細胞,在含20 ng/mL EGF和bFGF、20 μL/mL 的B-27無血清培養基中繼續培養。流式細胞儀檢測CD133陽性細胞率。CSCs細胞對數生長期時胰酶消化后鋪至6孔板中,分為NC組和miR-520f-3p inhibitor組,按說明書將脂質體2000與NC和miR-520f-3p inhibitor轉染試劑轉染至CSCs中,放至培養箱中培養。
1.4 細胞中OCT4、Nanog和SOX2蛋白表達檢測 采用Western blotting法。收集細胞,加入含有蛋白酶和磷酸酶抑制劑的RIPA裂解液,冰上充分裂解10 min,13 000 r/min、4 ℃離心30 min,上清液為蛋白液,BCA檢測蛋白濃度,加入Loading buffer變性后,SDS-PAGE電泳分離蛋白,濕轉方法將蛋白轉至PVDF膜上,5% 脫脂牛奶室溫封閉3 h,TBST洗5 min后加入一抗孵育4 ℃過夜,TBST洗3次5 min后,二抗室溫孵育2 h,ELC化學發光法曝光條帶。
1.5 細胞增殖能力檢測 采用MTS增殖實驗。胰酶消化轉染24 h后的CSCs細胞計數,以每組(NC組和miR-520f-3p inhibitor組)每孔2 000個細胞接種于96孔板中,每組含6個復孔,輕放至細胞培養箱中培養,細胞完全貼壁后第、1、2、3和4天時每孔向150 μL培養基中加入30 μL MTS工作液,培養箱中孵育2 h,酶標儀于波長490 nm處測取光密度(OD)值。
1.6 細胞轉移能力檢測 采用Transwell小室實驗。胰酶消化轉染48 h后的CSCs細胞計數,無血清培養基洗3次,以每組每孔1×106個/mL細胞、0.1 mL無血清培養基接種于Transwell小室微孔膜上室面, 下室加入0.5 mL完全培養基作為趨化因子,置于培養箱中培養,下室穿過10個細胞時,將聚碳酸酯微孔膜上室面細胞PBS洗掉,微孔膜在甲醇中固定15 min,蘇木素染色。隨機計數顯微鏡下5個視野聚碳酸酯微孔膜下室面的細胞數,取其均值。
1.7 miR-520f-3p靶基因的驗證 采用TargetScan7.1軟件(http://www.targetscan.org/)預測miR-520f-3p的靶基因。CSCs細胞對數生長期時胰酶消化后鋪至96孔板中,分為LDOC1-wt(野生型)與miR-520f-3p mimics共轉染組(LDOC1-wt+miR-520f-3p);LDOC1-wt與NC共轉染組(LDOC1-wt+NC);LDOC1-mut(突變型)與miR-520f-3p mimics共轉染組(LDOC1-mut+miR-520f-3p);LDOC1-mut與NC共轉染組(LDOC1-mut+NC),采用脂質體2000進行各組細胞的轉染,收集轉染48 h的細胞,根據雙熒光素酶報告基因檢測試劑盒說明書檢測各組熒光素酶活性。
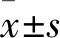
2 結果
2.1 膠質瘤和腦組織中miR-520f-3p表達比較 miR-520f-3p在膠質瘤和正常腦組織中的相對表達量分別為1.23±0.44、0.88±0.30,二者比較,P=0.002。
2.2 膠質瘤組織中miR-520f-3p表達與患者臨床病理特征間的關系 miR-520f-3p在膠質瘤組織中的表達與腫瘤直徑和WHO分級有關(P均<0.05),而與患者性別、年齡、腫瘤完整切除、組織學類型無關(P均>0.05),見表1。

表1 miR-520f-3p在膠質瘤組織中的表達與患者臨床病理特征間的關系
2.3 膠質瘤CSCs的分選與鑒定 利用抗體包被的磁珠從U87細胞培養的腫瘤球分選出CD133+的細胞,無血清培養基中擴大培養后流式細胞儀檢測CD133+率為93.08%,Western blotting檢測OCT4、Nanog和SOX2干性標志蛋白在CD133+細胞中的相對表達量分別為0.36±0.07、0.82±0.09、0.80±0.07,在CD133-細胞中的相對表達量分別為0.18±0.03、0.26±0.05、0.25±0.06,二者比較,P均<0.05。
2.4 miR-520f-3p在膠質瘤CSCs中的表達 qRT-PCR結果顯示,miR-520f-3p在CSCs(CD133+)中的表達(6.15±0.69)高于在U87(CD133-)中的表達(1.00±0.05)(P<0.05);miR-520f-3p inhibitor轉染CSCs,qRT-PCR檢測顯示miR-520f-3p inhibitor組、NC組中miR-520f-3p的相對表達量分別為0.27±0.07、 1.00±0.10,兩組比較,P<0.05。
2.5 干擾miR-520f-3p表達對CSCs細胞增殖的影響 與NC組相比,miR-520f-3p inhibitor組細胞增殖能力減慢(P<0.05),見表2。
2.6 干擾miR-520f-3p表達對CSCs細胞轉移能力的影響 miR-520f-3p inhibitor組和NC組細胞穿膜數分別為(32.58±8.36)、(80.67±10.90)個,兩組比較,P<0.05。
2.7 miR-520f-3p對癌癥亮氨酸拉鏈下調因子1(LDOC1)的靶向調控作用 TargetScan7.1軟件在線預測顯示LDOC1啟動子區有miR-520f-3p的結合位點。進一步雙熒光素酶報告基因試驗結果顯示,與LDOC1-wt+NC共轉染組(1±0.05)相比,LDOC1-wt+miR-520f-3p共轉染組的熒光素酶活性(0.31±0.05)降低(P<0.05);而LDOC1-mut+NC(1.00±0.04)和LDOC1-mut+miR-520f-3p(0.92±0.06)組間的熒光素酶活性無統計學差異(P>0.05)。qRT-PCR結果顯示,與NC轉染組(1.00±0.10)比較,miR-520f-3p inhibitor組CSCs中LDOC1 mRNA表達(5.79±0.73)增加(P<0.05)。

表2 兩組不同時點細胞的OD值比較
3 討論
膠質瘤是成人常見的中樞神經系統腫瘤,惡性程度較高[1]。膠質瘤具有快速生長、浸潤性增長、高復發及抗輻射和化療耐藥等惡性特征,使得膠質瘤患者的預后較差[2],同時有研究發現,膠質瘤對常規化學療法的耐藥可激活致癌信號傳導通路,使其惡性程度更高[11]。近年來,有證據表明膠質瘤在功能上是異質的,即膠質瘤中存在一部分具有一系列干細胞特征的腫瘤細胞,包括干細胞標志物優先表達、自我更新能力增強和多譜系分化潛能,并且其在膠質瘤治療后能夠快速啟動腫瘤生長或重新填充腫瘤組織,這些腫瘤細胞為膠質瘤CSCs,且越來越多的研究表明,膠質瘤的惡性特征與膠質瘤CSCs密切相關[7]。同時,隨著CSCs的培養和分離方法的成熟,使得CSCs成為廣大學者的研究熱點。在白血病、結腸癌等其他腫瘤中已經報道CSCs可以作為化學藥物的靶點抑制腫瘤的生長[12,13]。
研究表明,miRNAs通過表觀遺傳調控機制在膠質瘤的發生發展中發揮關鍵作用[4]。miRNAs是一類小分子非編碼單鏈RNA,長度為19~25個核苷酸,為高度保守的內源性RNA,廣泛表達于各類組織中,miRNAs的異常表達可致多種人類疾病的發生,包括惡性腫瘤[5,6],miRNAs可作為促癌因子和抑癌因子,在腫瘤中表達異常后均可促進腫瘤的惡性生物學行為。同時研究表明,表觀遺傳修飾調節為CSCs重要的調控機制,而miRNAs調控CSCs的報道逐漸增多,miRNAs在調控CSCs的增殖、侵襲和轉移中發揮重要作用[8],miRNAs在膠質瘤CSCs的惡性生物學功能中有重要調控作用。miR-520f-3p是新近發現和鑒定的miRNAs,目前對其研究報道較少,其異常表達會引起疾病的發生。Reed等[14]報道,miR-520f-3p在前驅亨廷頓病患者中表達升高,可作為診斷亨廷頓病的miRNAs生物標志物。Meshkat等[15]在乳腺癌中發現,miR-520f-3p的單核苷酸多態性 rs75598818 GA可降低乳腺癌發病和晚期乳腺癌的風險,rs75598818多態性影響mir-520f莖環的穩定性,miR-520f-3p可能是潛在的腫瘤抑制因子。而miR-520f-3p在膠質瘤組織中的表達及發揮的生物學功能尚不清楚。
本研究結果顯示,miR-520f-3p在膠質瘤組織中的表達高于正常腦組織中,且膠質瘤組織中miR-520f-3p表達與腫瘤直徑和WHO分級有關,表明miR-520f-3p在膠質瘤組織中的表達上調可能促進腫瘤增殖和轉移。Xiao等[10]研究發現,AR / miR-520f-3p / SOX9信號軸通過增加CSCs參與改變肝細胞癌細胞在缺氧條件下對索拉非尼治療的敏感性,提示miR-520f-3p與CSCs相關,因此我們設想在膠質瘤中表達增加的miR-520f-3p可能參與CSCs的干性調控。由于CSCs在腫瘤細胞中只是一小部分,需要經過分離擴大培養后進行研究,目前CSCs的分離方法主要是無血清懸浮培養方法和基于CSCs表面免疫學分子分選方法。無血清懸浮培養方法是利用CSCs具有較強的自我更新能力,而能在添加EGF、bFGF和B-27等生長因子的無血清培養基中生長增殖成腫瘤球,而普通的腫瘤細胞則發生凋亡[16]。同時CSCs表面特異表達一些免疫學分子,利用抗體抗原結合的原理將CSCs從腫瘤細胞中分離出,膠質瘤CSCs表面的免疫學分子標志物主要為CD133[17],本研究則采用上述兩種方法篩選出93.08%的CD133+腫瘤細胞,Western blotting檢測與CD133-瘤細胞相比,CD133+的腫瘤細胞中干性標志蛋白OCT4、Nanog和SOX2的表達顯著升高,證實CD133+的腫瘤細胞為CSCs。而qRT-PCR檢測結果發現,miR-520f-3p在CSCs中的表達高于U87細胞中,與其在膠質瘤組織中的表達具有一致性。進一步采用inhibitor抑制CSCs中miR-520f-3p的表達后,MTS增殖實驗和Transwell實驗結果顯示,抑制miR-520f-3p表達后CSCs增殖和轉移能力均下降,CSCs的生物學特性受抑。
此外,miRNAs通過結合靶基因mRNA的3′端非翻譯區,在基因轉錄后水平以表觀遺傳修飾的方式調控靶基因的表達[7]。因此我們尋找miR-520f-3p的靶基因以進一步研究miR-520f-3p調控膠質瘤CSCs干性的作用機制,但每個miRNA的靶基因可存在數十個到數百個,而TargetScan7.1軟件可在線預測miRNAs的靶基因,我們預測發現,LDOC1的啟動子區有miR-520f-3p的結合位點,可能是miR-520f-3p的靶基因。LDOC1基因位于Xq27,為X連鎖腫瘤抑制因子,編碼146個氨基酸的蛋白質,其在N-末端結構域具有典型的亮氨酸-拉鏈基序,并且富含與SH3結合結構域相似的脯氨酸區域性,LDOC1通過這兩個結構域與各種細胞蛋白相互發揮功能。LDOC1普遍表達于各種組織中,但在宮頸癌、卵巢癌、甲狀腺癌等多種腫瘤中表達下調或沉默,并通過抑制腫瘤細胞增殖和轉移以及誘導細胞凋亡而起到腫瘤抑制劑的作用[18~20]。同時LDOC1是已知的NF-κB轉錄抑制因子[21],熒光素酶報告基因實驗結果顯示LDOC1是miR-520f-3p直接調控的靶基因,而抑制CSCs中的miR-520f-3p表達后,qRT-PCR結果顯示CSCs中LDOC1 mRNA表達增加,表明miR-520f-3p可能通過靶向負調控LDOC1抑制CSCs的生物學特性,具體機制仍需后續研究深入探討。
綜上所述,miR-520f-3p在膠質瘤組織和CSCs中均高表達,且高表達與腫瘤直徑及WHO分級有關;miR-520f-3p可能通過負調控LDOC1增加CSCs的干性。

