外周血NLR及LMR在特發性膜性腎病患者病情評估中的價值
高靜歌,翟亞玲,竇艷娜,劉棟,肖靜,趙占正,劉章鎖,程根陽
1鄭州大學第一附屬醫院,鄭州450052;2鄭州大學腎臟病研究所
近年來,隨著人口老齡化、生活方式的改變和環境污染的加劇,特發性膜性腎病(IMN)發病率呈不斷上升趨勢[1]。IMN是一種抗體介導的自身免疫性疾病。目前,足細胞表面抗原磷脂酶A2受體1(PLA2R1)及含有血小板反應蛋白1型結構域7A(THSD7A)的自身循環抗體被認為在IMN的發展中起重要作用,PLA2R1和THSD7A已作為疾病診斷的生物標志物[2~4]。然而,PLA2R抗體及THSD7A抗體檢測目前價格偏高,僅在國內少數醫院開展,因此,尋找簡單準確的生物標志物顯得尤為重要。中性粒細胞-淋巴細胞比值(NLR)和淋巴細胞-單核細胞比值(LMR)是近年來研究較多的反映機體免疫和慢性炎癥狀態的指標,因其易于檢測而備受關注。NLR及LMR在惡性腫瘤、慢性腎臟病、糖尿病腎病、腎癌、血液透析患者中研究較多,與病情進展及預后密切相關,已被認為是疾病鑒別診斷和預測患者預后的可靠指標[5~9]。最近研究表明,異常的NLR水平與系統性紅斑狼瘡(SLE)、ANCA相關性血管炎、銀屑病、原發性干燥綜合征、白塞病等自身免疫性疾病有關[10~12]。IMN作為免疫和炎癥反應參與的疾病,NLR及LMR水平對其病情評估作用尚不明確。2019年1月,我們探討了外周血NLR及LMR在IMN患者病情評估中的價值。
1 資料與方法
1.1 臨床資料 選取2014年12月~2018年6月收治于鄭州大學第一附屬醫院腎內科、行經皮腎穿刺活檢病理確診為IMN患者902例。病例均結合臨床表現及腎組織光鏡、電鏡、免疫熒光檢查,并排除SLE、乙型肝炎病毒感染、惡性腫瘤、原發性干燥綜合征、類風濕關節炎、其他自身免疫性疾病和藥物、毒物等原因引發的繼發性膜性腎病,明確診斷為IMN。收集患者腎穿刺前所完善的人口學資料及實驗室檢查結果,主要包括性別、年齡、中性粒細胞計數、淋巴細胞計數、單核細胞計數、血肌酐(Scr)、血尿酸(UA)、血尿素氮(BUN)、白蛋白(Alb)、C反應蛋白(CRP)、24 h尿蛋白總量、血抗磷脂酶A2受體(PLA2R)抗體等,根據公式eGFR=175·Scr-1.234·age-0.179·0.79 (如果是女性)[13]計算腎小球濾過率。本研究經鄭州大學第一附屬醫院倫理委員會批準。所有研究對象或其家屬知情同意。
1.2 外周血中NLR及LMR測算 根據收集到的臨床資料結果計算NLR及LMR,計算公式:NLR=外周血中性粒細胞計數(×109/L)/外周血淋巴細胞計數(×109/L);LMR=外周血淋巴細胞計數(×109/L)/外周血單核細胞計數(×109/L)。
1.3 腎組織病理檢查 根據 Ehrenreich-Churg 膜性腎病分期的標準,將IMN分為Ⅰ~Ⅳ期[14]。為便于統計,當介于兩個分期之間時,以高分期為最終分期。計算腎小球硬化率;統計腎小管/間質病變程度(0表示未見明顯病變,1表示灶狀病變,2表示片狀病變,3表示彌漫狀病變);統計血管損傷程度(0表示未見明顯病變,1表示單純血管管壁增厚,2表示除血管管壁增厚外,還合并其他病變,如纖維素樣壞死、玻璃樣病變等);統計腎臟組織免疫球蛋白及補體沉積的熒光強度,IgG及IgG4分為“0”組(染色強度≤+)、“1”組(染色強度++)和“2”組(染色強度≥+++);補體沉積的熒光強度0表示染色強度<+,1表示染色強度≥+。
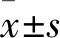
2 結果
2.1 IMN患者不同NLR水平間臨床、病理指標對比 根據NLR中位數(1.95)將患者分為NLR高水平組和NLR低水平組各451例。NLR高水平組男性占比64.5%(291/451),年齡50.00(42.00,61.00)歲,BUN水平為5.11(4.00,6.85)mmol/L,Scr水平為70.00(58.00,81.00)μmol/L,UA水平為(313.43±83.51)μmol/L,Alb水平為(25.26±6.60)g/L,CRP水平為0.92(0.20,1.90)mg/L,24 h尿蛋白總量為4.61(2.56,7.51)g,抗PLA2R抗體水平為36.90(10.80,119.15)pU/mL。NLR低水平組男性占比56.1%(253/451),年齡48.00(37.00,58.00)歲,BUN水平為4.60(3.71,5.70)mmol/L,Scr水平為66.00(55.00,78.00)μmol/L,UA水平為(315.97±83.36)μmol/L,Alb水平為(25.76±6.46)g/L,CRP水平為0.90(0.19,2.72)mg/L,24 h尿蛋白總量水平為4.56(2.26,7.45)g,抗PLA2R抗體水平為33.10(9.50,115.10)pU/mL。相較于NLR低水平組,NLR高水平組男性患者居多、年齡偏大、BUN及Scr水平高(P均<0.05);在病理指標方面,相較于NLR低水平組,NLR高水平組C3在腎組織上沉積多、腎小管/間質病變重(P均<0.05),見表1。

表1 IMN患者NLR不同水平間病理指標對比
2.2 IMN患者不同LMR水平間臨床、病理指標對比 根據LMR中位數(4.30)將患者分為LMR高水平組和LMR低水平組各451例,LMR低水平組男性占比65.2%(294/451),年齡50.00(42.00,61.00)歲,BUN水平為5.10(4.00,6.60)mmol/L,Scr水平為71.00(59.00,82.00)μmol/L,UA水平為(310.55±84.27)μmol/L,Alb水平為(25.16±6.59)g/L,CRP水平為0.90(0.19,2.00)mg/L,24 h尿蛋白總量為4.62(2.52,7.60)g,抗PLA2R抗體水平為34.10(11.50,113.70)pU/mL。LMR高水平組男性占比55.4%(250/451),年齡47.00(37.00,58.00)歲,BUN水平為4.60(3.70,5.88)mmol/L,Scr水平為65.00(55.00,77.00)μmol/L,UA水平為(318.78±85.45)μmol/L,Alb水平為(25.85±6.46)g/L,CRP水平為0.95(0.20,2.53)mg/L,24 h尿蛋白總量為4.56(2.41,7.41)g,抗PLA2R抗體水平為37.20(9.05,130.80)pU/mL。相較于LMR高水平組,LMR低水平組男性患者居多、年齡較大、BUN及Scr水平高(P均<0.05);病理指標方面,兩組間未見統計學差異,見表2。

表2 IMN患者LMR不同水平之間病理指標對比
2.3 IMN患者NLR、LMR與腎小球濾過率的相關性 NLR與腎小球濾過率呈負相關(r=-0.112,P<0.01),LMR與腎小球濾過率呈正相關(r=0.176,P<0.01)。
3 討論
中性粒細胞是宿主防御的重要介質,可產生諸多炎癥介質和細胞因子,并介導自身免疫性疾病的先天和適應性免疫反應[15]。而淋巴細胞作為免疫細胞,參與機體主要的免疫活動。T淋巴細胞通過分泌白細胞介素等多種細胞因子刺激B淋巴細胞增殖和激活,B淋巴細胞則通過介導體液免疫、形成免疫復合物沉積于腎小球上皮細胞下,導致腎小球濾過屏障損傷,參與疾病發生[16]。NLR是一種亞臨床炎癥標志物,已與其他炎癥標志物聯用于自身和非自身免疫性疾病的炎癥檢測[8,10,12]。SLE患者的NLR水平高于正常對照組[9],NLR水平異常與糖尿病腎病、慢性腎臟病、ANCA相關性血管炎、干燥綜合征等的發生發展有關[5,6,8,11]。有文獻[17]指出,在糖尿病腎病中,C3沉積與腎小球濾過屏障受損有關,腎臟損害重、蛋白尿多的患者,可伴隨更多的C3漏出,并沉積于腎臟局部繼發免疫防御反應,進一步加重腎臟損傷;Abe等[18]證實,IgA腎病患者的腎小球固有細胞(系膜細胞、上皮細胞等)可合成C3及其活化產物,并與病理嚴重程度相關。本研究結果顯示,在IMN患者中,NLR高水平組C3在腎組織上沉積更多,腎小管/間質病變更重,NLR水平越高,腎小球濾過率越低,NLR與IMN疾病嚴重程度相關,與以往在其他自身免疫性疾病中的結果相似。
在多發性骨髓瘤中,LMR是患者總生存率(OS)和無進展生存率(PFS)的獨立預測指標,LMR≤4.20的患者OS和PFS均低于LMR>4.20患者;此外,LMR≤4.20患者的血清乳酸脫氫酶、肌酐、鈣和β2微球蛋白水平明顯升高,復發率較高[19]。本研究結果顯示,IMN患者LMR低水平組的BUN及Scr水平高;同時,LMR水平低,腎小球濾過率低。
IMN是一種器官特異性自身免疫性疾病,由自身循環抗體與足細胞表面的自身抗原結合而致病[20];PLA2R1和THSD7A是目前已被公認的兩大靶標抗原[3,4]。但本研究中,并未發現NLR和LMR水平與PLA2R抗體滴度的相關性。作為一種自身免疫性疾病,IMN患者的免疫功能處于紊亂狀態,多種因素參與其中,可能涉及更多機制。
與檢測其他細胞因子相比,NLR和LMR計算方便,成本低。此外,與單個白細胞參數相比,NLR和LMR相對穩定,不容易受到脫水/過量水化、血液樣本稀釋和血液規格的影響,同時被證實可反映IMN患者的病情。本研究存在一定局限性。首先,患者均來自同一個中心。其次,本研究是一項缺乏縱向觀察的回顧性研究,可能受其他因素影響。此外,本研究缺乏預后方面的觀察。
綜上所述,NLR和LMR可作為反映IMN患者病情嚴重程度的參考指標。

