酒用糯高粱EMS突變體庫構建及突變體篩選
丁延慶 曹寧 周棱波 程斌 高旭 汪燦 鄒桂花 張立異


摘要:【目的】利用甲基磺酸乙酯(EMS)構建酒用糯高粱突變體庫,并篩選出田間表型性狀明顯突變的株系,為糯高粱遺傳改良、新品種選育及基因功能研究提供豐富的基礎材料。【方法】采用0.4% EMS對糯高粱品種紅纓子進行誘變處理,M1代單株收獲,并對M2代突變群體開展全生育期的田間表型性狀鑒定,篩選出性狀明顯突變的株系。【結果】經EMS誘變處理后紅纓子M1代突變群體田間存活率降至31.9%,且出現了多種性狀變異,如葉片白(黃)化、葉片畸形、穗畸形、植株矮化和不育等性狀,共獲得M1代突變株系1020個。在M2代突變群體中發現86個突變株系,突變頻率為8.43%。其中,葉色(白化、黃化、芯葉白化、淺綠色、白綠條紋、黃綠條紋)突變株系42個、葉型(畸形葉、卷曲葉和直立葉)突變株系8個、穗型(畸形、小穗和穗缺失)突變株系10個、生育期(早熟和晚熟)突變株系5個、蠟質(蠟質缺失)突變株系4個、感病性(易感病)突變株系4個、育性(完全不育和半不育)突變株系5個及株高(高桿和矮桿)突變株系8個。【結論】構建的酒用糯高粱EMS突變體庫表型變異豐富,可用于高粱功能基因組學研究和酒用糯高粱育種。
關鍵詞: 酒用糯高粱;甲基磺酸乙酯(EMS);突變體庫;構建;表型鑒定;篩選
中圖分類號: S532? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2020)12-2884-08
Abstract:【Objective】A waxy sorghum mutant library was constructed by treatment with the chemical agent ethyl methane sulfonate(EMS),and the lines with obvious trait mutations in field were selected,it provided basic materials for genetic improvement,breeding of new variety,and exploring gene functions of waxy sorghum. 【Method】In this study,Hongyingzi,a waxy sorghum cultivar,was mutated by 0.4% EMS. Each M1 mutant was harvested separately. The phenotype of the M2 mutant population was identified at all-growth stage,and the lines with obvious trait mutations were selected. 【Result】After EMS treatment,the field survival rate of M1 mutant population decreased to 31.9%. Differences were observed between M1 mutant and wild type in phenotypic traits(such as leaf albino,leaf deformity,panicle deformity,plant dwarf and sterility), and a mutant library containing 1020 M1 lines was obtained.? In M2 mutation population, compared to the wild type,a total of 86 individuals had visible phenotypic variation with 8.43% mutation rate. It included phenotypic mutations of 42 leaf color mutant lines(leaf albino,leaf deformity,core leaf albino,light green,white-green stripes and yellow-green stripes),8 leaf type mutant lines(deformed leaf,curled leaf and erect leaf),10 panicle mutant lines(deformed panicle,small panicle and panicle deletion), 5 growth stage mutant lines (early ripening and late ripening),4 wax content mutant lines(wax deficiency),4 disease resistance mutant lines(disease susceptible),5 fertility mutant lines(sterility and semi-sterility) and 8 plant height mutant lines(tall and dwarf). 【Conclusion】Thus,a Hongyingzi mutant library with rich phenotypic diversities was successfully built,which can provide abundant resources for both sorghum functional genomics research and waxy sorghum breeding in the future.
Key words:waxy sorghum; ethyl methanesulfonate(EMS); mutant library; construction; phenotypic identification; screening
Foundation item:National Natural Science Foundation of China(31660400); Science and Technology Plan Project of Guizhou(QKHPTRC〔2018〕5768-01);Youth Project of Guizhou Academy of Agricultural Sciences(QNKYQNJJ〔2018〕76); Open Project of Research Center for Crop Molecular Breeding of Zhejiang(2020KFKT-001)
0 引言
【研究意義】高粱[Sorghum bicolor(L.) Moench]是全球主要的禾谷類作物之一,屬于C4模式作物,具有光合作用率高、耐高溫干旱、耐貧瘠、耐鹽堿等優點。高粱栽培種根據用途可分為飼草高粱、掃帚高粱、甜高粱和籽粒高粱等4種類型,其中又將直漣淀粉含量在5%以下的籽粒高粱稱為糯高粱(汪燦等,2019)。優質糯高粱是釀造茅臺酒和習酒等醬香型白酒的主要原料,對我國區域經濟發展發揮重要作用。目前,醬香型酒用糯高粱種植品種較單一,主栽品種出現嚴重退化,且由于穗型和株型的影響,大部分栽培品種產量難以提高,也不利于實現機械化生產。通過甲基磺酸乙酯(EMS)化學誘變構建表型變異豐富的突變體庫,可為高粱功能基因組學研究及酒用糯高粱新品種選育提供豐富的基礎資源。【前人研究進展】化學誘變劑能誘發作物農藝性狀產生突變,經多年多點的突變體選擇和鑒定及雜交和回交,最終選育出優良作物新品種(尚靜等,2020)。其中,EMS是目前應用最廣泛的化學誘變劑,其原理是通過對作物進行誘變產生點突變和少量的染色體變異,進而達到改良作物特殊性狀的目的(Greene et al.,2003),已廣泛應用于高粱突變體庫的構建,且篩選出一些具有優良性狀的突變體材料。目前,高粱EMS突變體庫的構建主要利用美國高粱品種BTx623。Xin等(2009)利用0.25% EMS誘變BTx623從而構建含1600個株系的突變體庫,并篩選獲得42個褐色中脈突變體,其木質素含量較野生型大幅減少,從而提高了高粱莖稈的適口性和消化率。王春語等(2014)研究表明,當EMS濃度為0.2%,誘變時間為20 h時,BTx623產生的突變類型最多,可獲得葉型、株型、穗型、育性和生育期等性狀突變類型。張會等(2015)從甜高粱能飼一號的EMS誘變群體中篩選獲得生物量、半纖維素和可溶性糖含量顯著提高的3個突變體材料。Jiao等(2016)利用0.1%~0.3% EMS誘變BTx623從而構建含6400個M4株系的突變體庫,篩選到486個包括直立葉、褐色中脈、早熟、穗粒數增加和抗倒伏等性狀的優良突變株系。Addo-Quaye等(2018)采用0.1%~0.3% EMS誘變BTx623從而構建含12000個株系的突變體庫,通過對其中586個突變株系進行深度重測序,快速確定大量真實的SNP變異類型,結合后期的表型鑒定結果,可有效避免假陽性的出現。此外,含有豐富等位基因變異的EMS突變體庫是基因遺傳功能分析的理想資源庫。運用定向誘導基因組局部突變(TILLING)技術,Xin等(2008)從1600株高粱EMS誘變群體中鑒定出2個咖啡酸甲基轉移酶基因突變材料;Chen等(2018b)鑒定出1個由于SbNAB1基因突變導致的分蘗數增多、株高降低和腋芽生出的EMS突變體;Jiao等(2018a,2018b)對1個穗粒數顯著增加的EMS突變體進行遺傳分析,結果發現該表型的改變是由轉錄因子MSD1突變導致;Li等(2018)通過圖位克隆確定高粱脆稈EMS突變體中的突變基因SbBC1,該基因中1個堿基的突變導致突變體莖稈纖維素含量降低,木質素含量增加,從而提高了抗倒伏能力。【本研究切入點】目前高粱EMS突變體庫構建所采用的品種較單一。紅纓子是貴州茅臺酒專用的釀造品種,具有支鏈淀粉含量高、單寧含量較高、籽粒硬度大和種皮厚等符合茅臺酒釀造工藝要求的一系列特點,且作為貴州酒用糯高粱的主栽品種,貴州大部分酒用糯高粱與其具有較近的親緣關系,是我國南方具有代表性的高粱品種之一。經過長期的自然和人工選擇,貴州酒用糯高粱與其他地區(非洲、美國和中國北方)的高粱品種相比在株型和穗型等農藝性狀上具有明顯的遺傳學差異(肖松等,2016;丁延慶等,2019)。但目前鮮見有關紅纓子及與其親緣關系較近的酒用糯高粱品種EMS突變體庫構建及突變體篩選的研究報道。【擬解決的關鍵問題】利用EMS對紅纓子進行化學誘變,創制表型變異豐富的突變體庫,以期改良紅纓子株型、穗型和產量等性狀,為開展調控釀造品質、產量等重要農藝性狀基因的遺傳定位及功能研究提供基礎材料。
1 材料與方法
1. 1 試驗材料
供試材料為酒用糯高粱品種紅纓子,由貴州省農業科學院旱糧研究所保存。EMS、磷酸鹽緩沖液(PBS)和硫代硫酸鈉(Na2S2O3)水溶液均購自北京索萊寶科技有限公司。
1. 2 試驗方法
1. 2. 1 EMS誘導處理 篩選籽粒飽滿,均勻一致的紅纓子籽粒10000粒,在通風櫥中加入含有0.4% EMS的磷酸緩沖液(0.1 mol/L),種子完全被溶液浸沒后,室溫下混合振蕩(50 r/min)處理14 h,誘變結束后加入0.1 mol/L Na2S2O3水溶液對廢液進行中和處理,流水沖洗6 h后吸干水分,最終獲得M1代突變種子。
1. 2. 2 突變群體種植及性狀調查 在貴州農業科學院試驗大田種植紅纓子M1代突變種子,行距60 cm,株距20 cm,常規肥水管理,期間對M1代突變群體的突變情況進行調查鑒定。為提高M2代突變群體的突變頻率,參照Jiao等(2016)的方法,M1代突變植株套袋自交后僅收獲結實率小于30%的單株種子,并進行編號。種植紅纓子M2代突變種子,每個突變株系種植20粒種子,行距60 cm,株距20 cm,常規肥水管理。參照張彬等(2019)的方法,以野生型植株為對照,對M2代突變群體的變異情況進行調查鑒定:每隔3~5 d進行一次田間調查,觀察記錄各突變株系的突變性狀,記錄不同生長時期(幼苗期、拔節期、抽穗開花期和成熟期)的突變特征及類型,統計突變頻率。籽粒成熟后對M2代突變株系進行單株收獲。
1. 3 統計分析
采用Excel 2010進行數據整理分析。田間存活率(%)=出苗數/播種的種子數×100,突變頻率(%)=M2代突變株系/M1代突變群體株系數×100。
2 結果與分析
2. 1 EMS誘變處理結果
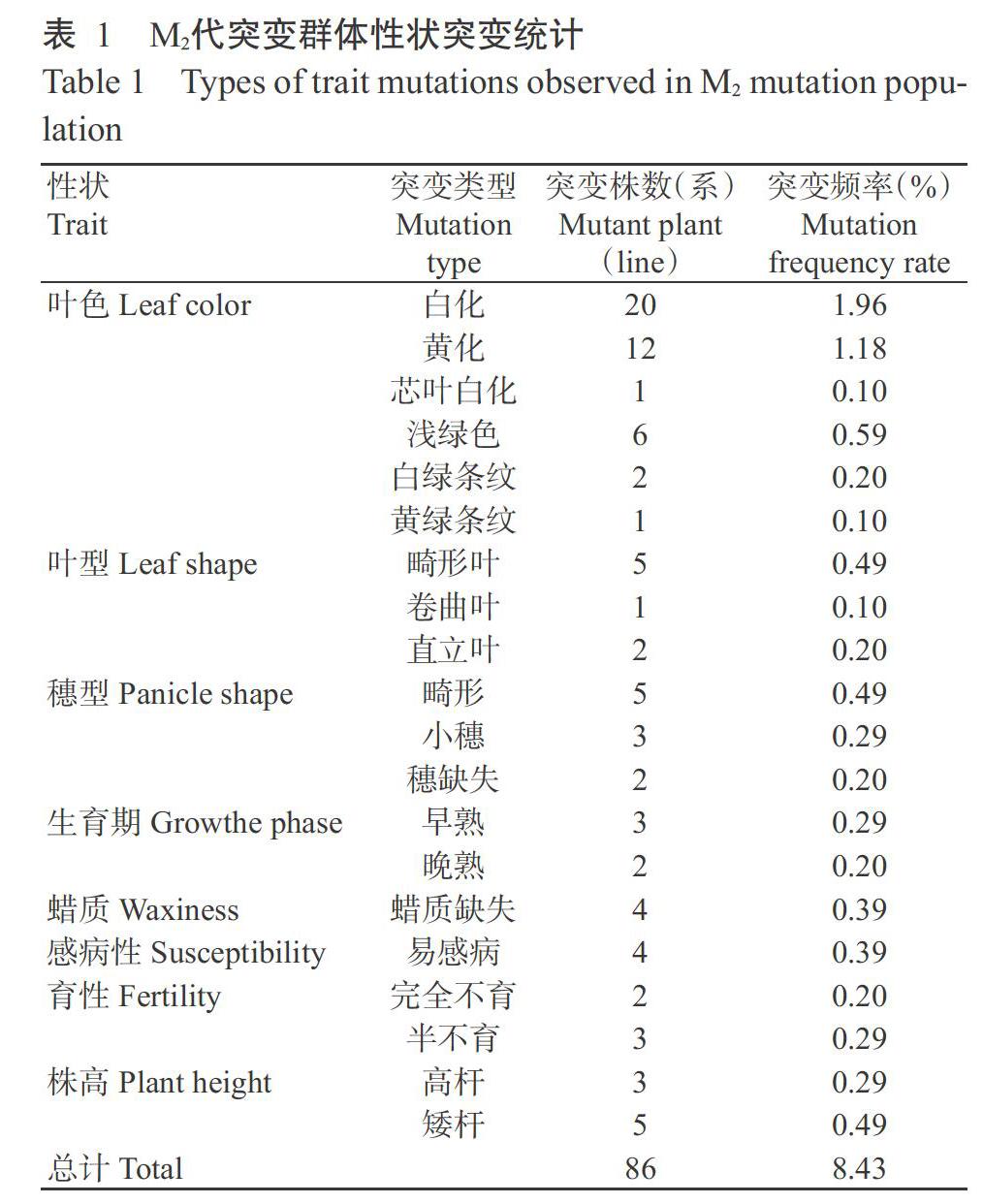
經EMS誘變處理后,紅纓子M1代突變群體田間存活率降至31.9%,且出現了多種性狀變異,如葉片白(黃)化、葉片畸形、穗畸形、植株矮化和不育等性狀,最終獲得結實率小于30%的M1代突變株系共1020個。種植M2代突變群體后,對各株系的表型和田間農藝性狀(葉色、葉型、蠟質、生育期、穗型和育性等)進行調查統計,結果如表1所示。在M2代突變群體中發現86個突變株系,突變頻率為8.43%。
2. 2 葉色突變體分析結果
EMS誘變獲得的紅纓子M2代突變群體中出現6種葉色突變類型,共42個株系。(1)白化突變體:共20個株系在幼苗期時葉片出現白化突變,無法光合作用而逐漸枯萎死亡(圖1-A)。(2)黃化突變體:共12個株系在幼苗期葉片持續黃化,無法轉綠,生長發育一段時間后逐漸枯萎直至死亡(圖1-B)。(3)芯葉白化突變體:僅1個株系在幼苗期時芯葉出現白化現象,無法正常萌發新葉,植株生長一段時間后逐漸枯萎直至死亡(圖1-C)。(4)淺綠色突變體:共6個株系在幼苗期時葉片較野生型淺,呈淺綠色,與白化突變體和黃化突變體相比,葉片中葉綠素含量較多,其中有4個株系從拔節期開始植株葉片逐漸轉綠,至成熟期時與野生型葉片顏色無明顯差異,另外2個株系的突變體葉片在整個生育期內始終保持淺綠色,無轉綠現象發生,但能正常生長發育直至成熟(圖1-D)。(5)條紋葉突變體:共3個株系,根據葉片條紋表型的不同,可分為兩大類,第一類是葉片條紋呈白綠相間(圖1-E),由于葉綠素含量較少,植株無法正常生長抽穗;第二類是葉片條紋呈黃綠相間(圖1-F),植株能存活抽穗直至成熟。
2. 3 葉型突變體分析結果
EMS誘變獲得的紅纓子M2代突變群體中出現3種葉型突變類型,共8個株系。(1)畸形葉突變體:共5個株系葉片較野生型(圖2-A)明顯皺褶卷曲,且植株明顯矮化,大部分植株無法正常生長發育(圖2-B)。(2)卷曲葉突變體:僅1個株系大部分葉片較野生型明顯卷曲下垂,其余性狀與野生型基本一致(圖2-C)。(3)直立葉突變體:共2個突變株系葉片在整個生育期直立上挺生長,且植株較野生型輕度矮化,莖稈節間長度明顯縮短(圖2-D)。
2. 4 穗型突變體分析結果
野生型植株穗型為側散型,抽穗期時穗呈傘狀,成熟期時整穗側向一方下垂生長,平均穗長為35.5 cm(圖3-A)。EMS誘變獲得的紅纓子M2代突變群體中出現3種穗型突變類型,共10個株系。(1)畸形穗突變體:共5個株系穗分支較短,抽穗期時旗葉無法正常展開,穗呈卷曲狀(圖3-B)或不規則散向四周(圖3-C),4個株系出現不育,無法正常結實。(2)小穗突變體:共3個株系穗分支變短,平均穗長僅為10.5 cm,且結實率極低(圖3-D)。(3)穗缺失突變體:共2個株系在幼苗期與拔節期能正常生長,但抽穗期時植株主莖和分蘗均無法正常孕穗,且株高較野生型明顯降低。
2. 5 生育期突變體分析結果
以野生型植株為對照,調查EMS誘變獲得的紅纓子M2代突變群體中各株系生育期(抽穗期和成熟期)的突變情況,結果發現有3個株系提前8~15 d抽穗(圖4-B),為早熟突變體,有2個株系延遲10~15 d抽穗,為晚熟突變體。以籽粒變硬、籽粒大小接近正常作為成熟期標志,經觀察發現早熟突變體成熟期比野生型提前10~15 d,晚熟突變體的成熟期要比野生型延遲約10~20 d。
2. 6 蠟質缺失突變體分析結果
野生型植株莖稈表面有明顯的白色蠟質層(圖5-A),但EMS誘變獲得的紅纓子M2代突變群體中,共有4個株系出現蠟層缺失,在整個生育期內植株莖稈、葉片和葉鞘均無明顯蠟層覆蓋(圖5-B),其中,有3個株系的蠟質缺失突變體在成熟期株高明顯低于野生型,但其他農藝性狀未出現明顯變化。
2. 7 易感病突變體分析結果
128株野生型植株葉片均未出現明顯的感病情況(圖6-A),但EMS誘變獲得的紅纓子M2代突變群體中有4個株系易感病,具體又分為2種類型:第一類突變株系葉片從拔節期開始出現明顯的大塊褐斑,并伴有葉片局部壞死、枯萎現象,大部分葉片顏色與野生型基本一致(圖6-B);第二類突變株系從拔節期開始感病葉片上出現小褐斑,部分葉片上幾乎布滿了褐斑,且葉片顏色較野生型明顯黃化(圖6-C)。
2. 8 育性突變體分析結果
EMS誘變獲得的紅纓子M2代突變群體中出現完全不育突變和半不育突變兩大類,共5個株系。(1)完全不育突變體:共有2個株系穗較野生型(圖7-A)短且稀疏,推測因花粉育性降低而不能結實(圖7-B);(2)半不育突變體:共有3個株系穗結實率較野生型明顯降低(圖7-C)。
2. 9 株高突變體分析結果
野生型平均株高為260 cm。EMS誘變獲得的紅纓子M2代突變群體中,共鑒定到8個株高突變株系,可分為高桿和矮桿2種突變類型(圖8)。(1)高桿突變體:共3個株系株高為341~364 cm,平均為352 cm。(2)矮桿突變體:共5個株系株高為179~192 cm,平均為185 m,較野生型下降28.8%,且部分矮桿突變體的莖節數并未減少,但莖稈節間長度較野生型明顯縮短。
3 討論
EMS作為一種化學誘變劑,已廣泛應用于作物誘變育種中,其誘變原理是與DNA中的堿基發生反應,進而改變基因結構誘發相應的點突變。目前已成功構建水稻(Satoh and Omura,1981)、擬南芥(James and Dooner,1990)、大麥(Caldwell et al.,2004)、番茄(Watanabe et al.,2007)、小麥(Bovina et al.,2014)、黃瓜(Chen et al.,2018a)、玉米(Lu et al.,2018)、馬鈴薯(Somalraju et al.,2018)和谷子(Sun et al.,2019)等植物的EMS突變體庫,篩選獲得許多具有優良性狀的種質資源。目前,相比水稻、玉米和小麥等其他禾本科作物,高粱EMS突變體庫構建所使用品種較單一,針對酒用糯高粱構建其EMS突變體庫的研究鮮見報道。本研究前期試驗發現紅纓子的最適誘變濃度為0.4%,較其他高粱品種(BTx623、晉粱5號和V4B)的最適誘變濃度高,可能與紅纓子籽粒種皮較厚,耐受性高有關(范昕琦等,2020)。此外,由于紅纓子的穗型和株型與其他高粱品種存在明顯差異。因此,本研究中EMS誘變所獲得的穗型和株型突變體也與其他高粱品種的EMS突變體也有所不同,后續可利用這些突變體對紅纓子獨特遺傳變異進行深入研究。
葉色突變體是研究作物光合作用相關機理,如葉綠體生長發育、葉綠素的生物合成、代謝及調控等途徑的理想材料。Zhu等(2019)對高粱野生型和白化致死突變體進行系統地蛋白質組學分析,結果發現,白化突變體中光合作用相關途徑、部分次生代謝產物生物合成及核糖體代謝途徑受到明顯抑制。此外,葉色可作為顏色標記性狀,在作物雜交育種和不育系加代中發揮作用。本研究篩選到芯葉白化突變體、黃化突變體、淺綠突變體、白綠相間條紋突變體和黃綠相間條紋突變體共6種葉色突變體,后續可對這些突變體遺傳機理進行深入研究。
植物表皮蠟質層是其與外界環境交替的最后一道自我防護的防線,可提高植株抗旱、預防病蟲害和抗射線等能力,在植物生存及生長發育中發揮重要的生理學和生態學功能。小麥、高粱、白菜和甘蔗等植物表面覆蓋有一層呈灰白色的蠟質,蠟質缺失會使植物表面的顏色變為亮綠色,肉眼清晰可見。目前,與其他模式植物(擬南芥、水稻和玉米)相比,已克隆的高粱蠟質相關基因較少,僅為高粱蠟質分泌的關鍵基因SbWBC11(Mizuno et al.,2013)、蠟質合成基因SbM39(Uttam et al.,2017)和SbM40(Jiao et al.,2018a)等。但有關高粱蠟質合成、運輸、分泌和轉錄調控途徑尚不清楚。本研究獲得4個蠟質缺失突變體株系,以其為研究對象對深入挖掘蠟質相關基因,探究高粱蠟形成的分子機制具有重要意義。
株高常作為一個重要表型性狀在作物育種中備受關注。目前,已在高粱中定位到多個控制株高的關鍵遺傳位點,其中3個主效基因SbDw1、SbDw2和SbDw3已被成功克隆(Boyles et al.,2019)。由于紅纓子株高較其他品種高,不耐密植,不利于大規模機械化生產,限制經濟效益的提高。本研究共獲得5個矮桿突變株系,今后應以其為研究對象,深入發掘株高相關基因,從而明確其調控機制及突變機理,并利用其培育矮桿糯高粱新品種,改善貴州酒用糯高粱主栽品種單一的現狀,實現增產增收。
突變頻率指某種特定的突變在整個誘變群體中所占的比例。一般情況下,使用的誘變劑劑量越大,則產生某種特定突變的頻率就越高。本研究中高粱紅纓子M2代突變群體的突變頻率(8.33%)比Xin等(2008)構建的高粱BTx623M3代突變群體突變頻率(63.3%)低,可能是由于在M2代突變群體中,突變性狀大多以單株突變方式所表現,出現純合突變株系的概率較小,部分株系還會出現世代分離,且由于環境的影響,部分突變性狀會發生改變,因此需在不同環境中種植,觀察突變性狀的遺傳穩定性。這些是構建EMS突變體庫中需注意的關鍵問題,今后應對突變群體的性狀進行重復鑒定。此外,本研究僅對M2代突變群體中田間表型性狀明顯突變的株系進行鑒定調查,未對籽粒品質(淀粉、單寧、脂肪和蛋白質含量)和抗逆(干旱、鹽和重金屬脅迫)等性狀進行鑒定調查,因此下一步將會針對這些性狀開展系統地鑒定工作,以期獲得更多有利用價值的EMS突變體。
4 結論
構建的酒用糯高粱EMS突變體庫突變類型豐富,可用于高粱功能基因組學研究和酒用糯高粱育種。
參考文獻:
丁延慶,周棱波,汪燦,曹寧,程斌,高旭,彭秋,邵明波,張立異. 2019. 醬香型酒用糯高粱研究進展[J]. 生物技術通報,35(5):28-34. [Ding Y Q,Zhou L B,Wang C,Cao N,Cheng B,Gao X,Peng Q,Shao M B,Zhang L Y. 2019. Research advance in Glutinous sorghum for ma-king sauce-flavor liquor in China[J]. Biotechnology Bu-lletin,35(5):28-34.]
范昕琦,王海燕,聶萌恩,趙興奎,張一中,楊慧勇,張曉娟,梁篤,段永紅,柳青山. 2020. EMS誘變對高粱出苗及農藝性狀的影響[J]. 作物雜志,(1):47-54. [Fan X Q,Wang H Y,Nie M E,Zhao X K,Zhang Y Z,Yang H Y,Zhang X J,Liang D,Duan Y H,Liu Q S. 2020. Effects of EMS mutagenesis on emergence[J]. Crops,(1):47-54.]
尚靜,張會,王圣潔,王小玲,姜守陽,查丁石,吳雪霞. 2020. EMS誘變對茄子種子萌發、幼苗生長和抗氧化系統的影響[J]. 江西農業學報,32(2):33-37. [Shang J,Zhang H,Wang S J,Wang X L,Jiang S Y,Zha D S,Wu X X. 2020. Effects of EMS mutagenesis on seed germination,seedling growth and antioxidant system of eggplant(Solanum melongena)[J]. Acta Agriculturae Jiangxi,32(2):33-37.]
汪燦,周棱波,高旭,張國兵,程斌,曹寧,丁延慶,徐燕,邵明波,張立異. 2019. 基于分型測序技術的粒用高粱遺傳多樣性和群體結構分析[J]. 植物遺傳資源學報,20(3):677-684. [Wang C,Zhou L B,Gao X,Zhang G B,Cheng B,Cao N,Ding Y Q,Xu Y,Shao M B,Zhang L Y. 2019. Genetic diversity and population structure analysis of grain-use sorghum based on genotyping by sequencing technology[J]. Journal of Plant Genetic Resources,20(3):677-684.]
王春語,朱振興,李丹,叢玲,張麗霞. 2014. 高粱EMS誘變及突變體篩選、鑒定[J]. 生物技術通報,30(9):78-83. [Wang C Y,Zhu Z X,Li D,Cong L,Zhang L X. 2014. EMS mutagenesis,mutant screening and identification of sorghum[J]. Biotechnology Bulletin,30(9):78-83.]
肖松,周棱波,張國兵,邵明波,乙引,張立異. 2016. 醬香型白酒用糯高粱種質遺傳多樣性分析[J]. 江蘇農業科學,44(4):45-49. [Xiao S,Zhou L B,Zhang G B,Shao M B,Yi Y,Zhang L Y. 2016. Genetic diversity analysis of maotai-flavor liquor-making waxy sorghum[J]. Jiangsu Agricultural Sciences,44(4):45-49.]
張彬,王喆,陳利青,禾璐,李紅英,喬治軍,韓淵懷. 2019. 糜子EMS突變體庫構建和突變體篩選[J]. 植物遺傳資源學報,20(2):370-376. [Zhang B,Wang Z,Chen L Q,He L,Li H Y,Qiao Z J,Han Y H. 2019. Construction of EMS-treated mutant library and mutant phenotypic analysis in broomcorn millet[J]. Journal of Plant Genetic Resources,20(2):370-376.]
張會,鄒維華,張友兵,張銳,豐勝求,涂媛苑,景海春,彭良才. 2015. 優質能源甜高粱突變體的篩選與鑒定[J]. 華中農業大學學報,34(5):1-6. [Zhang H,Zou W H,Zhang Y B,Zhang R,Feng S Q,Tu Y Y,Jing H C,Peng L C. 2015. Idengtification of sweet sorghum mutants for rich soluble sugars and high biomas enzymatic digestibility[J]. Journal of Huazhong Arricultural University,34(5):1-6.]
Addo-Quaye C,Tuinstra M,Carraro N,Weil C,Dilkes B P. 2018. Whole-genome sequence accuracy is improved by replication in a population of mutagenized sorghum[J]. G3:Genes,Genomes,Genetics,8(3):1079-1094.
Bovina R,Brunazzi A,Gasparini G,Sestili F,Palombieri S,Botticella E,Lafiandra D,Mantovani P,Massi A. 2014. Development of a TILLING resource in durum wheat for reverse- and forward-genetic analyses[J]. Crop and Pasture Science,65(1):112-124.
Boyles R E,Brenton Z W,Kresovich S. 2019. Genetic and genomic resources of sorghum to connect genotype with phenotype in contrasting environments[J]. The Plant Journal,97(1):19-39.
Caldwell D G,McCallum N,Shaw P,Muehlbauer G J,Marshall D F,Muehlbauer R. 2004. A structured mutant popu-lation for forward and reverse genetics in barley(Hordeum vulgare L.)[J]. The Plant Journal,40(1):143-150.
Chen C,Cui Q,Huang S,Wang S,Liu X,Lu X,Chen H,Tian Y. 2018a. An EMS mutant library for cucumber[J]. Journal of Integrative Agriculture,17(7):1612-1619.
Chen J,Zhang L,Zhu M,Han L,Lv Y,Liu Y,Li P,Jing H,Cai H. 2018b. Non-dormant Axillary Bud 1 regulates axillary bud outgrowth in sorghum[J]. Journal of Integrative Plant Biology,60(10):938-955.
Greene E A,Codomo C A,Taylor N E,Henikoff J G,Till B J,Reynolds S H,Enns L C,Burtner C,Johnson J E,Odden A R,Comai L,Henikoff S. 2003. Spectrum of chemically induced mutations from a arge-scale reverse-genetic screen in Arabidopsis[J]. Genetics,164(2):731-740.
James D W,Dooner H K. 1990. Isolation of EMS-induced mutants in Arabidopsis altered in seed fatty acid composition[J]. Theoretical and Applied Genetics,80(2):241-245.
Jiao Y,Burke J J,Chopra R,Burow G,Chen J,Wang B,HayesC,Emendack Y,Ware D,Xin Z. 2016. A sorghum mutant resource as an efficient platform for gene disco-very in grasses[J]. The Plant Cell,28(7):1551-1562.
Jiao Y,Burow G,Gladman N,Acosta-Martinez V,Chen J,Burke J,Ware D,Xin Z. 2018a. Efficient identification of causal mutations through sequencing of bulked F2 from two allelic bloomless mutants of Sorghum bicolor[J]. Frontiers in Plant Science,8:2267.
Jiao Y,Lee Y K,Gladman N,Chopra R,Christensen S A,Regulski M,Burow G,Hayes C,Burke J,Ware D,Xin Z. 2018b. MSD1 regulates pedicellate spikelet fertility in sorghum through the jasmonic acid pathway[J]. Nature Communications,9(1):822.
Li P,Liu Y R,Tan W Q,Chen J,Zhu M J,Lv Y,Liu Y S,Yu S C,Zhang W J,Cai H W. 2018. Brittle Culm 1 encodes a COBRA-like protein involved in secondary cell wall cellulose biosynthesis in sorghum[J]. Plant and Cell Phy-siology,60(4):788-801.
Lu X D,Liu J S,Ren W,Yang Q,Chai Z G,Chen R M,Wang L,Zhao J,Lang Z H,Wang H Y,Fan Y L,Zhao J R,Zhang C Y. 2018. Gene-indexed mutations in maize[J]. Molecular Plant,11(3):496-504.
Mizuno H,Kawahigashi H,Ogata J,Minami H,Kanamori H,Nakagawa H,Matsumoto T. 2013. Genomic inversion caused by gamma irradiation contributes to down regulation of a WBC11 homolog in bloomless sorghum[J]. Theo-retical and Applied Genetics,126(6):1513-1520.
Satoh H,Omura T. 1981. New endosperm mutations induced by chemical mutagens in rice Oryza sativa L[J]. Japanese Journal of Breeding,31(3):316-326.
Somalraju A,Ghose K,Main D,Bizimungu B,Fofana B. 2018. Development of pre-breeding diploid potato germplasm displaying wide phenotypic variations as induced by ethyl methane sulfonate mutagenesis[J]. Canadian Journal of Plant Science,99(2):138-151.
Sun J,Luu N S,Chen Z H,Chen B,Cui X A,Wu J X,Zhang Z G,Lu T G. 2019. Generation and characterization of a foxtail millet(Setaria italica) mutant library[J]. Frontiers in Plant Science,10:369.
Uttam G A,Praveen M,Rao Y V,Tonapi V A,Madhusudhana R. 2017. Molecular mapping and candidate gene analysis of a new epicuticular wax locus in sorghum(Sorghum bicolor L. Moench)[J]. Theoretical and Applied Genetics,130(10):2109-2125.
Watanabe S,Mizoguchi T,Aoki K,Kubo Y,Mori H,Imanishi S,Yamazaki Y,Shibata D,Ezura H. 2007. Ethyl methane sulfonate(EMS) mutagenesis of Solanum lycopersicum cv. Micro-Tom for large-scale mutant screens[J]. Plant Biotechnology,24(1):33-38.
Xin Z,Ming L W,Barkley N A,Burow G,Franks C,Pederson G,Burke J. 2008. Applying genotyping(TILLING) and phenotyping analyses to elucidate gene function in a chemically induced sorghum mutant population[J]. BMC Plant Biology,8(1):1-14.
Xin Z,Wang M L,Burow G,Burke J. 2009. An induced sorghum mutant population suitable for bioenergy research[J]. BioEnergy Research,2(1):10-16.
Zhu L,Wang D P,Sun J S,Mu Y Y,Pu W J,Ma B,Ren F L,Yan W X,Zhang Z G,Li G Y,Li Y B,Pan Y H. 2019. Phenotypic and proteomic characteristics of sorghum(Sorghum bicolor) albino lethal mutant sbe6-a1[J]. Plant Phy-siology and Biochemistry,139:400-410.
(責任編輯 陳 燕)

