藏紅花酸對鏈脲佐菌素誘導的糖尿病大鼠視網膜神經上皮的保護作用
趙永吉,陸 瑩,游志鵬
(南昌大學第二附屬醫院眼科,江西 南昌 330006)
糖尿病性視網膜病變是一種慢性疾病,是人類致盲的主要原因之一,到2010年全球有1.66億人患有糖尿病視網膜病,并且到2030年這一數字會增加到1.9億,每年的新增患者達200萬[1]。糖尿病視網膜病變發病機制之一是線粒體電子傳遞鏈活性氧ROS的增加,它導致視網膜組織損傷加重,使視網膜神經細胞不可逆凋亡[2]。毛細血管內皮細胞及周細胞氧化應激導致的凋亡、炎癥反應以及毛細血管血流動力學的改變都會引起視網膜缺血缺氧,而缺血缺氧是導致視網膜新生血管的重要原因,它會促進毛細血管內皮細胞的遷移和增殖,并使血管內皮細胞間的連接變得疏松[3]。大量研究顯示,蛋白激酶C(protein kinase C,PKC)通路的激活是導致糖尿病性視網膜病變發病的重要原因之一,在缺氧環境中PKC-β的高表達會導致新生血管的形成,同時抑制PKC-β會導致新生毛細血管的減少[4]。
藏紅花酸是藏紅花提取物的主要成分,屬于類胡蘿卜素衍生物,口服藏紅花酸可經小腸快速吸收,并以游離或與葡萄糖醛酸結合的方式存在于血漿中[5]。目前藏紅花酸可治療視網膜缺血/再灌注[6]以及氧化應激而導致的視網膜凋亡[7]并且研究發現其可以抑制視網膜微血管內皮細胞的增殖和遷移[8]。本文探討藏紅花酸對糖尿病視網膜病變的保護作用的機制,對于糖尿病視網膜病變的藥物治療提供新的治療靶點,為進一步的基礎及臨床研究提供可能基礎。
1 材料和方法
1.1 材料
1.1.1實驗動物 ♂ SD大鼠購自南昌大學動物實驗科學部,選用健康♂ SD大鼠體質量約180 g,所有大鼠實驗前均經檢查眼底,無眼部病變。
1.1.2試劑 藏紅花酸購自四川維克奇生物科技有限公司(批號:wkq16041207);鏈脲佐菌素(streptozotocin,STZ)購自美國Sigma公司;兔抗鼠cleaved-caspase-3購自武漢塞維爾生物公司;兔抗鼠一抗PKC-β抗體、羊抗兔二抗IgG抗體、兔抗鼠一抗GAPDH抗體購自美國Abcam公司;TRIzol試劑盒購自全式金生物科技公司、RNA保存液購自武漢博士德生物有限公司、Premix×TaqTM試劑盒、RNase-free water、SYBR?Premix Ex TaqTMII(Tli RNaseH Plus)購自日本TaKaRa公司;其余試劑均為化學分析純。
1.1.3儀器 倒置相差顯微鏡(日本Olympus公司);蛋白凝膠電泳系統美國(Bio-Rad公司);ABI7300實時熒光定量PCR儀(ABI公司);RM2016 型病理石蠟切片機(德國徠卡公司);微量移液器(德國Eppendorf公司);眼科顯微手術器械(南京康華醫療器械有限公司)。
1.2 造模及分組
1.2.1造模 采用STZ建立糖尿病大鼠模型,STZ按4 g·L-1溶解于0.1 mmol·L-1檸檬酸緩沖液(pH 4.0~4.5),注射量為60 mg·kg-1,72 h后取大鼠尾靜脈血,測血糖,當血糖≥16.6 mmol·L-1即為成模大鼠,正常組大鼠將造模藥物換成等量生理鹽水。
1.2.2實驗分組 分4組每組10只大鼠,正常對照組(CON):食道灌胃給0.5% CMC-Na 3 mL;糖尿病對照組(DM):食道灌胃給0.5% CMC-Na 3 mL, DM+藏紅花酸低劑量組[DM+CRO(L)]:經食道灌胃給藏紅花酸50 mg·kg-1,qd.8周, DM+藏紅花酸高劑量組[DM+CRO(H)]:經食道灌胃給藏紅花酸100 mg·kg-1,qd.8周。
1.3 免疫組化石蠟切片脫蠟入水,微波抗原修復10 min,過氧化氫封閉10 min,加3% BSA,室溫封閉30 min,滴加cleaved-caspase-3抗體,置于濕盒內4℃冰箱孵育24 h, 加二抗覆蓋組織,室溫孵育50 min,玻片置于脫色搖床上洗滌15 min后加DBA顯色液,顯微鏡下控制顯色時間,顯色棕黃色為陽性,脫水封片,圖像采集:采用HPIAS-1000高清晰病理彩色圖像分析系統對免疫組織化學染色陽性產物進行分析。記錄6個400倍視野陽性單位(PU),取其平均值,用PU值的大小代表陽性產物表達量的多少。
1.4qRT-PCR引物設計,Bcl-2上游引物5′-AGATCGTGATGAAGTACA-3′,下游引物 5′-TGCTCTCAGGCTGGAAGGA-3′;BAX上游引物 5′-CACCAGCTCTGAACAGATCAT-3′,下游引物5′-CCTCTGCAGCTCCATGTTGT-3′; PKCβ上游引物5′-GAGGTCCTCATCGTTGTTGT-3′,下游引物5′-TGATAGTCTTGGTCTTCTGC-3′;GAPDH上游引物5′-AGTGCCAGCCTCGTCTCATA3-′下游引物5′-GACTGTGCCGTTGAACTTGC-3′。用TRIzol提取RNA并檢測純度,逆轉錄按試劑盒說明進行操作,實時熒光定量PCR按SYBR?Premix Ex TaqTMII試劑盒操作進行,反應條件:預變性;60 ℃,30 s;95 ℃,30 s,95 ℃,3 s; PCR擴增40個循環。反應結束后確認熒光定量PCR的擴增曲線和溶解曲線輸出CT值,按2ΔΔCT數據分析結果。
1.5 蛋白質印跡提取眼球視網膜神經上皮中總蛋白,將配置好SDS-PAGE膠置于電泳槽中,待用蛋白置于水鍋中煮沸5 min后,充分混勻,上樣孔中分別加入Marker及樣品蛋白20 μL,樣品經SDS-PAGE轉移至PVDF膜,用5%脫脂奶粉封閉1 h,洗膜兩分鐘,加入一抗,置于4 ℃冰箱中孵育過夜,用1×TBST溶液洗膜3次,10 min/次,加入稀釋的二抗(1% BSA以1 ∶10 000稀釋),置于水平搖床中,孵育60 min后1×TBST溶液洗膜10 min×3次,后在暗室中進行曝光顯影。
2 結果
2.1 免疫組化染色結果判定免疫組化結果如Tab 1、Fig 1所示,糖尿病大鼠視網膜中凋亡細胞主要存在于神經節細胞層和內核層,藏紅花酸高劑量和低劑量組糖尿病大鼠視網膜內核層及神經節細胞層caspase-3的表達較糖尿病對照組下降,藏紅花酸高劑量處理組較藏紅花酸低劑量處理組caspase-3表達下降。
2.2 qRT-PCR檢測mRNA表達
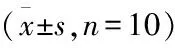
Tab 1 Average optical density of caspase-3 in each group
#P<0.05vsCON,*P<0.05vsDM,△P<0.01vsDM+CRO(L)

Fig 1 Expression of caspase-3 in the innernuclear layer and ganglion cell layer of rats
A=CON,B=DM+CRO(H),C=DM+CRO(L),D=DM(400×)
2.2.1TNF-α mRNA表達 qRT-PCR檢測顯示TNF-α mRNA紅花酸高劑量及低劑量處理組間表達對比無明顯差異,其余各組之間的表達如Tab 2示,與對照組相比差異均有顯著性。
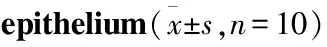
Tab 2 Expression of TNF-α mRNAin rat retinal nerve
#P<0.05vsCON,*P<0.01vsDM
2.2.2Bax mRNA表達 如Tab 3示藏紅花酸高劑量及低劑量處理組大鼠Bax mRNA的表達較糖尿病對照組大鼠下降,藏紅花酸高劑量較低劑量處理組表達下降,差異有統計學意義。
Tab 3 Expression of Bax mRNAin rat retinal nerve
#P<0.01vsCON,*P<0.01vsDM,△P<0.05vsDM+CRO(L)
2.2.3Bcl-2 mRNA表達 如Tab 4示藏紅花酸高劑量及低劑量處理組大鼠Bcl-2 mRNA的表達較糖尿病對照組大鼠升高,藏紅花酸高劑量較低劑量處理組表達升高,差異有統計學意義。
Tab 4 Expression of Bcl-2 mRNAin rat retinal nerve
#P<0.05vsCON,*P<0.01vsDM,△P<0.05vsDM+CRO(L)
2.2.4PKC-β mRNA的表達 如Tab 5示藏紅花酸高劑量及低劑量處理組大鼠PKC-β mRNA的表達較糖尿病對照組大鼠均下降,藏紅花酸高劑量較低劑量處理組表達下降,差異有統計學意義。

Tab 5 Expression of PKC-beta mRNAin rat retinal nerve
#P<0.01vsCON,*P<0.01vsDM,△P<0.05vsDM+CRO(L)
2.3 蛋白質印記的檢測各組PKC蛋白與內參GAPDH 蛋白質印記結果如Fig 2所示,藏紅花酸高劑量及低劑量處理組大鼠PKC的表達較糖尿病對照組大鼠下降(t=4.95,P=0.00),藏紅花酸高劑量較低劑量處理組表達下降,差異有統計學意義(t=5.68,P=0.00)。
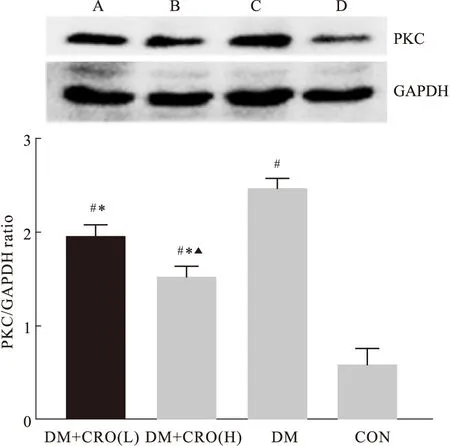
Fig 2 Expression of PKC in rat retinal nerve epithelium
A=DM+CRO(L),B=DM+CRO(H),C=DM,D=CON.#P<0.01vsCON,*P<0.01vsDM,△P<0.05vsDM+CRO(L)
3 討論
PKC廣泛分布于多種組織、器官和細胞,是多功能絲氨酸和蘇氨酸激酶,它控制著糖代謝并參與基因的表達調控,同時PKC的激活是糖尿病視網膜病變發生的重要原因之一[9],本實驗通過蛋白質印跡法檢測大鼠視網膜神經上皮PKC的表達,發現藏紅花酸處理組PKC的表達較糖尿病對照組減少,表明藏紅花酸在糖尿病大鼠中可通過抑制PKC基因和蛋白表達進而對大鼠視網膜神經上皮起到保護作用。
既往有研究發現,藏紅花酸可以抑制視網膜缺血/再灌注損傷,減少視網膜神經節細胞層及內核層細胞的凋亡[10],并且研究還發現藏紅花酸可以抑制caspase-3和caspase-9而保護由H2O2引起的視網膜變性[11],而高糖使視網膜細胞線粒體產生過度氧自由基而導致的糖尿病視網膜產生氧化應激損害[12],本實驗通過免疫組化檢測caspase-3在視網膜神經上皮表達發現caspase-3主要表達在內核層和神經節細胞層,并且藏紅花酸處理組較糖尿病對照組表達降低,藏紅花酸高劑量組較藏紅花酸低劑量組表達下降,這表明藏紅花酸減少糖尿病大鼠視網膜神經上皮細胞的凋亡。研究顯示高血糖同時可以激活視網膜內免疫炎癥反應,使視網膜內免疫炎癥失調,位于視網膜內叢狀層的小膠質細胞是主要的免疫炎癥反應細胞,小膠質細胞激活而產生的各種神經毒性分子如NF-κB和IL-1β[13],并且caspase-3與炎癥因子密切相關,在糖尿病大鼠中細胞外的凋亡系統通常是由TNF-α受體激活,在視網膜血管凋亡時有大量的TNF-α受體激活,該受體的激活導致Bax進入線粒體,導致線粒體的氧自由基增加進一步觸發細胞色素C釋放進入細胞質中,進而caspase-3誘導細胞的凋亡[14]。研究顯示Bcl-2可以減少糖尿病大鼠微血管中血管內皮細胞的損害[15],減少超氧化物的生成,并減少視網膜微血管白細胞的粘附,這些都有利于改善缺血缺氧的損害。本研究顯示,藏紅花酸處理組大鼠TNF-α及Bax較糖尿病對照組下降,而Bcl-2較糖尿病對照組上升,這表明藏紅花酸通過降低TNF-α的表達,減少TNF-α受體的激活減少視網膜內炎癥反應,同時減少Bax基因表達,進而減少凋亡蛋白caspase-3的表達,同時抗凋亡相關基因Bcl-2的增加也減少caspase-3表達,從而減少神經節細胞及內核層細胞的凋亡。
綜上所述,藏紅花酸通過抑制TNF-α、caspase-3的表達,減少凋亡促進基因Bax表達,并提高凋亡抑制基因Bcl-2的表達,進而抑制視網膜中內核層及神經節細胞的凋亡,并且藏紅花酸通過抑制PKC基因和蛋白的表達,減少糖尿病視網膜病變通路之一的PKC通路的激活,從而對糖尿病性視網膜病變起到治療作用。
(致謝:本實驗分別于江西省分子醫學重點實驗室和南昌大學動物實驗科學部完成,感謝江西省分子醫學重點實驗室老師對本實驗的指導。)